方案详情文
智能文字提取功能测试中
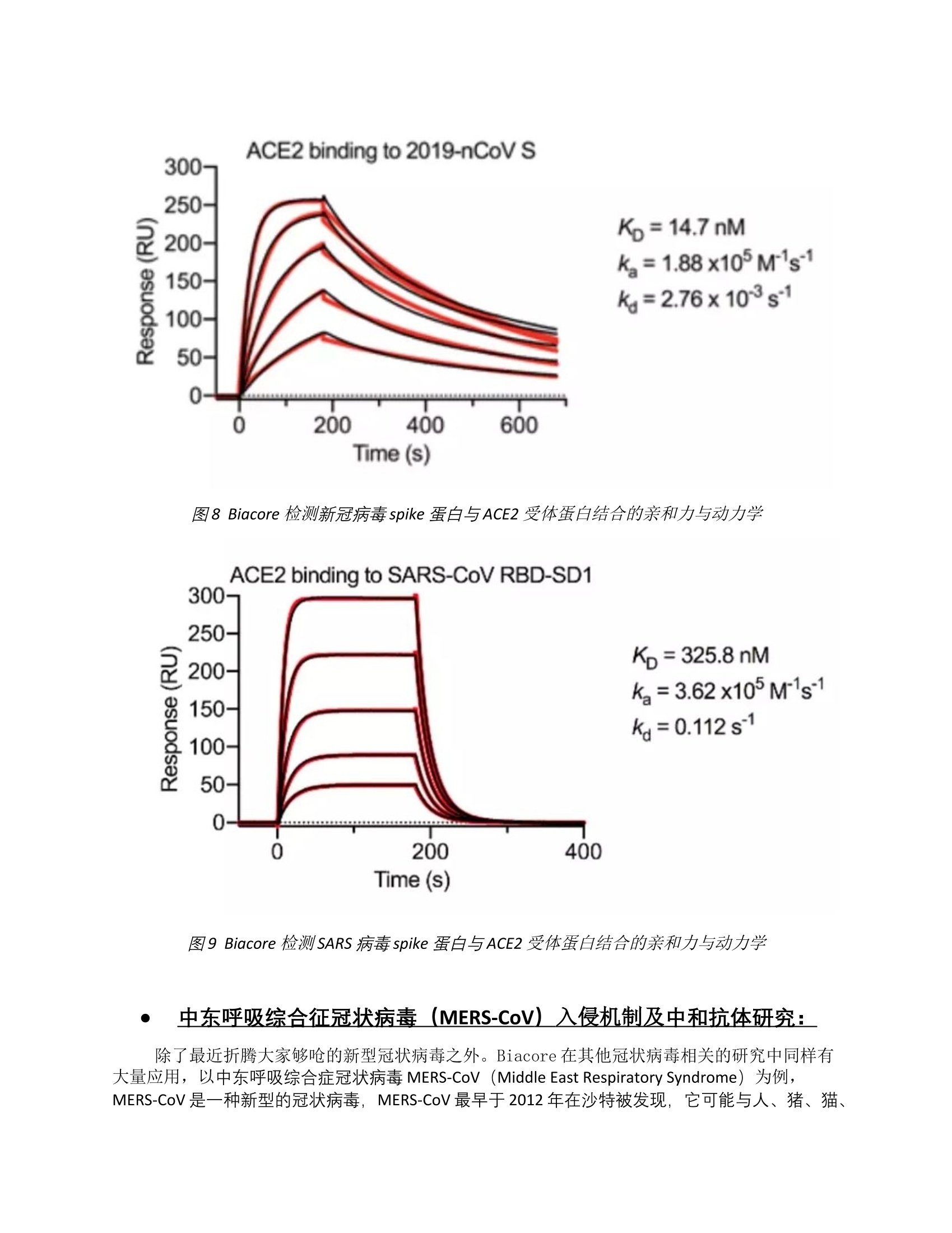
Biacore助力病毒入侵机制研究及治疗性药物研发 从分子层面解读病毒传播及入侵机制,加速科研工作者针对新型冠状病毒疫苗及药物研发 这场突如其来的疫情冲淡了大家过年的热情,它让我们反思,让我们凝聚,希望早日赢得这场“新冠抗疫”的胜利,尽快回归健康平安的日子。2月12日,国际病毒分类委员会的冠状病毒研究小组(CSG)正式将新型冠状病毒从“2019-nCov”更名为“SARS-CoV-2”,CSG表示,根据系统发育学、分类学和惯例,研究人员认为SARS-CoV-2与SARS并不是同一种病毒,但他们关系非常接近。而且已被证实SARS-CoV-2能够在人与人以及城市之间传播,潜伏期更长,传染性更强。专家多次建议针对疫情所有人都需要通过认真监视、主动接触追踪以及对动物宿主和向人类的传播途径进行严格搜索来最大程度地遏制新型冠状病毒的感染机会。除夕当晚,来自全国各地的“白衣天使”,主动请缨无怨无悔的加入了这场没有硝烟的战争,让武汉人民、湖北人民乃至全国人民都感到了莫大的鼓舞与感动。 不仅是白衣天使忘我地奋战在疫情一线,同样来自基础科研的工作者也放弃了假期,放弃了亲人团聚,加快步伐针对这来势汹汹的新型冠状病毒从致病机理以及传播机制进行深入研究。而作为分子互作“金标准”的Biacore一直在病毒传播机制、致病机理及治疗性药物研发上有卓越突破,在此小编就详细为大家介绍Biacore在不同病毒入侵与传播机制以及相应药物研发中的应用,希望借此让大家对病毒有充分的了解,同时助力科研工作者在本次疫情研究中尽快取得突破。 Biacore数据揭示新冠病毒(SARS-CoV-2)为何传染性比SARS强: 首先,我们先说说引发这次疫情的新型冠状病毒SARS-CoV-2,截至到2月17日上午9时,这次疫情已经造成超过7万人确诊,1700多人死亡,危害性远超2003年的SARS疫情。据中国疾控中心等机构研究结果显示,新冠肺炎的基本传染数R0高达3.77,从传染能力上要比SARS病毒强的多。而新型冠状病毒与SARS病毒都是依赖病毒表面的Spike蛋白与细胞表面的血管紧张素转换酶2(ACE2)结合才得以进入细胞,那新型冠状病毒的传染性为什么比SARS病毒强呢? 2020年2月16日,美国德克萨斯大学奥斯汀分校的Jason S. McLellan团队在bioRxiv上发表研究论文,研究人员利用Biacore详细检测了新冠病毒及SARS病毒Spike蛋白分别与ACE2受体的的亲和力。从Biacore检测结果可以明显看出,ACE2蛋白与新型冠状病毒的亲和力要比与SARS病毒的强22倍(如图8、9所示)。而且ACE2蛋白与新冠病毒结合时对应的解离速率(kd=2.76*10-3 s-1)也远远要慢于SARS(kd=0.112 s-1),两者相差了近40倍,说明新冠病毒在受体上的滞留期更长。这就意味着新冠病毒一旦识别细胞表面的ACE2受体蛋白,就会抓住而不“松手”,这就解释了为什么新冠病毒的传染性如此之强。 图8 Biacore检测新冠病毒spike蛋白与ACE2受体蛋白结合的亲和力与动力学 图9 Biacore检测SARS病毒spike蛋白与ACE2受体蛋白结合的亲和力与动力学 中东呼吸综合征冠状病毒(MERS-CoV)入侵机制及中和抗体研究: 除了最近折腾大家够呛的新型冠状病毒之外。Biacore在其他冠状病毒相关的研究中同样有大量应用,以中东呼吸综合症冠状病毒MERS-CoV(Middle East Respiratory Syndrome)为例,MERS-CoV是一种新型的冠状病毒,MERS-CoV最早于2012年在沙特被发现,它可能与人、猪、猫、狗、鼠和鸡的呼吸系统感染相关。世界卫生组织在一份声明中表示,该病暂时感染的大多数是年长者,但不清楚患者是如何感染的,病毒是否来自动物,以及病毒传播范围到底有多广。而在后续研究工作中发现这种病毒与蝙蝠体内的冠状病毒最为接近。 在MERS-CoV病毒的的相关研究中,咱们中国的科学家同样硕果累累,来自中科院微生物所及四川大学的科学家利用biacore详细研究了MERS-CoV病毒的入侵与传播机制;而来自清华大学和复旦大学的研究者则利用不同的方法分别寻找到了高亲和力的中和抗体。 来自清华大学生科院的王新泉教授课题组利用酵母库率先发现了两个高亲和力的中和抗体MERS-4 和MERS-27,Biacore检测结果显示,这些抗体与相应抗原的结合亲和力高达E-10数量级(图6),并且能够有效阻断病毒与相应受体的结合。相关的成果发表在2014年的Science Translational Medicine杂志上。 图6 Biacore检测中和抗体MERS-4 和MERS-27与相应抗原结合的亲和力 而来自复旦大学医学分子病毒学实验室姜世勃团队与美国国立卫生院迪米特罗夫团队合作,利用噬菌体展示技术同样筛选到了对MERS-CoV病毒具有高抑制活性的全人源单克隆抗体(m336)。该成果发表在2015年的Nature communication杂志上。在该项研究中,作者同样利用Biacore来验证m336及其不同点突变蛋白与重组MERS-CoV S1蛋白的结合活性,从分子层面佐证了m336的轻链是其与病毒结合从而发挥中和作用的关键(图7)。 图7 Biacore检测m336及其各突变体与MERS-CoV S1之间的结合 埃博拉病毒入侵分子机制研究: 2014年3月开始,一场以几内亚、利比里亚和塞拉利昂为中心的扎伊尔型埃博拉病毒疫情迅速在整个西非蔓延开来,共导致了28000多人感染,死亡人数接近11000人。2016年1月15日,国际学术期刊Cell 在线发表中国科学院微生物研究所、中国疾病预防控制中心的题为Ebola Viral Glycoprotein Bound to Its Endosomal Receptor Niemann-Pick C1的文章。文章作者首次从分子水平阐释了一种新的病毒膜融合激发机制,这种新型机制与之前病毒学家们熟知的四种病毒膜融合激发机制都大为不同,成为近年来国际病毒学领域的一大突破。该研究同时还为抗病毒药物设计提供了全新靶点。 众所周知,细胞膜上的NPC1分子是埃博拉病毒入侵所必需的,但是NPC1分子如何介导病毒入侵却一直是个未解之谜。在该项研究工作中,Biacore从分子层面揭示埃博拉病毒囊膜表面糖蛋白在内吞体里经过宿主蛋白酶Cathepsin的酶切处理后,暴露出的糖蛋白核心区GPcl与NPC1分子的C结构域(NPC1-C)发生相互作用(如图1: B/ C所示),从而启动后续的病毒膜融合过程,实现病毒的感染。与此相反,病毒囊膜表面未经酶切,糖蛋白核心区GPcl不暴露时,无论是否糖基化修饰,都不与受体NPC1-C结合(如图1: A所示)。 图1. Biacore验证病毒囊膜表面糖蛋白不同结构域与NPC1-C结合 那么到底是NPC1-C分子上哪些关键的氨基酸介导了与病毒糖蛋白核心区GPcl的结合呢?随后研究者们又对NPC1-C上不同位点的氨基酸进行了点突变,并利用Biacore检测了这些不同位点突变的NPC1-C蛋白与病毒糖蛋白核心区GPcl的结合。结果表明,位于NPC1-C蛋白与病毒糖蛋白核心区GPcl结合界面上一些关键氨基酸通过形成两个loop结构介导了两者的结合(图2)。 图2. Biacore验证NPC1-C蛋白序列中与病毒糖蛋白核心区GPcl结合的关键氨基酸 同年五月清华大学颜宁课题组和微生物所合作,利用单颗粒冷冻电镜技术重构了NPC1全长膜蛋白结构,以及NPC1与埃博拉GPcl复合物的电镜结构。结构显示NPC1在去垢剂中以单体形式存在,NPC1的结构和大量的生化分析解释了很多与Niemann-Pick C综合症相关的突变。同时结合Biacore实验数据,还证实了相较于中性pH,在类似于体内溶酶体的低pH条件下,埃博拉病毒GPcl与NPC1有更高的亲和力,并且结构域C的亲和力与GPcl最强,而结构域A与GPcl的亲和力很弱(图3)。NPC1与GPcl复合体结构进一步揭示了结构域C在介导埃博拉病毒入侵中其主导作用,而结构域A和结构域I起到支撑作用。 图3 Biacore验证埃博拉GPcl在不同pH条件与NPC1及其不同结构域的结合 上述两篇cell的文章,详细的阐述了埃博拉病毒入侵人体细胞的机制,并且借助Biacore鉴定了细胞膜表面的受体NPC1上与病毒糖蛋白核心区GPcl结合的关键氨基酸,为后续治疗药物的开发奠定了基础。 基孔肯雅病毒入侵机制研究: 基孔肯雅病毒(Chikungunya virus,CHIKV)是一类可引起发热、皮疹、关节疼痛的蚊虫传播病毒。该病毒病主要分布在热带和亚热带地区。人感染该病毒后可致急慢性的外周关节痛或关节炎,严重时致人死亡。2019年5月9日,中国科学院北京生科院、微生物所与中国科学院天津工业生物技术研究所在国际顶级期刊Cell上发表了题为“ Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope Protein ” 的研究成果,该研究首次从分子水平阐明了基孔肯雅病毒囊膜表面E(CHIKV E)蛋白与其受体MXRA8分子的相互作用,不仅揭示了此类病毒入侵细胞的分子机制,同时为抗病毒药物开发及新型疫苗设计提供了新靶点。 文中作者借助Biacore首先验证了CHIKV E与人源hMXRA8/鼠源mMXRA8均能直接结合,并且亲和力分别为6.02 ± 0.39 μM和3.50 ± 0.86 μM(如图4: A/ B所示)。其次作者将hMXRA8上八个不同位点的氨基酸进行了系列突变,利用Biacore进行结合验证,其中 Q63、D64、E96单突变和E227 / R228双突变,略微降低了hMXRA8对CHIKV E的结合(如图4: E/ F/ I/ K所示)。Y92的单突变部分降低了二者结合的亲和力(如图4: H所示)。 而R69和R98单突变完全破坏了二者的结合(如图4: G/ J所示)。综上结果表明, 不同位点的氨基酸对于二者的互作都有不同程度的贡献,并且这些结果与相应的晶体结构数据完全吻合。最后,Biacore也帮助作者发现了人源hMXRA8内部二硫键的缺失(C144A / C279A或C144S / C279S)同样可以破坏其与CHIKV E的结合(如图4: L/ M所示),从而表明二硫键对于hMXRA8构象的稳定十分重要。 图4 Biacore检测MXRA8与甲病毒E蛋白之间的结合亲和力 在同一期《Cell》中,华盛顿大学医学院科研人员也发表了针对基孔肯雅病毒与其受体MXRA8的相互作用机制的研究成果:Cryo-EM Structure of Chikungunya Virus in Complex with the Mxra8 Receptor。该篇文章也同样采用Biacore技术检测了人源(如图5: B/ C所示)和鼠源(如图5: D/ E所示) Mxra8与 CHIKV VLPs的结合,同样证明了Mxra8 通过类似的机制识别病毒CHIKV蛋白,从而介导病毒的入侵。 图5 Biacore检测MXRA8与CHIKV VLPs之间的结合亲和力 结语 通过以上几个例子不难看出,Biacore不仅可以很好的从分子层面揭示病毒入侵宿主的机制,也可以寻找发现全新的靶点,同时对应中和抗体开发也能给出综合性评价,从而加快治疗性药物及疫苗的研发。 除了上述几个病毒相关例子之外,Biacore在不同禽流感病毒的入侵与传播机制以及相关流感疫苗的研发与定量,在寨卡病毒、乙肝病毒、各种疱疹病毒等的基础研究与治疗性药物研发中都有大量应用,仅国内高校及科研机构发表的高分文章就有数百篇。而就在当下人们最关注的新冠病毒,Biacore除了很好的揭示为什么新冠病毒传染性更强之外,同时还在帮助国内外的许多研究机构与相关企业,加速相关抗体、核酸类、多肽类药物的开发,并且已经发现了一些不错的苗头分子。在这里我们不仅要为广大奋战在一线的医生、护士及科研人员点赞!同时,我们更相信Biacore作为病毒基础研究与药物开发的高效工具,一定能够帮助科研人员加速针对新冠病毒的科研攻关,并尽早研制出针对性的疫苗与药物。 武汉加油,湖北加油,中国加油,Biacore与你们在一起,这场难关我们一起度过! 相关文献出处: Ebola Viral Glycoprotein Bound to Its Endosomal Receptor Niemann-Pick C1 Cell. 2015 Dec; 164(1-2), 258-268 Structural Insights into the Niemann-Pick C1 (NPC1)-Mediated Cholesterol Transfer and Ebola Infection Cell. 2016 Jun; 165(6), 1467-1478 Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope Protein Cell. 2019 Apr. 177, 1-11 Cryo-EM Structure of Chikungunya Virus in Complex with the Mxra8 Receptor Cell. 2019 Apr. 177, 1-13 Potent Neutralization of MERS-CoV by Human Neutralizing Monoclonal Antibodies to the Viral Spike Glycoprotein Science Translational Medicine. 2014 Apr. 6(234), 234ra59-234ra59 Junctional and allele-specific residues are critical for MERS-CoV neutralization by an exceptionally potent germline-like antibody Nature communications. 2015 Sep; ncomms9223 Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation bioRxiv. 2020 Feb 这场突如其来的疫情冲淡了大家过年的热情,它让我们反思,让我们凝聚,希望早日赢得这场“新冠抗疫”的胜利,尽快回归健康平安的日子。2月12日,国际病毒分类委员会的冠状病毒研究小组(CSG)正式将新型冠状病毒从“2019-nCov”更名为“SARS-CoV-2”,CSG表示,根据系统发育学、分类学和惯例,研究人员认为SARS-CoV-2与SARS并不是同一种病毒,但他们关系非常接近。而且已被证实SARS-CoV-2能够在人与人以及城市之间传播,潜伏期更长,传染性更强。专家多次建议针对疫情所有人都需要通过认真监视、主动接触追踪以及对动物宿主和向人类的传播途径进行严格搜索来最大程度地遏制新型冠状病毒的感染机会。除夕当晚,来自全国各地的“白衣天使”,主动请缨无怨无悔的加入了这场没有硝烟的战争,让武汉人民、湖北人民乃至全国人民都感到了莫大的鼓舞与感动。 不仅是白衣天使忘我地奋战在疫情一线,同样来自基础科研的工作者也放弃了假期,放弃了亲人团聚,加快步伐针对这来势汹汹的新型冠状病毒从致病机理以及传播机制进行深入研究。而作为分子互作“金标准”的Biacore一直在病毒传播机制、致病机理及治疗性药物研发上有卓越突破,在此小编就详细为大家介绍Biacore在不同病毒入侵与传播机制以及相应药物研发中的应用,希望借此让大家对病毒有充分的了解,同时助力科研工作者在本次疫情研究中尽快取得突破。Biacore数据揭示新冠病毒(SARS-CoV-2)为何传染性比SARS强: 首先,我们先说说引发这次疫情的新型冠状病毒SARS-CoV-2,截至到2月17日上午9时,这次疫情已经造成超过7万人确诊,1700多人死亡,危害性远超2003年的SARS疫情。据中国疾控中心等机构研究结果显示,新冠肺炎的基本传染数R0高达3.77,从传染能力上要比SARS病毒强的多。而新型冠状病毒与SARS病毒都是依赖病毒表面的Spike蛋白与细胞表面的血管紧张素转换酶2(ACE2)结合才得以进入细胞,那新型冠状病毒的传染性为什么比SARS病毒强呢? 2020年2月16日,美国德克萨斯大学奥斯汀分校的Jason S. McLellan团队在bioRxiv上发表研究论文,研究人员利用Biacore详细检测了新冠病毒及SARS病毒Spike蛋白分别与ACE2受体的的亲和力。从Biacore检测结果可以明显看出,ACE2蛋白与新型冠状病毒的亲和力要比与SARS病毒的强22倍(如图8、9所示)。而且ACE2蛋白与新冠病毒结合时对应的解离速率(kd=2.76*10-3 s-1)也远远要慢于SARS(kd=0.112 s-1),两者相差了近40倍,说明新冠病毒在受体上的滞留期更长。这就意味着新冠病毒一旦识别细胞表面的ACE2受体蛋白,就会抓住而不“松手”,这就解释了为什么新冠病毒的传染性如此之强。图8 Biacore检测新冠病毒spike蛋白与ACE2受体蛋白结合的亲和力与动力学图9 Biacore检测SARS病毒spike蛋白与ACE2受体蛋白结合的亲和力与动力学中东呼吸综合征冠状病毒(MERS-CoV)入侵机制及中和抗体研究: 除了最近折腾大家够呛的新型冠状病毒之外。Biacore在其他冠状病毒相关的研究中同样有大量应用,以中东呼吸综合症冠状病毒MERS-CoV(Middle East Respiratory Syndrome)为例,MERS-CoV是一种新型的冠状病毒,MERS-CoV最早于2012年在沙特被发现,它可能与人、猪、猫、狗、鼠和鸡的呼吸系统感染相关。世界卫生组织在一份声明中表示,该病暂时感染的大多数是年长者,但不清楚患者是如何感染的,病毒是否来自动物,以及病毒传播范围到底有多广。而在后续研究工作中发现这种病毒与蝙蝠体内的冠状病毒最为接近。 在MERS-CoV病毒的的相关研究中,咱们中国的科学家同样硕果累累,来自中科院微生物所及四川大学的科学家利用biacore详细研究了MERS-CoV病毒的入侵与传播机制;而来自清华大学和复旦大学的研究者则利用不同的方法分别寻找到了高亲和力的中和抗体。来自清华大学生科院的王新泉教授课题组利用酵母库率先发现了两个高亲和力的中和抗体MERS-4 和MERS-27,Biacore检测结果显示,这些抗体与相应抗原的结合亲和力高达E-10数量级(图6),并且能够有效阻断病毒与相应受体的结合。相关的成果发表在2014年的Science Translational Medicine杂志上。而来自复旦大学医学分子病毒学实验室姜世勃团队与美国国立卫生院迪米特罗夫团队合作,利用噬菌体展示技术同样筛选到了对MERS-CoV病毒具有高抑制活性的全人源单克隆抗体(m336)。该成果发表在2015年的Nature communication杂志上。在该项研究中,作者同样利用Biacore来验证m336及其不同点突变蛋白与重组MERS-CoV S1蛋白的结合活性,从分子层面佐证了m336的轻链是其与病毒结合从而发挥中和作用的关键(图7)。埃博拉病毒入侵分子机制研究: 2014年3月开始,一场以几内亚、利比里亚和塞拉利昂为中心的扎伊尔型埃博拉病毒疫情迅速在整个西非蔓延开来,共导致了28000多人感染,死亡人数接近11000人。2016年1月15日,国际学术期刊Cell 在线发表中国科学院微生物研究所、中国疾病预防控制中心的题为Ebola Viral Glycoprotein Bound to Its Endosomal Receptor Niemann-Pick C1的文章。文章作者首次从分子水平阐释了一种新的病毒膜融合激发机制,这种新型机制与之前病毒学家们熟知的四种病毒膜融合激发机制都大为不同,成为近年来国际病毒学领域的一大突破。该研究同时还为抗病毒药物设计提供了全新靶点。 众所周知,细胞膜上的NPC1分子是埃博拉病毒入侵所必需的,但是NPC1分子如何介导病毒入侵却一直是个未解之谜。在该项研究工作中,Biacore从分子层面揭示埃博拉病毒囊膜表面糖蛋白在内吞体里经过宿主蛋白酶Cathepsin的酶切处理后,暴露出的糖蛋白核心区GPcl与NPC1分子的C结构域(NPC1-C)发生相互作用(如图1: B/ C所示),从而启动后续的病毒膜融合过程,实现病毒的感染。与此相反,病毒囊膜表面未经酶切,糖蛋白核心区GPcl不暴露时,无论是否糖基化修饰,都不与受体NPC1-C结合(如图1: A所示)。埃博拉病毒入侵分子机制研究: 2014年3月开始,一场以几内亚、利比里亚和塞拉利昂为中心的扎伊尔型埃博拉病毒疫情迅速在整个西非蔓延开来,共导致了28000多人感染,死亡人数接近11000人。2016年1月15日,国际学术期刊Cell 在线发表中国科学院微生物研究所、中国疾病预防控制中心的题为Ebola Viral Glycoprotein Bound to Its Endosomal Receptor Niemann-Pick C1的文章。文章作者首次从分子水平阐释了一种新的病毒膜融合激发机制,这种新型机制与之前病毒学家们熟知的四种病毒膜融合激发机制都大为不同,成为近年来国际病毒学领域的一大突破。该研究同时还为抗病毒药物设计提供了全新靶点。 众所周知,细胞膜上的NPC1分子是埃博拉病毒入侵所必需的,但是NPC1分子如何介导病毒入侵却一直是个未解之谜。在该项研究工作中,Biacore从分子层面揭示埃博拉病毒囊膜表面糖蛋白在内吞体里经过宿主蛋白酶Cathepsin的酶切处理后,暴露出的糖蛋白核心区GPcl与NPC1分子的C结构域(NPC1-C)发生相互作用(如图1: B/ C所示),从而启动后续的病毒膜融合过程,实现病毒的感染。与此相反,病毒囊膜表面未经酶切,糖蛋白核心区GPcl不暴露时,无论是否糖基化修饰,都不与受体NPC1-C结合(如图1: A所示)。 那么到底是NPC1-C分子上哪些关键的氨基酸介导了与病毒糖蛋白核心区GPcl的结合呢?随后研究者们又对NPC1-C上不同位点的氨基酸进行了点突变,并利用Biacore检测了这些不同位点突变的NPC1-C蛋白与病毒糖蛋白核心区GPcl的结合。结果表明,位于NPC1-C蛋白与病毒糖蛋白核心区GPcl结合界面上一些关键氨基酸通过形成两个loop结构介导了两者的结合(图2)。同年五月清华大学颜宁课题组和微生物所合作,利用单颗粒冷冻电镜技术重构了NPC1全长膜蛋白结构,以及NPC1与埃博拉GPcl复合物的电镜结构。结构显示NPC1在去垢剂中以单体形式存在,NPC1的结构和大量的生化分析解释了很多与Niemann-Pick C综合症相关的突变。同时结合Biacore实验数据,还证实了相较于中性pH,在类似于体内溶酶体的低pH条件下,埃博拉病毒GPcl与NPC1有更高的亲和力,并且结构域C的亲和力与GPcl最强,而结构域A与GPcl的亲和力很弱(图3)。NPC1与GPcl复合体结构进一步揭示了结构域C在介导埃博拉病毒入侵中其主导作用,而结构域A和结构域I起到支撑作用。上述两篇cell的文章,详细的阐述了埃博拉病毒入侵人体细胞的机制,并且借助Biacore鉴定了细胞膜表面的受体NPC1上与病毒糖蛋白核心区GPcl结合的关键氨基酸,为后续治疗药物的开发奠定了基础。 基孔肯雅病毒入侵机制研究: 基孔肯雅病毒(Chikungunya virus,CHIKV)是一类可引起发热、皮疹、关节疼痛的蚊虫传播病毒。该病毒病主要分布在热带和亚热带地区。人感染该病毒后可致急慢性的外周关节痛或关节炎,严重时致人死亡。2019年5月9日,中国科学院北京生科院、微生物所与中国科学院天津工业生物技术研究所在国际顶级期刊Cell上发表了题为“ Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope Protein ” 的研究成果,该研究首次从分子水平阐明了基孔肯雅病毒囊膜表面E(CHIKV E)蛋白与其受体MXRA8分子的相互作用,不仅揭示了此类病毒入侵细胞的分子机制,同时为抗病毒药物开发及新型疫苗设计提供了新靶点。 文中作者借助Biacore首先验证了CHIKV E与人源hMXRA8/鼠源mMXRA8均能直接结合,并且亲和力分别为6.02 ± 0.39 μM和3.50 ± 0.86 μM(如图4: A/ B所示)。其次作者将hMXRA8上八个不同位点的氨基酸进行了系列突变,利用Biacore进行结合验证,其中 Q63、D64、E96单突变和E227 / R228双突变,略微降低了hMXRA8对CHIKV E的结合(如图4: E/ F/ I/ K所示)。Y92的单突变部分降低了二者结合的亲和力(如图4: H所示)。 而R69和R98单突变完全破坏了二者的结合(如图4: G/ J所示)。综上结果表明, 不同位点的氨基酸对于二者的互作都有不同程度的贡献,并且这些结果与相应的晶体结构数据完全吻合。最后,Biacore也帮助作者发现了人源hMXRA8内部二硫键的缺失(C144A / C279A或C144S / C279S)同样可以破坏其与CHIKV E的结合(如图4: L/ M所示),从而表明二硫键对于hMXRA8构象的稳定十分重要。在同一期《Cell》中,华盛顿大学医学院科研人员也发表了针对基孔肯雅病毒与其受体MXRA8的相互作用机制的研究成果:Cryo-EM Structure of Chikungunya Virus in Complex with the Mxra8 Receptor。该篇文章也同样采用Biacore技术检测了人源(如图5: B/ C所示)和鼠源(如图5: D/ E所示) Mxra8与 CHIKV VLPs的结合,同样证明了Mxra8 通过类似的机制识别病毒CHIKV蛋白,从而介导病毒的入侵。结语 通过以上几个例子不难看出,Biacore不仅可以很好的从分子层面揭示病毒入侵宿主的机制,也可以寻找发现全新的靶点,同时对应中和抗体开发也能给出综合性评价,从而加快治疗性药物及疫苗的研发。除了上述几个病毒相关例子之外,Biacore在不同禽流感病毒的入侵与传播机制以及相关流感疫苗的研发与定量,在寨卡病毒、乙肝病毒、各种疱疹病毒等的基础研究与治疗性药物研发中都有大量应用,仅国内高校及科研机构发表的高分文章就有数百篇。而就在当下人们最关注的新冠病毒,Biacore除了很好的揭示为什么新冠病毒传染性更强之外,同时还在帮助国内外的许多研究机构与相关企业,加速相关抗体、核酸类、多肽类药物的开发,并且已经发现了一些不错的苗头分子。在这里我们不仅要为广大奋战在一线的医生、护士及科研人员点赞!同时,我们更相信Biacore作为病毒基础研究与药物开发的高效工具,一定能够帮助科研人员加速针对新冠病毒的科研攻关,并尽早研制出针对性的疫苗与药物。武汉加油,湖北加油,中国加油,Biacore与你们在一起,这场难关我们一起度过! 相关文献出处:Ebola Viral Glycoprotein Bound to Its Endosomal Receptor Niemann-Pick C1Cell. 2015 Dec; 164(1-2), 258-268 Structural Insights into the Niemann-Pick C1 (NPC1)-Mediated Cholesterol Transfer and Ebola InfectionCell. 2016 Jun; 165(6), 1467-1478 Molecular Basis of Arthritogenic Alphavirus Receptor MXRA8 Binding to Chikungunya Virus Envelope ProteinCell. 2019 Apr. 177, 1-11 Cryo-EM Structure of Chikungunya Virus in Complex with the Mxra8 ReceptorCell. 2019 Apr. 177, 1-13 Potent Neutralization of MERS-CoV by Human Neutralizing Monoclonal Antibodies to the Viral Spike GlycoproteinScience Translational Medicine. 2014 Apr. 6(234), 234ra59-234ra59 Junctional and allele-specific residues are critical for MERS-CoV neutralization by an exceptionally potent germline-like antibodyNature communications. 2015 Sep; ncomms9223 Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion ConformationbioRxiv. 2020 Feb
关闭-
1/9

-
2/9
还剩7页未读,是否继续阅读?
继续免费阅读全文产品配置单
Cytiva(思拓凡)为您提供《病毒中药物检测方案 》,该方案主要用于其他中生化检验检测,参考标准《暂无》,《病毒中药物检测方案 》用到的仪器有Biacore™ 8K/8K+ 生物分子相互作用分析系统。
我要纠错





