方案详情文
智能文字提取功能测试中
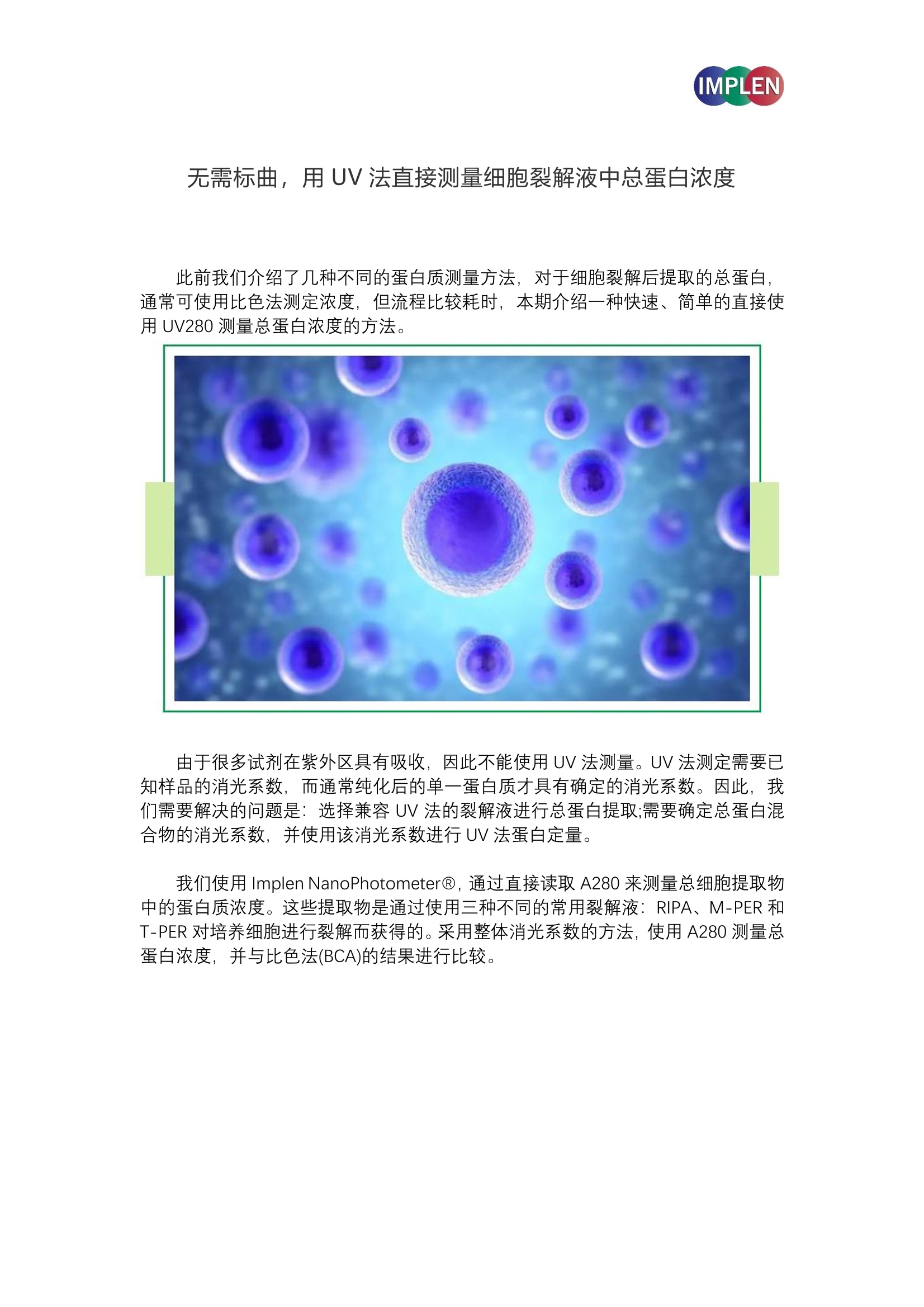
IMPLEN 无需标曲,用UV法直接测量细胞裂解液中总蛋白浓度 此前我们介绍了几种不同的蛋白质测量方法,对于细胞裂解后提取的总蛋白,通常可使用比色法测定浓度,但流程比较耗时,本期介绍一种快速、简单的直接使用 UV280 测量总蛋白浓度的方法。 由于很多试剂在紫外区具有吸收,因此不能使用 UV 法测量。UV 法测定需要已知样品的消光系数,而通常纯化后的单一蛋白质才具有确定的消光系数。因此,我们需要解决的问题是:选择兼容 UV 法的裂解液进行总蛋白提取;需要确定总蛋白混合物的消光系数,并使用该消光系数进行 UV 法蛋白定量。 我们使用 Implen NanoPhotometerQ, 通过直接读取 A280 来测量总细胞提取物中的蛋白质浓度。这些提取物是通过使用三种不同的常用裂解液: RIPA、M-PER 和T-PER对培养细胞进行裂解而获得的。采用整体消光系数的方法,使用A280测量总蛋白浓度,并与比色法(BCA)的结果进行比较。 材料和方法 将 HEK293T 成纤维细胞(ATCC)以250000个细胞/孔的密度接种在12孔板上,加入 DMEM、10%FBS 于 CO2培养箱中生长至汇合。对于免疫印迹实验,使用稳定转染的 HEK293T 细胞衍生物,表达人铁转运蛋白(Fpn)融合绿色荧光蛋白(GFP)。用冷 PBS快速冲洗汇合的细胞层两次,分别添加 150pl的裂解液 RIPA、T-PER或 M-PER(Thermo-Scientific),在存在或不存在蛋白酶抑制剂混合物(cOmplete, Mini,EDTAfree, Roche)的情况下进行裂解,并调整至5mM EDTA 含量。在水平摇床上于40℃下培养30分钟,收集裂解物,转移至1.5ml试管中, 在20000xg下离心15分钟。收集并保存上清液用于蛋白质分析和免疫印迹分析。 蛋白质分析包括直接A280)紫外定量和BBCCAA 比色法分析,使用NanophotometerQ超微量分光光度计的A280蛋白定量法,将每个裂解液中的1.2ul样品施加到测量基座上,在去离子水空白处对每个样品进行三次读数。按照制造商的 BCA 蛋白分析试剂盒((ThermoScientific)的说明,使用 BSA 被用作参考标准来生成蛋白质校准曲线,对蛋白质进行定量分析。在免疫印迹分析中, HEK293T/Fpn-GFP细胞裂解物中的蛋白质通过 SDS 凝胶电泳分离并转移到 PVDF 膜上(BioRadTrans-Blo)。使用5%脱脂奶粉封闭,用兔抗 GFP 一抗孵育,洗涤后与羊抗兔 HRP 结合二抗孵育。用化学发光的 HRP 底物(ThermoScientific Super Signal West Pico)反应发光。 实验结果 裂解液成分的影响 试剂成分在 A280 处影响的验证。RIPA由于其强烈的A280 干扰,不能作为蛋白质直接紫外定量的最佳选择。这是由于 RIPA配方中使用的洗涤剂成分(如 SDS 或NP-408)的较强紫外吸收造成的。同样,一些提取中使用的增溶试剂,如 NDSB 或TritonX-100 也会干扰 A280。相比之下,提取试剂 M-PER 和 T-PER 在远紫外范围内具有吸收, 240nm 处的拖尾吸光度≤0.07,但在280nm 处几乎为零。两性离子洗涤剂 CHAPS, 以及常用试剂(蛋白酶抑制剂)或缓冲液(HEPES)在 280nm 区域没有明显吸收,因此与直接蛋白质紫外吸收法兼容(图1)。这些光谱是使用测试试剂的典型浓度进行的,即1X用于溶解缓冲液和蛋白酶抑制剂,:1mM DTT 或 25 mMHEPES。 图1:细胞裂解常用提取试剂和缓冲液的光谱分析。对勾表示兼容A280法的试剂。 如图2B所示, 将 RIPA 添加到 BSA 液液中会显著干扰其 280nm 区域的吸收信号当。其他洗涤剂如 M-PER或 T-PER 在该区域不会出现任何干扰(图2B)。 直接读取细胞裂解物中的A280数据 在不同的提取液中提取从 HEK293T 总蛋白, 通过 A280 直接测定蛋白质浓度。A280 读数在用 RIPA 制备的裂解液中有明显的变化,误差高达21%(图3A)。而用T-PER 和 M-PER 裂解物的信号具有很高的重现性,无论是否存在蛋白酶抑制剂,实验误差只有1%或更小。 为了排除 RIPA 和其他裂解液在提取效率和蛋白质产量上可能具有较大差异,使用对应的裂解产物的进行 WesternBlot 免疫印迹,结果显示在这些细胞中表达的蛋白质的相对丰度(Fpn-GFP)并不因所使用的提取液种类而发生显著变化(见图3B)。Fpn-GFP融合蛋白条带在所有裂解液中的含量较一致(实际上通过 GAPDH 内参归一化后,在RIPA 样品中略低)。 图3:不同提取缓冲液制备的细胞裂解液蛋白质得率比较。 A280法计算粗细胞裂解液中蛋白质浓度 基于 RIPA不适用于 A280法蛋白定量,仅使用 M-PER 和 T-PER制备的裂解产物。对于A280数据,使用三种不同的参考消光系数,以计算这些裂解产物中的蛋白质浓度(图4)。 当以牛血清白蛋白作为标准品时, T-PER 裂解物中计算的蛋白质浓度为4.72±0.02mg/ml(图4A)。然而,如果假设含有蛋白质粗混合物的 1mg/ml 溶液的总消光系数约为1(OD1),则相同样品的结果为 3.31±0.03mg/ml,这通常用于粗略估 计蛋白质浓度,或进行不同样品间的相对定量。 然而,还可使用细胞中116种常规蛋白质的平均消光系数(Avge),这些蛋白质具有广泛的氨基酸组成和分子量,对于 1mg/ml 的溶液, Avge 约为 1.3(I/g*cm)1,2。应用此参数,得到相同T-PER 裂解物中的计算浓度为2.49±0.03mg/ml (图4A)。尽管在M-PER裂解物中发现了一个稍低的蛋白质浓度,但三个参考标准品之间的相对差异与 T-PER 相同(图4A)。在用 M-PER 或 T-PER 缓冲液提取的两种裂解液中,每组结果具有极微小变化(±1%)和一致性。 BCA 比色法分析 使用比色法(BCA)在相同的T-PER和M-PER细胞裂解液中平行测定蛋白质浓度,T-PER 和 M-PER 裂解产物中的蛋白质浓度分别为1.44±0.02和1.29±0.02mg/ml(图4A),这低于直接A280测量的估计值和理论值。尽管存在 BCA 和直接A280结果之间存在差异,但必须考虑的是,通常添加到裂解缓冲液中的某些试剂会干扰 BCA 分析(例如,洗涤剂或螯合剂,包括 EDTA 和 EGTA)。此外, BCA 分析使用 BSA作为标准参考蛋白质来计算样本中的蛋白质浓度,这意味着假设粗裂解物中的蛋白质在其铜离子络合方面的行为类似于 BSA。 已知 BCA 分析中的显色反应主要受蛋白质中某些氨基酸残基(半胱氨酸、半胱氨酸、酪氨酸和色氨酸)的影响,这些氨基酸残基在每种蛋白质中的代表性并不相同。而基于106种蛋白质Avge 得到的 A280 浓度值更具有代表性。在绝大多数情况下可以直接通过 A280 和 Avge 直接测量总蛋白浓度,对于个别大量表达某种蛋白以至影响了 Avge 平衡的样品,也可以使用 BCA/A280 的方法的比率来推导校正系数。对于T-PER 和 M-PER裂解物样品,基于 BSA、OD1 和 Avge, BCA 比色法与 A280 读数的平均比值分别约为0.32、0.46和0.6(图4C)。 结论 最简单、快速和可靠的的蛋白质浓度定量方法是在 280nm处直接紫外测量。在消光系数已知的溶液中纯化蛋白质的理想情况下,直接 A280 测量的定量精度最大化。使用 T-PER 和 M-PER 作为裂解液提取蛋白质,可直接使用 A280 测定吸光度值, 而 RIPA 裂解液不适用。 直接A280方法的一个实际优势是,如果所有样品均采用相同的提取方案制备,则可以使用高度一致且可重复的方法更有效地处理大量裂解产物样品。该方法快速、简单、成本低,不需要添加任何试剂,只需要极小的样品体积(1ul),即可使用NanophotometerQ进行测量。 根据原理,用于测量蛋白质浓度的比色法分析都需要建立一个反应(例如Bradford、Lowry、BCA)。裂解液中的复杂成分对生色团形成过程的干扰,而导致的 结果偏差是应被考虑的,而使用不涉及任何干预操作的直接紫外A280 方法不仅消除了潜在的样品处理及成分干扰,而且还节省了建立标准曲线所需的时间以及试剂的成本。 使用直接A280法,蛋白质浓度结果将取决于计算所用的参考标准,决定哪一个参考是最合适的取决于每个研究者, 而 Avge 方法的优点是使用根据已知大量蛋白质的整体消光系数进行浓度计算。与比色法(BCA)的比较表明,直接A280测量可以通过转换因子与 BCA分析结果相关联。在需要测量大量细胞裂解液样品中蛋白质浓度的情况下, A280 直接法提供了一个很好的选择。 ( 参考文献: ) ( 1、G r imsley,G. R . and Pace, C.N. (2003) Spectrophotometric determination of protein concentration. Current Protocols i n Protein Science, 3.1.1.-3.1.9 ) ( 2、P a ce,C. N ., Vajdos, F . , F ee, L. , Grimsley, G.an d Gray , T . (1995 ) How to measure andpredict the molar absorption coefficient of a protein. P rot Sci 4, 241-2423 ) Implen GmbH 因普恩((北京)国际贸易有限公司 由于很多试剂在紫外区具有吸收,因此不能使用UV法测量。UV法测定需要已知样品的消光系数,而通常纯化后的单一蛋白质才具有确定的消光系数。因此,我们需要解决的问题是:选择兼容UV法的裂解液进行总蛋白提取;需要确定总蛋白混合物的消光系数,并使用该消光系数进行UV法蛋白定量。 我们使用Implen NanoPhotometer®,通过直接读取A280来测量总细胞提取物中的蛋白质浓度。这些提取物是通过使用三种不同的常用裂解液:RIPA、M-PER和T-PER对培养细胞进行裂解而获得的。采用整体消光系数的方法,使用A280测量总蛋白浓度,并与比色法(BCA)的结果进行比较。直接A280方法的一个实际优势是,如果所有样品均采用相同的提取方案制备,则可以使用高度一致且可重复的方法更有效地处理大量裂解产物样品。该方法快速、简单、成本低,不需要添加任何试剂,只需要极小的样品体积(1µl),即可使用Nanophotometer®进行测量。 根据原理,用于测量蛋白质浓度的比色法分析都需要建立一个反应(例如Bradford、Lowry、BCA)。裂解液中的复杂成分对生色团形成过程的干扰,而导致的结果偏差是应被考虑的,而使用不涉及任何干预操作的直接紫外A280方法不仅消除了潜在的样品处理及成分干扰,而且还节省了建立标准曲线所需的时间以及试剂的成本。 使用直接A280法,蛋白质浓度结果将取决于计算所用的参考标准,决定哪一个参考是最合适的取决于每个研究者,而Avgε方法的优点是使用根据已知大量蛋白质的整体消光系数进行浓度计算。与比色法(BCA)的比较表明,直接A280测量可以通过转换因子与BCA分析结果相关联。在需要测量大量细胞裂解液样品中蛋白质浓度的情况下,A280直接法提供了一个很好的选择。
关闭-
1/9
-
2/9

还剩7页未读,是否继续阅读?
继续免费阅读全文因普恩(北京)国际贸易有限公司为您提供《蛋白质中浓度检测方案(核酸蛋白分析)》,该方案主要用于蛋白质中浓度检测,参考标准《暂无》,《蛋白质中浓度检测方案(核酸蛋白分析)》用到的仪器有超微量分光光度计、高通量超微量分光光度计。
我要纠错
推荐专场
相关方案






 咨询
咨询



