-
+关注
私聊
-

〓疯子哥〓
第11楼2008/01/14
⑺、细胞信号传导
在细胞信号传导中,蛋白质的磷酸化扮演了重要角色。蛋白激酶催化ATP的γ-磷酸转移到底物蛋白苏氨酸、酪氨酸、丝氨酸的羟基上。因为磷酸基团的负电作用而使磷酸化的底物发生构象改变,进而激活了它们的催化活性,作用于下游的靶蛋白。研究蛋白磷酸化的方法有电泳、免疫组织化学以及体外蛋白激酶实验等,但这些方法不能提供足够的蛋白磷酸化和去磷酸化的时间和空间信息。象钙离子、CAMP 、CGMP、二酯酰甘油等第二信使分子已经有人用荧光检测器加以观察并达到了高分辨率的检测效果。Moritoshi Sato 13 等用基因编码的荧光指示器观察了细胞内的蛋白磷酸化现象。他们把一个感兴趣激酶的靶底物domain和一个磷酸化识别domain用一个连接序列连接形成串联融合单位(包括:底物结构域、连接序列、磷酸识别结构域)并与两边的兰色荧光蛋白(CFP)和黄色荧光蛋白(YFP)形成三明治式结构。两种突变GFP可分别充当受体和供体荧光素以引发FRET。底物结构域的磷酸化使之与临近的磷酸化识别结构域结合导致两个荧光素发生FRET,反过来又导致依赖磷酸化的供体和受体荧光发射速率的变化。在磷酸酶的激活作用下,磷酸化底物结构域又能去磷酸化FRET信号随之减弱。这种荧光指示器被称为’phocus’,能更好地反映细胞内激酶信号的传递。如图6所示: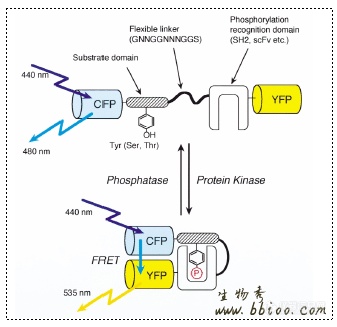
图6:细胞中蛋白磷酸化的荧光指示器’phocus’示意图。’phocus’的底物结构域被激酶磷酸化,临近的磷酸化识别结构域和磷酸化的底物结构域结合,从而使CFP和YFP的距离靠近发生了FRET
-
+关注
私聊
-

〓疯子哥〓
第12楼2008/01/14
⑻、FRET与QD的结合:
Igorl Meclintz23等人用自组装的纳米生物传感器实现了以QD为供体的FRET。多拷贝的大肠杆菌麦芽糖结合蛋白(MBP)以C末端的寡聚组氨酸片段与QD结合。在MBP上有糖结合位点,,传感器在可控制的溶液里自组装而成。有两种构型:一种是在体系中加入β-cydodextrin-QSY9(一种淬灭剂)结合到MBP的糖结合位点,引起了FRET,QD的光亮度减低,而加入麦芽糖后(麦芽糖与MBP的亲和力大于β-cydodextrin-QSY9与MBP的亲和力)竞争性地替换下β-cydodextrin-QSY9后,QD的光亮度又增加了。另一种麦芽糖传感器构型是由QD和Cy3标记的MBP以及β-cydodextrin-Cy3.5组成。这时QD发挥传感器作用是通过两步FRET来完成的,从而克服了QD供体和受体距离的固有限制。这里用了“optical relay station”(加油站)。在复合体中每个530纳米QD供体和10个Cy3标记的MBP分子结合,Cy3的作用是一个桥梁性受/供体,能最大程度地将能量传递给可被麦芽糖替换的结合在MBP糖结合位点的β-cydodextrin-Cy3.5。(该MBP是含有单个半胱氨酸的MBP变异体又称D95C,能位点特异地结合Cy3染料)。用Cy3染料标记的MBP滴定QD时引起QD荧光的减弱以及相应Cy3发射光的增加进而引起β-cydodextrin-Cy3.5发射的增加,表明在三者之间发生了两步FRET。当再加入麦芽糖时,则只有Cy3的发射增加,第二步FRET被阻断。在这些实验中,可得到R0、各竞争性配体的结合常数等有价值的数据。如图7所示
-
+关注
私聊
-

〓疯子哥〓
第13楼2008/01/14
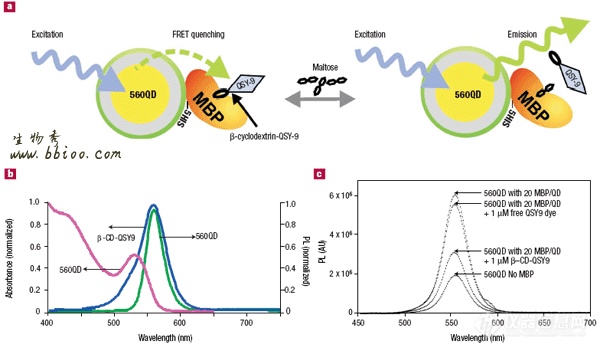
图7:530 QD-MBP-Cy3-®-CD-Cy3.5传感器的功能和性质示意:a表示了530QD-MBP-Cy3-®-CD-Cy3.5 maltose 传感器的结构。一个530-nm QD被大约10个MBP环绕。(只画出了一个)每一个MBP在唯一的cysteine 95位点结合Cy3(最大吸收峰556NM,最大发射峰570NM)在糖结合位点特异结合的CD-Cy3.5(最大吸收峰575NM,最大发射峰595NM),构成完整的纳米传感器。激发QD后由第一步FRET作用MBP-Cy3被激发,它的发射光再由第二步FRET激发CD-Cy3.5,加入麦芽糖后竞争性替换了®-CD-Cy3.5,阻断了第二步FRET,引起Cy3的发射增强。b 530QD-MBP-Cy3-®-CDCy3.5的光谱特性,530 QD 的吸收光谱用品红表示,发射光谱用兰色表示。MBP-Cy3的吸收光谱绿色表示,发射光谱黄色表示。®-CD-Cy3.5的吸收光谱橙色,发射光谱红色。c.530QDs 在MBPD95C-Cy3/未标记的MBP比率逐渐增大时的光谱特征。
除了以上的应用外,FRET还在其他一些方面得到运用,如:实时PCR实验和SNP检测、核酸分子杂交、引物延伸实验检验基因突变、自动基因测序、类脂的转运和分配、膜融合实验和膜电位测定、荧光蛋白酶底物、CAMP指示等多方面的研究。
在FRET技术不断改进的同时,各种有着优异性能的荧光素也相继推出,仅就GFP来说,由GFP到它的各种突变体,如CFP、YFP,到后来的改进的ECFP、EYFP等,最近又有Mark A Rizzo18 等人将ECFP进一步改进为Cerulean,ECFP的缺点是低的量子产率、低淬灭系数和短荧光寿命,只适合于二次幂处理。为提高ECFP在FRET中的性能,他们用位点特异突变的方法将它改进为Cerulean(ECFP/S72A/Y145A/H148D),后者的量子产率大大提高,亮度比ECFP高2.5倍,淬灭系数和荧光寿命也更长了,适合一次幂处理并且提高了信噪比。可以在FRET中发挥更好的作用。
-
+关注
私聊
-

〓疯子哥〓
第14楼2008/01/14
Acknowledgement :
本文所用图片均摘自相关文献
References
1 .Maria-chantal et al Fluorescence resonance energy transfer(FRET) theory and experiments Biochemical Education 26 (1998) 320-323
2 .Marin Peter et al Imaging molecular interactions by multiphoton FLIM .Biology of the cell 96(2004)231-236
3 .FRET tells us about proximities, distances, orientationsand dynamic properties Reviews in Molecular Biotechnology 82 2002 177_179
4 Yin Luo et al Localization of Cys133 of Rabbit Skeletal Troponin-I with Respect to Troponin-C by Resonance Energy Transfer Biophys J, June 1998, p. 3111-3119, Vol. 74, No. 6
5. Xing J, Cheung HC Internal movement in myosin subfragment 1 detected by fluorescence resonance energy transfer Biochemistry. 1995 May 16;34(19):6475-87
6. Erickson JW, Mittal R, Cerione RA Use of resonance energy transfer to determine the proximity of the guanine nucleotide binding site of transducin relative to a conformationally-sensitive site on the gamma subunit of the cyclic GMP phosphodiesterase. Biochemistry. 1995 Jul 11;34(27):8693-700.
7 .Atsushi Miyauaki et al Fluorescent indicatorsfor Ca2+ based on green fluorescent
proteins and calmodulin Nature 388(882-887)(1997)
8 .Kervin Truong et al FRET-based in vivo Ca2+ imaging by a new calmodulin-GFP fusion molecule Nature Structural biology 8 1069-1073(2001)
9 Miyawaki A et al Nature 388 882-887(1997)
10 Heim R Tsien R Y Curr.biol 6.178-182(1996)
11 .Ormo M et al Science .273 .1392-1395 (1996)
12 .Tomasz Heyduk. Ewa Heyduck Molecular beacons for detecting DNA binding proteins Nature biotechnology 20 .171-176(2002)