-
+关注
私聊
-
第12楼2005/06/29
TOCSY,NOESY的crossing peaks太多,确实不好辨认,建议用selective TOCSY,
NOE差谱.
我记得你在讨论NOE差谱时曾交流过你的经验,这时候不是可以用上了吗?祝您好运.
其实有时候"风水来回转",1D谱解决不了的问题,要做2D,由于化合物的原因,有些2D谱也不好分清楚,又要转到1D谱.不过此1D非彼1D,而是1D selective TOCSY和1DNOE差谱等,这要根据图谱的具体情况选用合适的脉冲实验.
您说:如果有一些肽中脯氨酸顺反异构的化学位移文献做参考就方便多了.那的确是.要亲自参考原文献,找出自己所需要的数据才最放心.
参考意见啦.liusky 发表:是的,从很多脯氨酸的NMR来看,他的同碳上的两氢是不等同的。由于现在做的一些大环肽化合物,其中某些脯氨酸H的位移大大脱离了正常范围,只是猜测是不是一些脯氨酸在这些大环中出现了顺反异构。当然理论上顺反异构是可以从NOESY判断出来的,不过分子过于复杂,TOCSY,NOESY的crossing peaks太多,以前用的500MHz的仪器峰的重叠很严重,现在用700之后可以区分峰的归属,但是判断顺反仍然不足。如果有一些肽中脯氨酸顺反异构的化学位移文献做参考就方便多了。
-
+关注
私聊
-

第15楼2005/07/04
其实你这么孤立地说cis- trans 是有人不理解。你想说的这种cis trans是特指在蛋白质或多肽中的情况,即形成肽键后Pro的N-Ca的取向。如下图所示
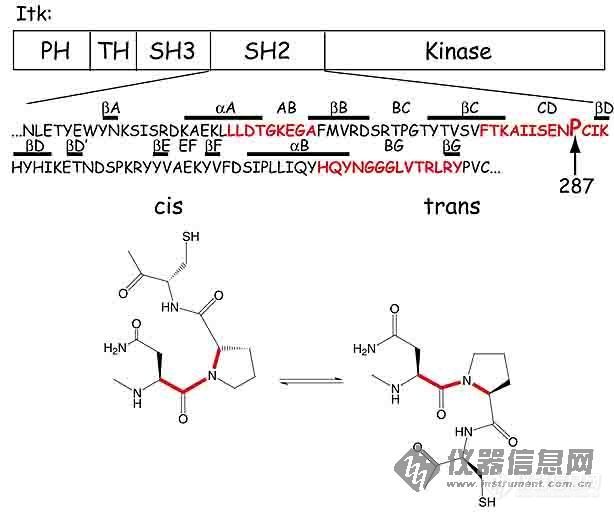 (对不起,发言太少,声望太低,可直接去下面地址看:(http://www.bioscience.org/2005/v10/af/1536/figures.htm)。在蛋白质中多数情况下Pro以trans出现,但在少数情况也会出现cis的,这会导致蛋白质的不同构象,通常都隐含着功能上的不同。这篇文章(http://gepard.bioinformatik.uni-saarland.de/html/Cell_SimulationsSS05/SuggestedReadingV4/V4-Mallis_NSB02.pdf)就是讲的这个问题)。cis和trans会导致不同的构象,当然会影响到相应的化学位移,不单是本身的,更重要的是邻近残基的,如果2种构象同时存在,在15N-1H HSQC中会看到部分2套峰。
(对不起,发言太少,声望太低,可直接去下面地址看:(http://www.bioscience.org/2005/v10/af/1536/figures.htm)。在蛋白质中多数情况下Pro以trans出现,但在少数情况也会出现cis的,这会导致蛋白质的不同构象,通常都隐含着功能上的不同。这篇文章(http://gepard.bioinformatik.uni-saarland.de/html/Cell_SimulationsSS05/SuggestedReadingV4/V4-Mallis_NSB02.pdf)就是讲的这个问题)。cis和trans会导致不同的构象,当然会影响到相应的化学位移,不单是本身的,更重要的是邻近残基的,如果2种构象同时存在,在15N-1H HSQC中会看到部分2套峰。