本文整理 LCMSMS和LCMS定量分析 的几个问题,以及LCMSMS定量分析的实例供大家了解!
Q:本人现在用三重四级杆LCMSMS定量分析目标物,但是没有标准品。内标法该具体怎么操作呢?资料说先配制一定重量比的待测组分和内标样品的混合物做色谱分析,测量峰面积,做重量比和面积比的关系曲线,此曲线即为标准曲线,如果这样的话,没有标准品怎么办?
方法一:
1、内标法进行定量分析,同样需要待测物标准品。如果没有待测物标准品就不能准确测量其含量,因为无法绘制标准曲线。
2、没有待测物标准品不能准确测量其含量,但可以通过加入内标的方法测量待测物的相对含量,可以比较待测物在各样品中的多少及相差倍数。
3、用LCMSMS做定量一般都采用MRM的扫描方式,你没有待测物标准品,就无法建立和优化MRM扫描的质谱参数,这样你只能使用FULL SCAN或SIM的扫描方法。没有待测物标准品,你也无法准确得到待测物在LC上的保留时间,如果你的样品中有与待测物相似质量数的化合物,你得到的色谱峰就不会很纯净,会对你判定那个是你的待测化合物产生干扰。
方法二:没有标准品,就只用面积相对定量。然后选用LCMSMS的SIM模式(样品杂质比较少,选择同位素丰度为100/100的分子量,上下增减0.2)。考察因素导致的量的改变比较微量,选择一种物质为回收率指示物(反应液前处理前加入),一种物质为内标物(前处理后、液相小瓶中进样测试前,在待测样品中加入定量的内标物,然后进行测试)。
Q:请问液质联用中质谱跑出来用于定性的图谱是什么样的,既然是用质谱来进行定量的话,那色谱本身配置的紫外检测器跑出来的图谱用于何用?液质联用有SIM和全扫描的,那么一般在药物代谢动力学试验中一般用哪一种呢?尤其是在对体内药物分析时,内标法用于定量的质谱图是什么样的?
质谱定量分析,使用的一般是LCMS/MS,不使用LCMS, 看一下质荷比,推测下分子量。UV可以用来定量,但是在有紫外吸收的干扰峰的时候,定量是不准的。LCMS/MS使用母离子/子离子来进行定量,相对来说,干扰要少的多,也比较准确,在PK/TK的应用很广泛。这里只有LCMS/MS定量的谱图,仅供参考!
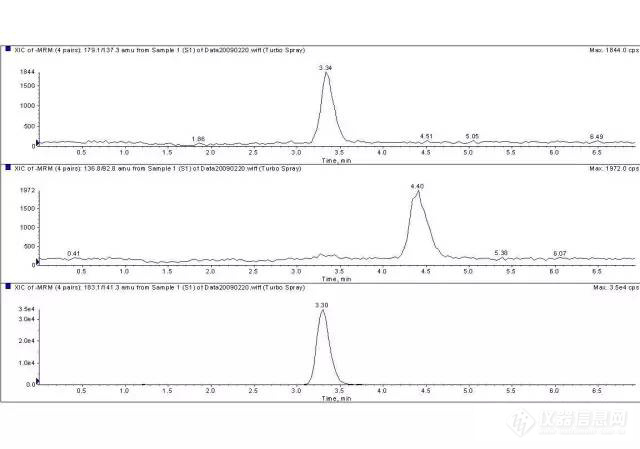
183.1/141.3 通道的是内标,其他的两个是化合物。
质谱定量中已经被广泛接受的方式是MS/MS定量。这种定量常通过三级四极杆或离子阱质谱实现。要求使用MS/MS的原因是:许多化合物有同样的质量。当使用Di一个维度即单级质谱MS去定量时,也会缺乏特异性,尤其是对于像血液那样的复杂的基质。Di二个维度的MS(即MS/MS)在大多数情况下,能够提供wei一的断裂。合并特异的母离子质量和wei一的碎片离子信息,可以选择性地监测被定量的化合物。
我想用LC-Q-TOF-MS 来做代谢组学,因为是样品是体液含有多种化合物,想加入内标后先进行一个相对的定量来判断含量发生变化的化合物,怎样去定量?用总离子流图好像不合适,如果利用峰面积进行相对定量的话,用哪个图比较合适?得用标准品才能定性吗?
LCMSMS定量分析使用SIM 或MRM模式。公认的MRM更为准确。SIM使用Q选择性的滤过选中的分子量。但是分子量相同的化合物很多,所以,如果样品稍微复杂的话,SIM基本不合适。
MRM选择母离子和子离子。使用Q过滤母离子,q 轰击母离子,TOF过滤子离子,使子离子被检测器检测到。分子量相同,轰击后产生的子离子不一样的干扰离子就被排除了。所以,MRM模式是更为可靠的LCMS定量分析方法。MRM检测是离子对。
内标的选择原理是结构基本和待测化合物类似。结构相同或类似,主要是为了满足被离子化的效率与样品类似。这就是为什么很多都选择使用该化合物或此类化合物的氘代化合物。内标的选择还要求其分子量与待测物质不重合(还需要尽量避开化合物的isotopic peak的m/z),并且可以和待测物质分开。
如果使用MRM, 样品被分开的话,那么理论上来说总离子流图上的每个峰都是代表一种物质。同时使用MRM模式,如果样品们的分子量与子离子不重叠,那么,即使在柱子中不被分开的化合物,也是可以认为在MS中被分开了。
文献报道的液质中几个峰,MRM检测到几十个物质就是多个物质在同一时间从色谱柱跑出来了。虽然出峰时间一样,但是每个化合物的peak应该是软件中可以显示出来的,只不过报道中由于篇幅有限,会被简略掉。
定性的话,需要标品,retention time 需要一致。
定量的话,需要先作标准曲线。peak area ration vs concentration.
自动进样器的常规维护保养方法
【最终季特惠】全自动顶空进样器 限时优惠
【最终季促销】岛津 UV3600 紫外可见近红外光谱仪
电感耦合等离子体质谱联用技术


关注

拨打电话

留言咨询