
2020年您是不是奉旨宅家了呢?有没有贴春夏秋冬膘?体检过后突然发现身边一群小伙伴患了肝浸润?也许很多人会认为,只要不饮酒那么自己的肝脏就不会有多大损伤。那当然是No, No, No~
脂肪在肝细胞中堆积到一定量时,非酒精性脂肪性肝(NAFLD)就出现了。相对于酒精性肝病来说,NAFLD的发病率正以惊人的数目增长着,80%的肥胖患者患有NAFLD,而BMI指数正常的人群中也有16%的人患有此病。

NAFLD目前尚缺有效的治疗方法,动物模型是研究NAFLD发病机制以及新药开发的重要平台。遗传和环境因素在肥胖的发生中起重要作用,饮食是诱导肥胖及相关代谢疾病的主要环境因素之一。下面小编就分享几款饮食诱导的NAFLD动物造模案例吧~
【 高脂饮食(HFD) 】
HFD诱导动物NAFLD与人类NAFLD发病机制接近,可引起增重、肥胖、胰岛素抵抗等。但在实验过程中,造模时间较长,症状较轻。与MCD相同喂养时间里,只能诱导温和的脂肪变性和炎症。此外,不同品种和性别的实验动物可能会对模型的建立造成影响。HFD模型诱导小鼠肝脂肪并不一定是线性增长,可能出现先降低后增长的现象。

正常喂食小鼠(图左),HFD喂食小鼠(图右)
案例一:C57BL/6J 小鼠+HFD[1]

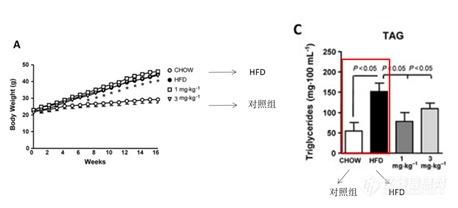

但与NAFLD人类疾病患者常伴胰岛素抵抗、肥胖等代谢综合征不同,该模型诱导动物通常伴随体重下降,且不具备胰岛素抵抗。因此,难以将该模型得到的动物发病机制延伸到人类发病机制中去。









不同方法制备的脂肪肝动物模型的表型和形成机制各异,应尽量选择与人类NAFLD相似、方法简单、成功率高、动物死亡率低、造模时间短和重复性好的实验模型。
MP Biomedicals 拥有超过50年的定制经验,饲料配方丰富,原料严格把控,产品新鲜制作,可为客户定制任何饲料的公司。文中提到的非酒精性脂肪肝病动物模型并非详尽无遗,如果您的研究需要用到定制配方,欢迎来电咨询我们。
【 订购信息 】

注:常用包装规格为10kg、20kg、50kg,上述表中均为10kg的饮食诱导非酒精性脂肪肝造模相关产品货号。带 * 的产品分常规款和辐照款可供选择,MP Biomedicals也可根据您的要求定制。
相关文献
1.Flores-CostaR, Alcaraz-Quiles J, Titos E, López-Vicario C, Casulleras M, Duran-Güell M,Rius B, Diaz A, Hall K, Shea C, et al. The soluble guanylate cyclase stimulatorIW-1973 prevents inflammation and fibrosis in experimental non-alcoholicsteatohepatitis. Br J Pharmacol 2018;175(6):953–67.
2.Weltman MD, Farrell GC, Liddle C. Increased hepatocyte CYP2E1 expression in arat nutritional model of hepatic steatosis with inflammation. Gastroenterology.1996; 111:1645–53.
3.SvendsenP, Graversen JH, Etzerodt A, Hager H, Roge R, Gronbaek H, Christensen EI,Moller HJ, Vilstrup H, Moestrup SK. Antibody-directed glucocorticoid targetingto CD163 in M2-type macrophages attenuates fructose-induced liver inflammatorychanges. Mol Ther Methods Clin Dev 2017;4:50–61.
4.Wolf MJ, Adili A, Piotrowitz K, Abdullah Z, Boege Y, Stemmer K, Ringelhan M,Simonavicius N, Egger M, Wohlleber D, et al. Metabolic activation ofintrahepatic CD8+ T cells and NKT cells causes nonalcoholic steatohepatitis andliver cancer via cross-talk with hepatocytes. Cancer Cell 2014;26(4):549–64.
【促销】不能错过的11月大促!
新品发布|磁珠法土壤基因组DNA提取试剂盒,满足高通量提取应用
【开学促销】快给你的实验动物造模武装起来吧~
新品预告| SPINeasy系列上新:水样DNA,组织&细菌DNA“提取利器”
相关产品

关注

拨打电话

留言咨询