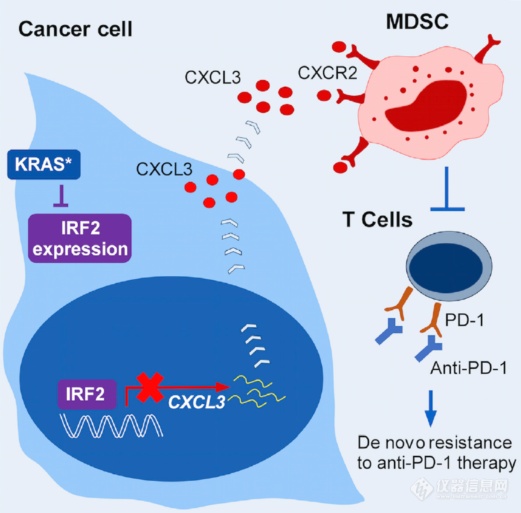
针对实体瘤肿瘤免疫疗法受限主要来源于两点:1、免疫细胞进入实体瘤微环境受限;2、肿瘤免疫抑制的微环境。此次整理分享的文章发现了免疫抑制细胞MDSC(起免疫抑制作用)进入结肠癌肿瘤微环境的机制,具体内容如下:
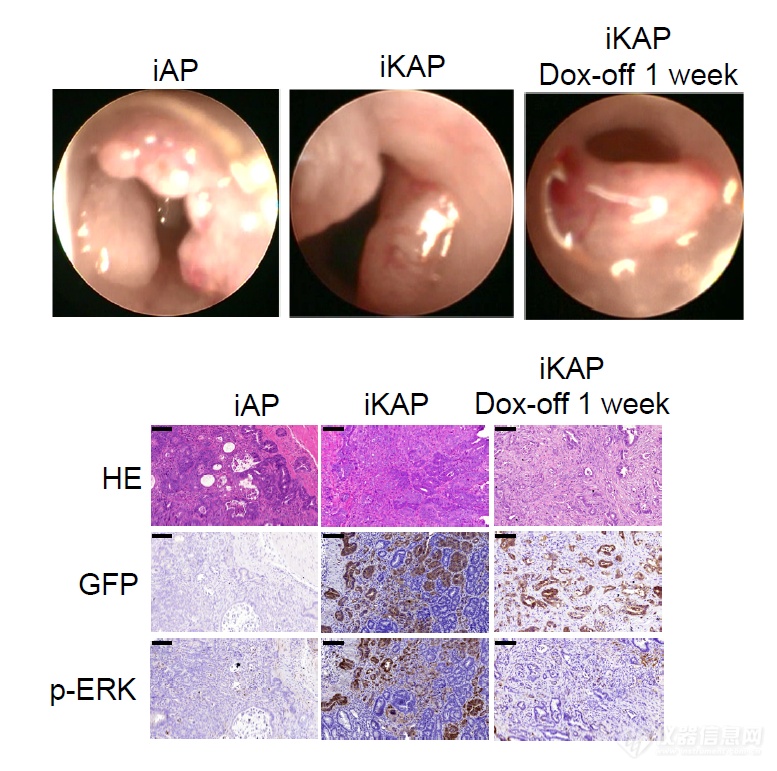
先造模,作者想研究KRAS突变(G12D)对肿瘤免疫的影响,设立了两组:iAP组-未突变结肠癌,iKAP组-Dox诱导KRAS突变的结肠癌(GFP是诱导突变时导入的报告分子)。镜检和组织切片反映两类肿瘤细胞在小鼠体内生长进度相当,iKAP组由于用Dox诱导了突变所以IHC结果会有GFP(报告分子)及p-ERK(MRAS下游)阳性
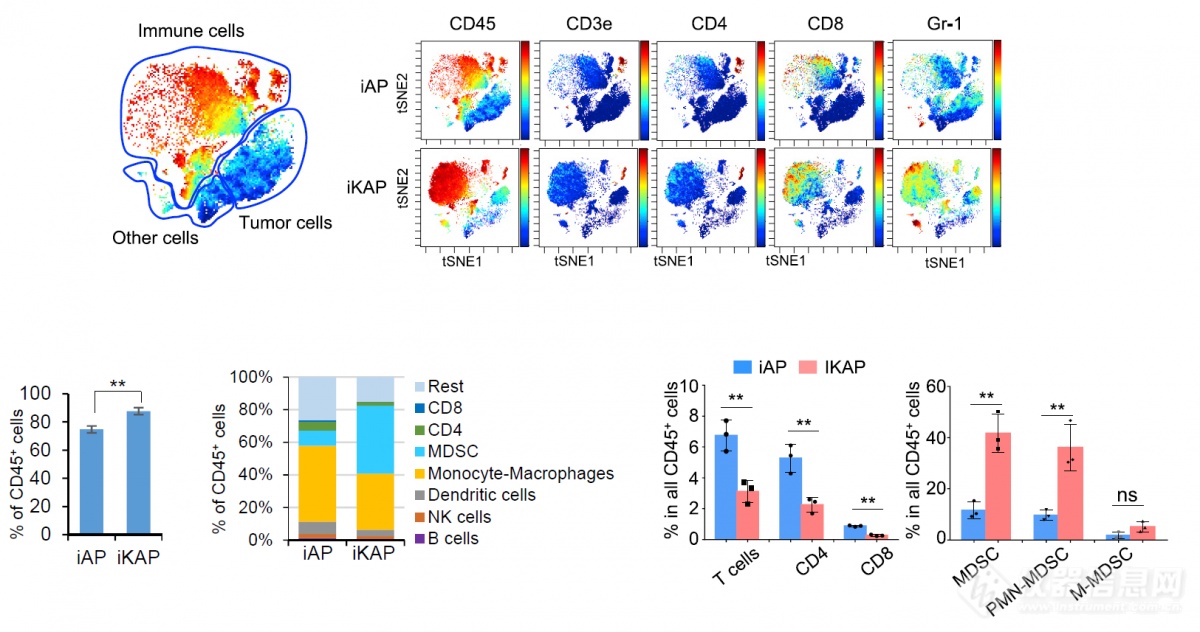
分别取两组小鼠肿瘤,分析免疫细胞组成,发现iKAP组(KRAS突变)免疫细胞总体浸润高于iAP组,T细胞浸润较少,而MDSC浸润显著高于iAP组,暗示KRAS突变和MDSC、T细胞浸润存在相关性
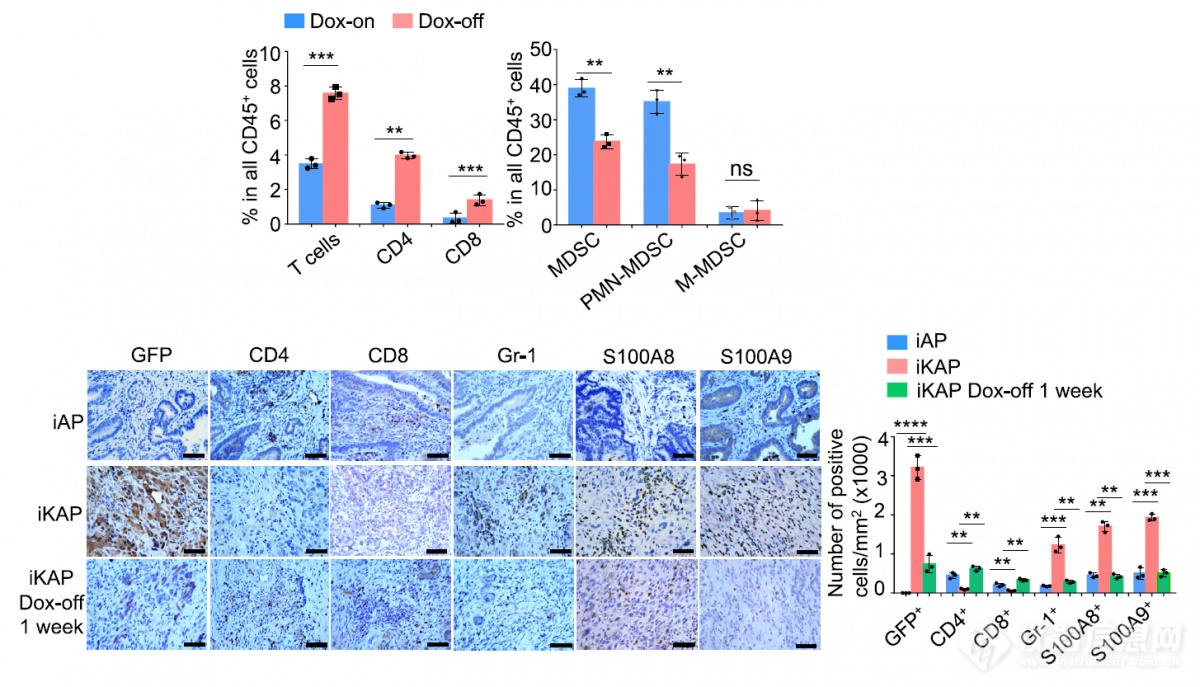
撤去Dox一周后,KRAS突变消失(IHC图上GFP不再表达),T细胞浸润增加,MDSC浸润减少,再次暗示KRAS突变会抑制T细胞浸润、促进MDSC浸润(流式、IHC两种方法确认)
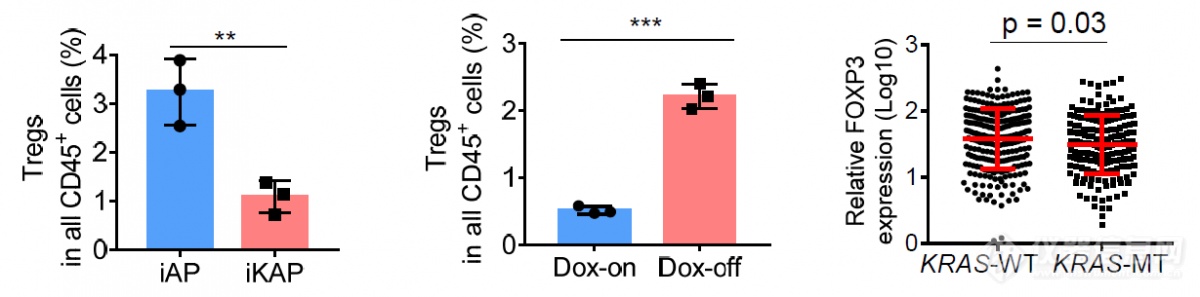
T细胞中Treg和MDSC一样发挥免疫抑制的作用,KARS突变后进一步分析Treg发现Treg浸润也减少,突变消失后Treg浸润恢复。在TCGA数据库里挖掘数据发现,在人结肠癌上KRAS突变后Treg浸润也会减少,暗示KRAS突变肿瘤中MDSC是发挥免疫抑制作用的细胞
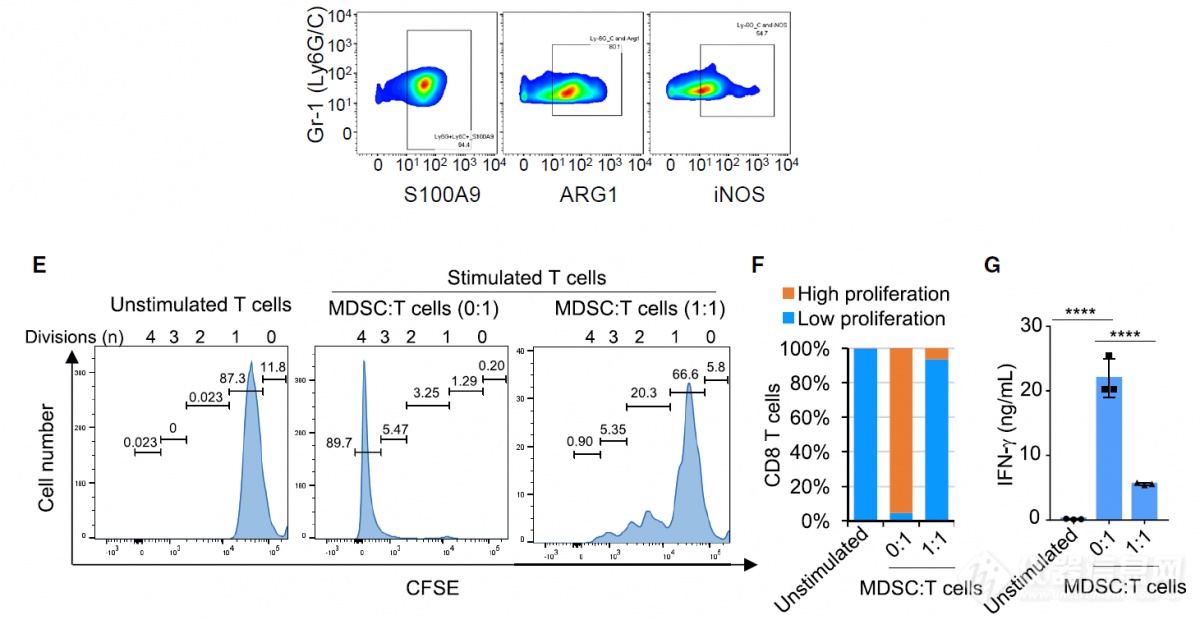
MDSC高表达免疫抑制性分子ARG1和iNOS,会抑制T细胞增殖、分泌IFN-γ
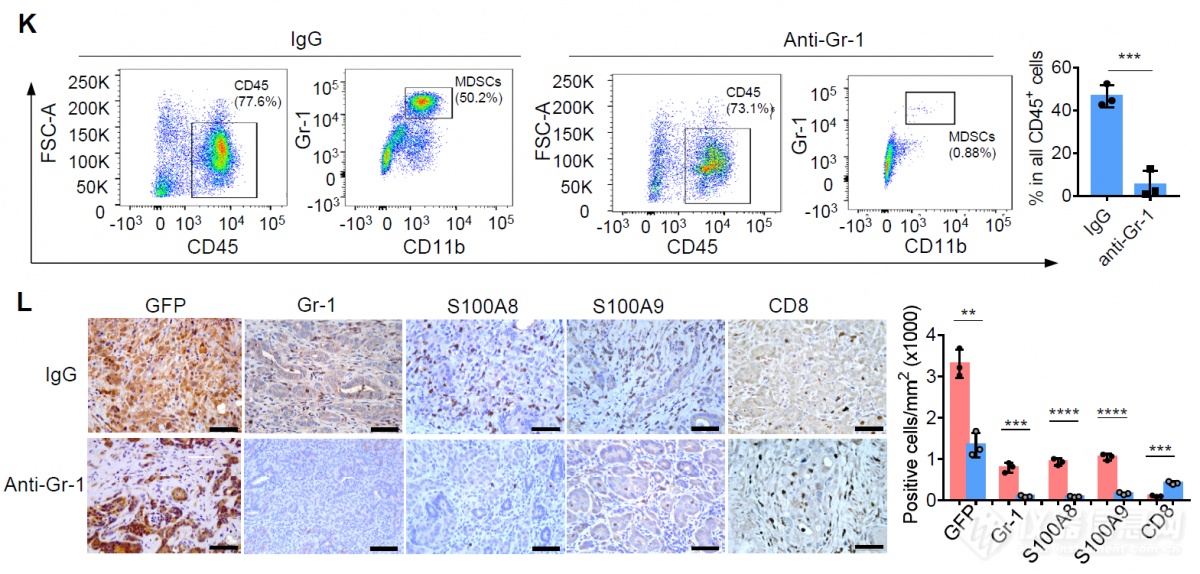
正着看完MDSC可以抑制T细胞后又反着看:抗体敲除MDSC后T细胞浸润增加
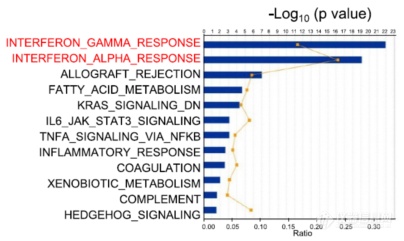
上面的数据充分说明KRAS突变会引起MDSC浸润增加,进而抑制T细胞浸润、增殖、发挥效应,那KRAS突变通过什么对MDSC产生的影响呢?作者选用ingenuity pathway analysis (IPA) of RNA sequencing (RNA-seq) profiles这种基因组学大数据方法比对KRAS突变后肿瘤细胞自身信号通路的变化:发现KRAS未突变组iAP IFN-γ及IFN-α通路高于iKAP组
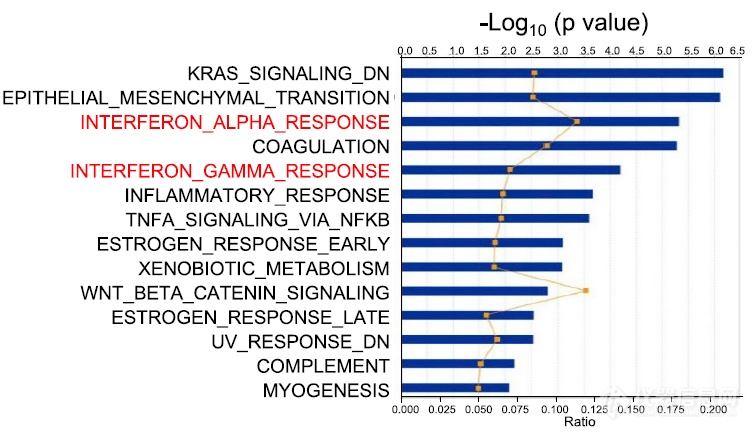
iKAP组撤去Dox后对RNA测序结果进行IPA分析(由于撤去了Dox,KRAS突变消失,会有一些通路发生上调),发现IFN-γ及IFN-α通路在KRAS突变消失后上调明显
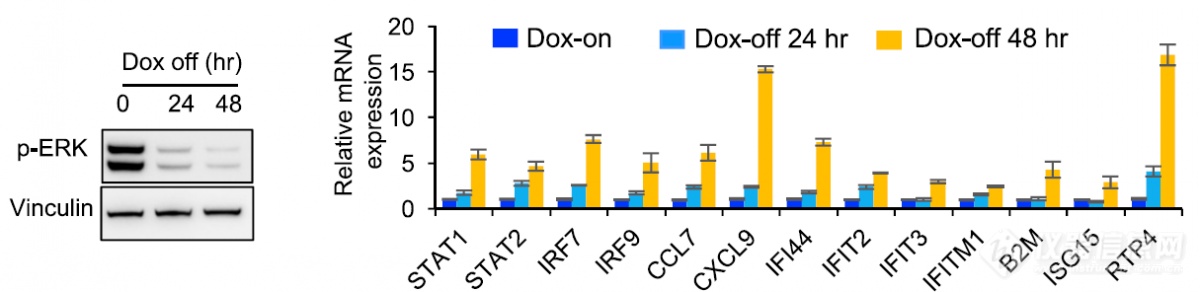
qPCR结果也说明撤去Dox,突变消失后IFN通路出现上调,暗示KRAS突变和IFN通路存在关联
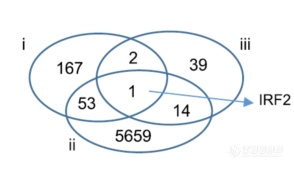
再进一步,作者想筛出KRAS突变后所抑制IFN通路的核心基因,将三类变化的基因(i) IFN-α and IFN-γ signature genes (n = 223); (ii) differentially expressed, invasive versus non-invasive (n = 5,727); (iii) mutually exclusive with KRAS mutation (n = 56)进行了交叉比对,找到了IRF2
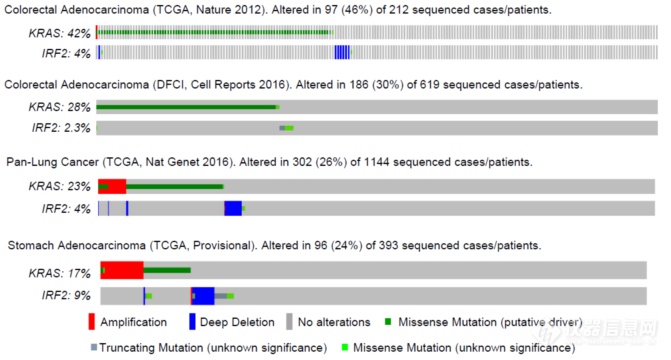
对TCGA数据库中肿瘤细胞基因变化进行了筛选,也发现伴随KRAS突变IRF2出现deletion
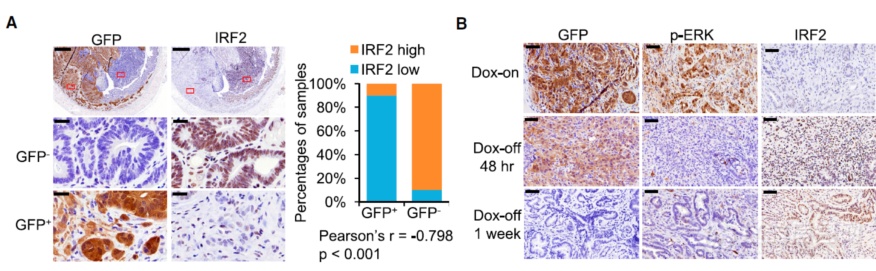
基因层面筛出KRAS突变会使IRF2下调,在组织蛋白层面进行验证发现:KRAS突变后IRF2表达下调,撤去Dox解除突变IRF2恢复表达,暗示KRAS突变会抑制IRF2
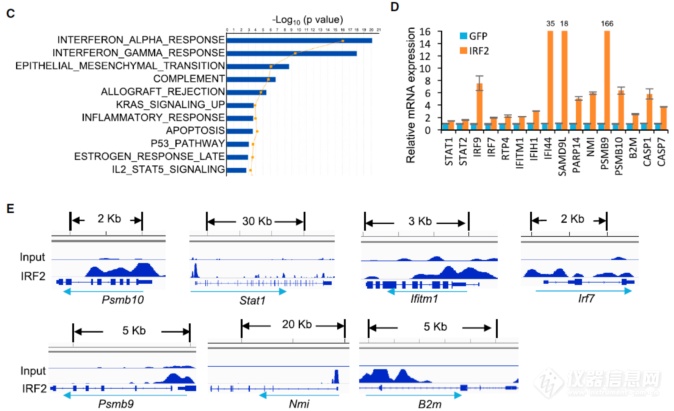
相当于找到了KRAS突变的“下游”IRF2,那IRF2的下游呢?作者让细胞过表达了IRF2,看哪些基因表达出现上调,上调的基因包括IFN signaling molecules (STAT1, STAT2, IRF9, IRF7), host defense-related regulation of immunity (RTP4, IFITM1, IFIH1, IFI44, PARP14, NMI, SAMD9L), antigen presentation (PSMB9, PSMB10, B2M), cell death (CASP7, CASP1),此外ChIP-seq发现很多IRF2结合的位点和IFN通路对应,暗示IRF2是KRAS突变影响IFN通路的主要调节者
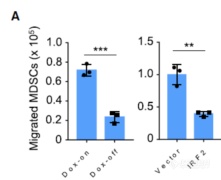
做了这么多实验发现KRAS突变会使MDSC浸润增加,KRAS突变抑制IRF2,那IRF2和MDSC浸润是否相关呢,做新的实验:在体外,撤去Dox后MDSC迁移减少,让细胞表达IRF2后MDSC迁移也减少,初步说明IRF2和MDSC迁移存在相关性
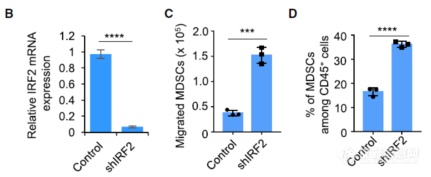
刚刚正着看到IRF2抑制MDSC迁移,开始反着看,沉默IRF2后,体外MDSC迁移能力提升,体内也观察到MDSC浸润增加,暗示IRF2对MDSC浸润存在调节作用
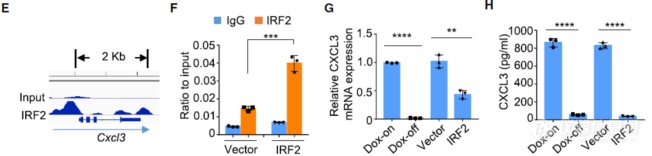
是什么将肿瘤细胞内部的IRF2和MDSC细胞联系起来的呢?细胞因子、趋化因子对于免疫细胞召集起重要作用,文章作者将突变后RNA-seq发现的表达发生上调的细胞因子、趋化因子和IRF2 ChIP-seq发现的IRF2结合的细胞因子、趋化因子基因交叉比对,发现CXCL3启动子上有IRF2的结合位点(E),过表达IRF2后结合的CXCL3增加(F)。进一步验证实验发现撤去Dox,KRAS突变消失后CXCL3表达下调,在肿瘤细胞上表达IRF2也会使CXCL3表达下调– KRAS突变抑制IRF2,IRF2抑制CXCL3,KRAS突变促进CXCL3的表达
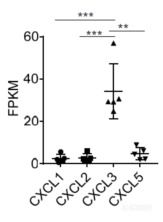
有一系列趋化因子可召集MDSC,但KRAS突变后只有CXCL3上调最为明显,暗示CXCL3发挥召集MDSC的作用
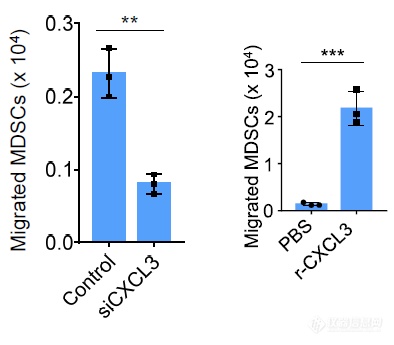
沉默肿瘤细胞的CXCL3后MDSC向肿瘤细胞条件培养基迁移显著减少,向培养基中加入重组的CXCL3后MDSC的迁移显著增加,再次暗示CXCL3对MDSC迁移存在调节作用
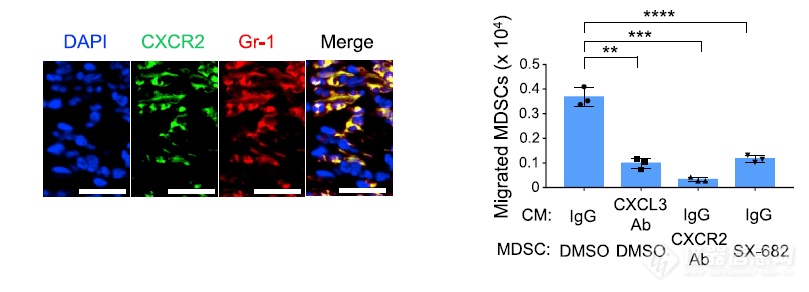
CXCL3的受体是CXCR2,免疫荧光检测发现MDSC的确表达CXCR2,用抗体或小分子阻断CXCR2后MDSC的迁移显著减少
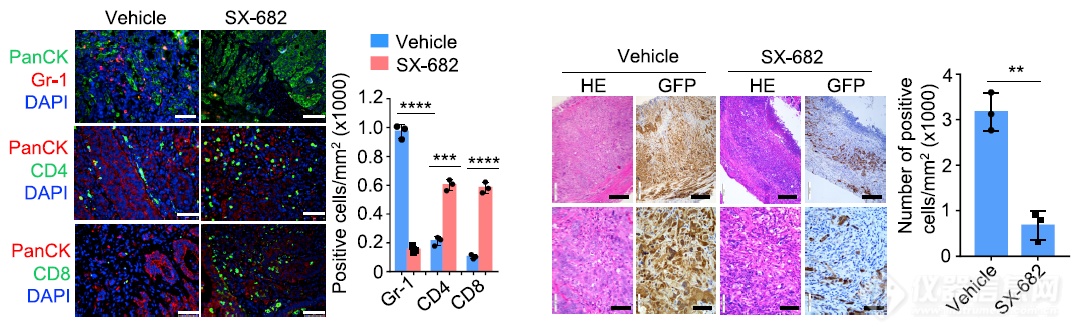
体内实验发现用小分子SX-682阻断CXCR2后MDSC浸润减少,T细胞浸润增加,同时还使肿瘤细胞减少
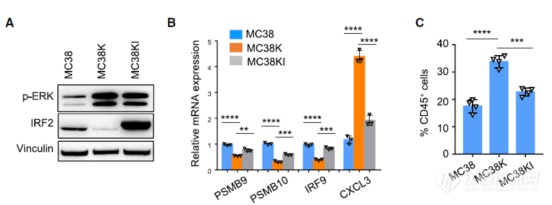
至此初步理出了一条线路KRAS突变会抑制IRF2,IRF2通过抑制CXCL3分泌抑制MDSC通过CXCR2的浸润,作者开始把这条线路中的角色摘出来一个一个的验证,首先是IRF2,选取MC38细胞系(KRAS通路正常,IRF2表达正常)、MC38K为KRAS突变细胞(可见ERK磷酸化的上调,IRF2表达受抑制)、MC38KI(KRAS突变同时强制表达IRF2,三种细胞中IRF2水平最高),可见KRAS突变后(MC38K组)IFN通路受抑制、CXCL3表达增加、MDSC浸润增加,突变KARS细胞强制表达IRF2后(MC38KI组)IFN通路回调、CXCL3表达下调、MDSC浸润减少
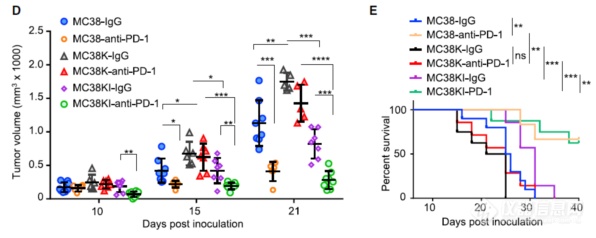
强制表达IRF2除可减缓MC38K肿瘤的生长速度、延长小鼠存活时间外,还可以提高MC38K肿瘤对PD-1疗法的敏感度
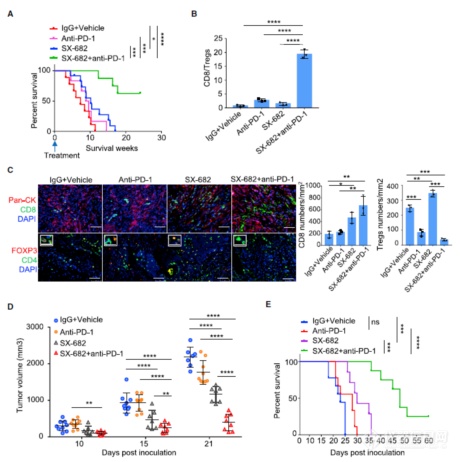
看IRF2之外另一关键节点CXCR2,可见用小分子SX-682阻断CXCR2对肿瘤免疫、肿瘤生长抑制、小鼠存活存在积极作用
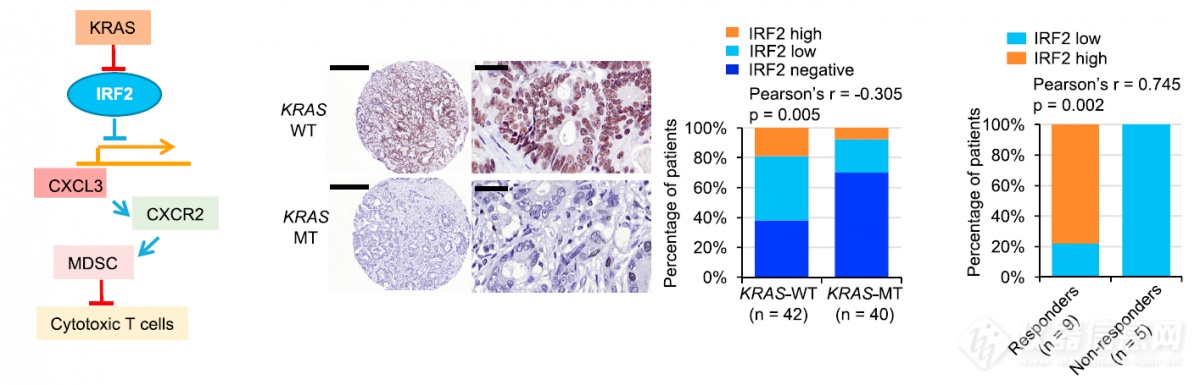
综上,作者理出了这样的机制:KRAS突变抑制IRF2后,CXCL3的抑制被解除,表达上调,召集MDSC抑制杀伤性T细胞,这一结论是由小鼠模型推导得来,为放大研究的意义,在人的样品、数据库中又挖掘了一番 - KARS突变肿瘤IRF2表达低、对PD-1疗法的响应与IRF2表达正相关
以往我们只关注肿瘤细胞本身,挖掘肿瘤细胞相较正常细胞到底哪出了问题,如:哪个蛋白突变了、哪条通路过度激活了、哪条通路受抑制了,找到肿瘤身上的问题之后试图直接在肿瘤细胞上进行纠正。肿瘤免疫疗法是一种新的视角,在和肿瘤细胞这台戏里我们又引入了新的角色-免疫细胞,这篇文章从这个视角出发去挖掘肿瘤细胞本身发生的“变化”对新角色免疫细胞产生的影响,工具、方法、模型其实就那么多,掌握这些只是必要的开始,更重要的还是讲故事的人的思维、视野。
Wenting Liao, Michael J. Overman, Adam T. Boutin, et al. KRAS-IRF2 Axis Drives Immune Suppression and Immune Therapy Resistance in Colorectal Cancer [J].Cancer Cell, 2019.
想了解更多CNS级期刊最新内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568
酶标仪科普专栏丨第二期:荧光偏振(FP)介绍及应用
从分子到疾病:线粒体动力学研究取得新突破
【会议预告】第三届 3D 细胞类器官应用与高内涵成像技术研讨会邀您参加
开学啦|新学期,“心”守护实验室仪器免费巡检报名名额领取中
相关产品
上海美谱达UV-3200扫描型紫外/可见分光光度计
Leica徕卡DM750M正置显微镜
希森美康ExoCounter 全自动外泌体分析仪
智能化共聚焦高内涵成像分析系统
比利时 Bioruptor plus非接触式全自动超声破碎仪
DM3000德国徕卡leica生物显微镜
徕卡生物倒置显微镜LeicaDMi1
希森美康ExoCounter 全自动外泌体分析仪
梅特勒托利多pH 复合电极 LE438
Diagenode全自动核酸剪切仪Megaruptor ®3
化学发光成像仪Amersham ImageQuant 800
BIORUPTOR超声波细胞破碎仪new pico比利时Diagenode
美国博勒飞AMETEK Brookfield CTX质构仪
美国思拓凡 cytiva go蛋白纯化系统
ATS超高压均质机AH-D400

关注

拨打电话

留言咨询