免疫疗法各种临床试验都开展了起来,科研这边在筛选免疫细胞或肿瘤细胞内部可调控肿瘤免疫靶点,今天整理分享这篇文章则将目光放到了肿瘤细胞和免疫细胞发生互作之后的故事,文章作者发现T细胞可以诱导肿瘤细胞发生铁死亡,具体内容如下:
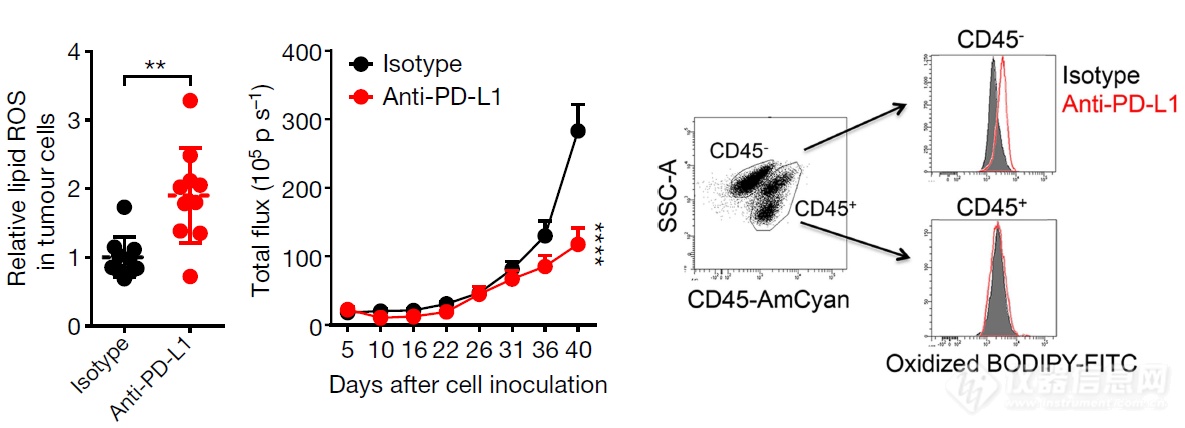
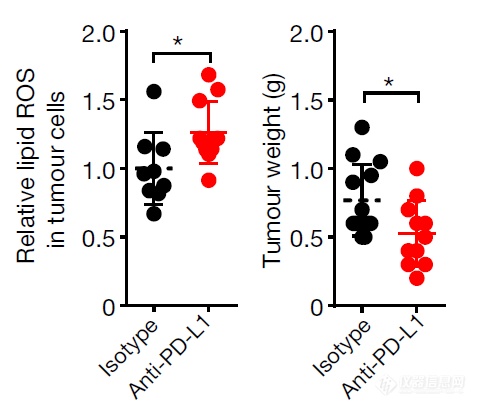
铁死亡是否在肿瘤免疫过程中出现尚未见报道,所以文章作者想看看T细胞和肿瘤细胞拼杀过程中是否会发生铁死亡,作者造了PD-L1单抗抑制卵巢癌细胞生长的模型,以Lipid ROS为指标监测铁死亡,发现PD-L1单抗组肿瘤细胞(CD45-)会发生铁死亡(Lipid ROS升高),而免疫细胞不会发生铁死亡(CD45+)
作者又换了一个肿瘤 - B16皮下移植瘤模型,再次发现肿瘤细胞发生铁死亡
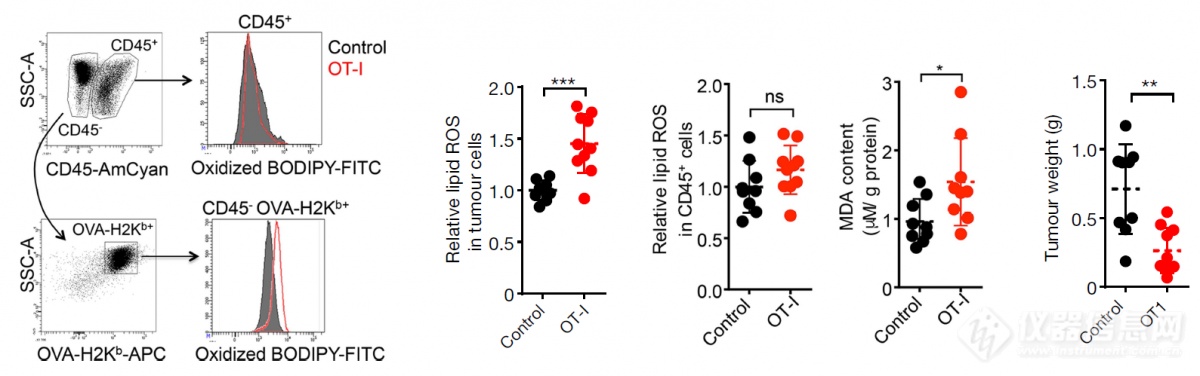
前面用PD-L1单抗诱导肿瘤免疫发现铁死亡现象,作者又建立了一个T细胞灌注抑制肿瘤生长的模型,再次发现肿瘤细胞发生铁死亡[ Lipid ROS、MDA(机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物。如丙二醛MDA,)升高 ],而免疫细胞不发生铁死亡
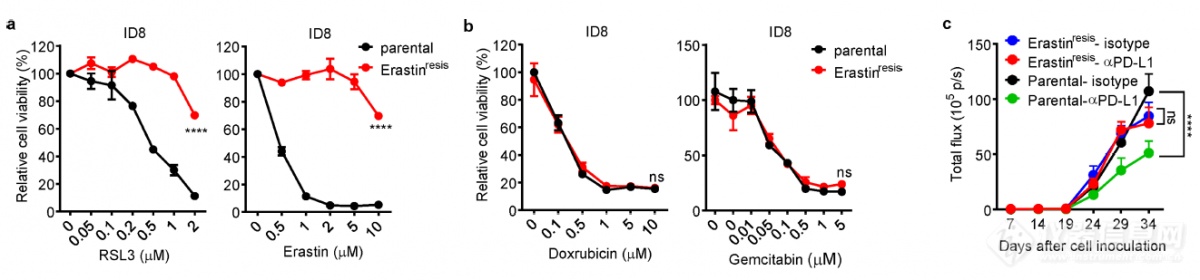
肿瘤免疫过程中发生了铁死亡,那铁死亡对单抗诱导的肿瘤生长抑制是否有贡献呢?作者制备了铁死亡耐受的细胞系Erastinresis(耐受铁死亡诱导剂RSL3和Erastin,不耐受凋亡诱导剂Doxrubicin和Gemcitabin),发现PD-L1单抗无法抑制铁死亡耐受肿瘤细胞的生长,暗示PD-L1单抗通过诱导肿瘤细胞铁死亡抑制肿瘤生长
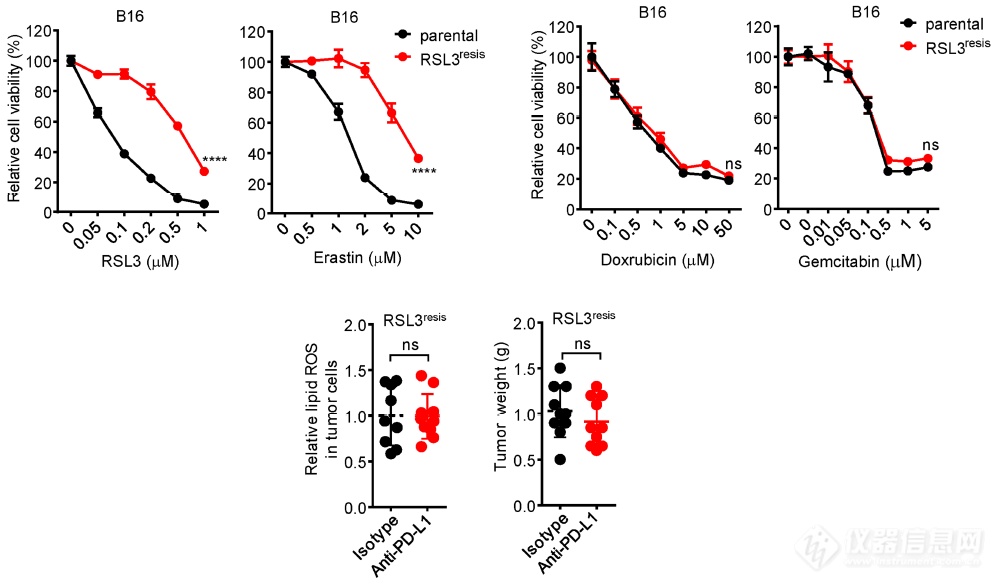
又制备了另一个耐受铁死亡不耐受凋亡的肿瘤细胞系,再次发现PD-L1单抗无法抑制铁死亡耐受肿瘤细胞的生长,再次暗示PD-L1单抗通过诱导肿瘤细胞铁死亡抑制肿瘤生长
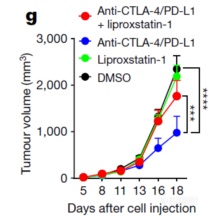
铁死亡抑制剂能阻断免疫检查点抑制剂的抑瘤作用,又一次说明铁死亡在肿瘤免疫反应中发挥重要作用
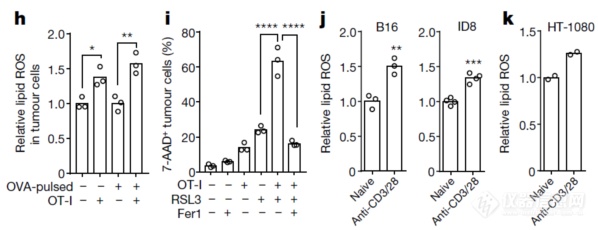
体外T细胞与肿瘤细胞共培养实验(h,i)发现:和T细胞共培养后肿瘤细胞Lipid ROS水平升高,铁死亡诱导剂RSL3可促进T细胞对肿瘤细胞的杀伤,而铁死亡抑制剂Fer1则会抑制T细胞对肿瘤细胞的杀伤,暗示铁死亡在T细胞杀伤肿瘤细胞中发挥作用;在T细胞和肿瘤细胞共培养体系中(j,k)加入用单抗激活的T细胞的培养上清后,肿瘤细胞lipid ROS水平升高,暗示激活后的T细胞的分泌物可诱导肿瘤细胞发生铁死亡
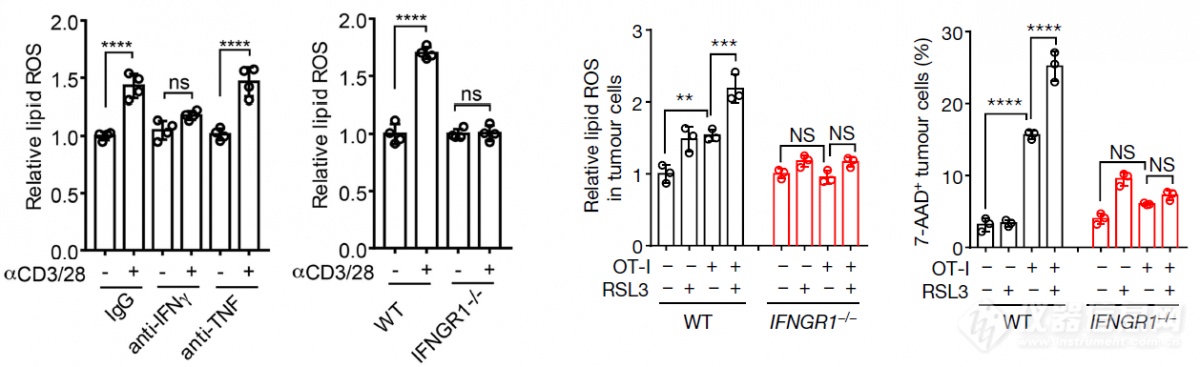
激活的T细胞的培养上清能提高lipid ROS,诱导肿瘤细胞发生铁死亡,暗示是T细胞分泌的细胞因子诱导铁死亡,单抗阻断IFNγ能够抵消激活的T细胞培养上清升高肿瘤细胞lipid ROS的作用,TNF单抗则无此作用,暗示是IFNγ在执行诱导铁死亡的作用,果然,敲除肿瘤细胞IFNγ受体后,激活T细胞的培养基上清、T细胞升高肿瘤细胞lipid ROS的作用消失,T细胞无法有效杀伤IFNγ受体缺陷的肿瘤细胞,至此找到了肿瘤免疫中诱导铁死亡的效应分子IFNγ
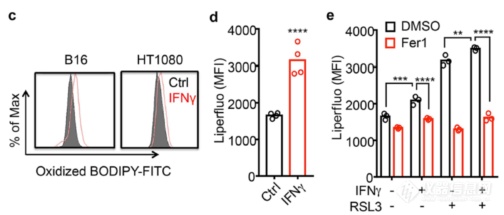
果然,用IFNγ刺激肿瘤细胞能升高其lipid ROS(用了两种不同的方法检测lipid ROS)
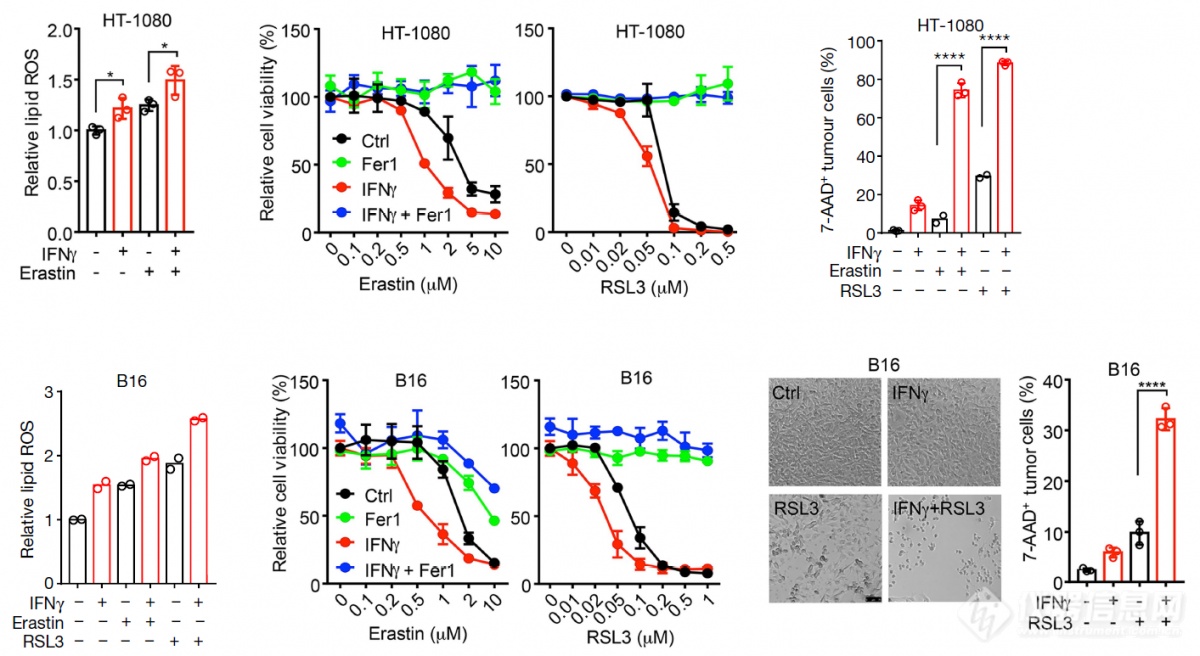
IFNγ能提高肿瘤细胞对铁死亡诱导剂的敏感度
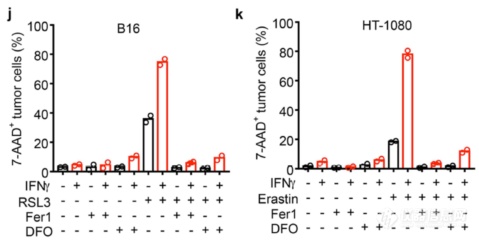
铁死亡阻断剂能阻断IFNγ和铁死亡诱导剂诱导的肿瘤细胞杀伤
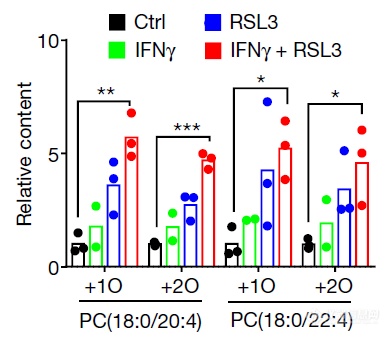
液质联用检测细胞内lipid的氧化状态发现,IFNγ处理可和铁死亡诱导剂一起升高细胞氧化磷脂酰胆碱(PC)水平
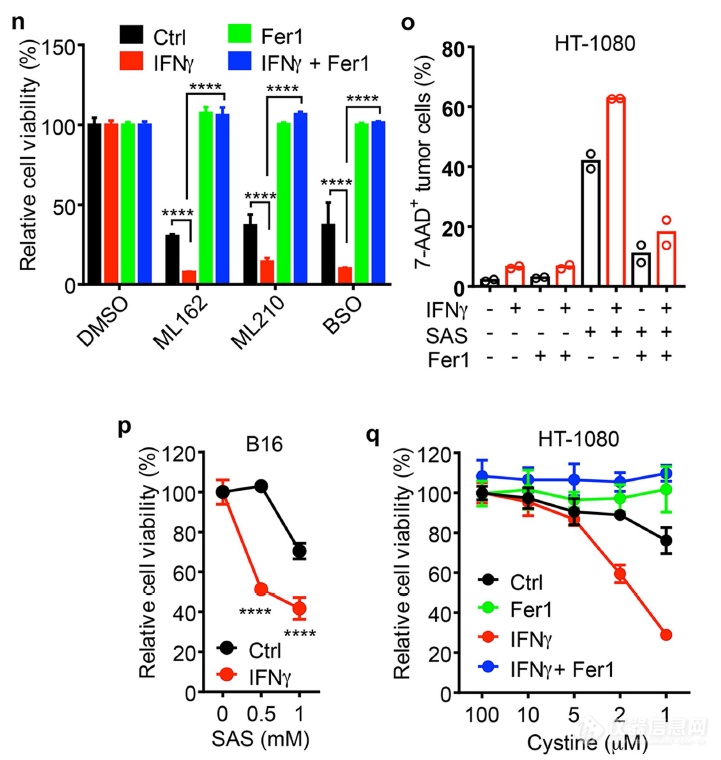
接着证明IFNγ对铁死亡的贡献:IFNγ能够提高一系列铁死亡诱导剂诱导铁死亡的作用
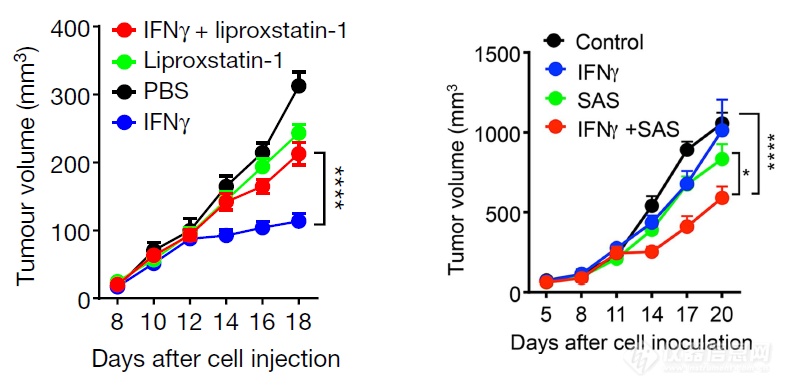
体外实验证明完IFNγ对铁死亡的贡献之后,体内实验证明:铁死亡抑制剂liproxstatin-1能够阻滞IFNγ的抑瘤作用,铁死亡诱导剂SAS能促进IFNγ的抑瘤作用
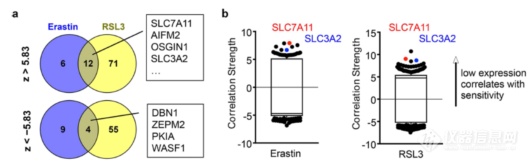
找到了IFNγ之后往哪走?该用大数据了,作者开始在数据库里找影响肿瘤细胞对铁死亡敏感度的biomarker,发现,SLC7A11和SLC3A2和铁死亡的耐受密切相关
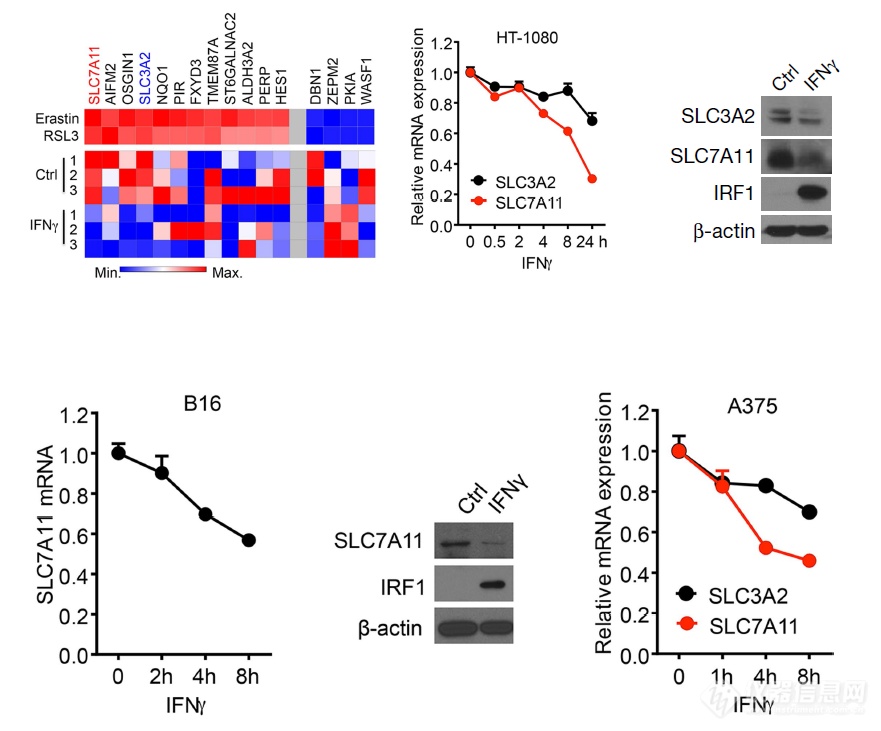
IFNγ处理细胞后SLC7A11和SLC3A2的表达出现下调
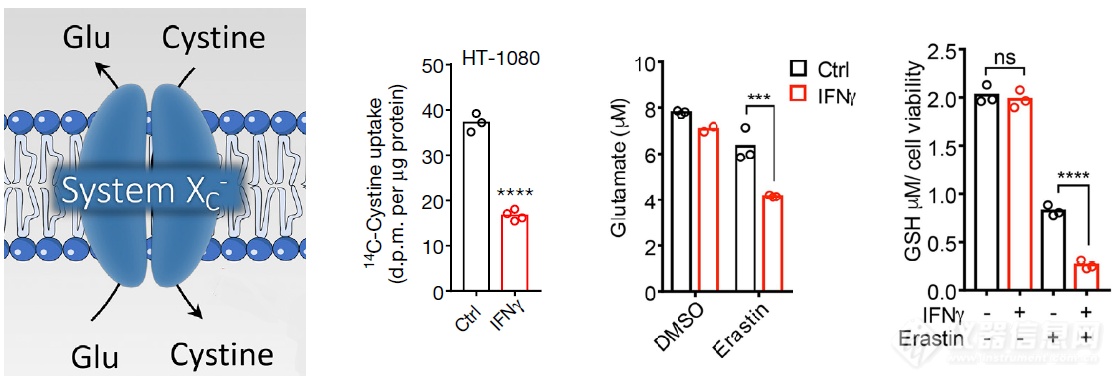
SLC7A11和SLC3A2组成system Xc,起摄取Cystine、外排Glu,保证谷胱甘肽的合成的作用,IFNγ处理后cystined的摄取和Glu的外排均减少,谷胱甘肽的合成受到干扰
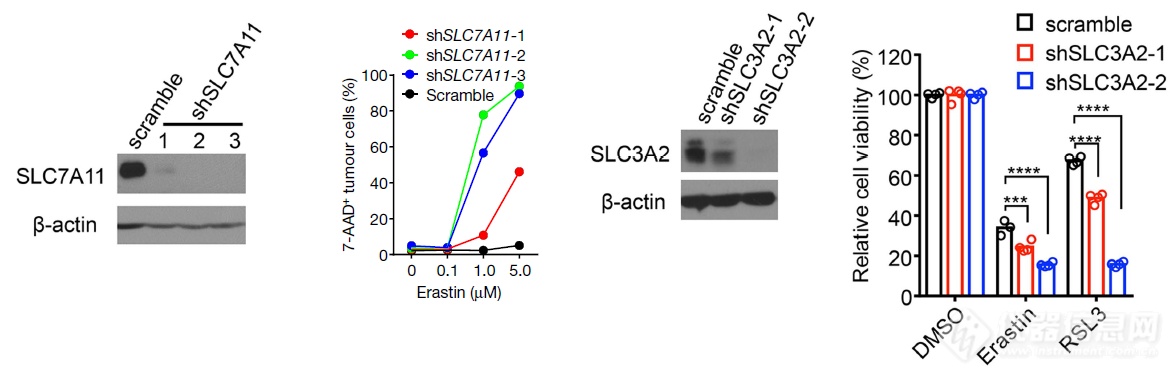
前面把IFNγ和铁死亡建立了相关性,又把IFNγ和SLC7A11、SLC3A2建立了相关性,大数据筛出SLC7A11、SLC3A2和铁死亡敏感度负相关,实际做一下:敲掉SLC7A11、SLC3A2后,肿瘤细胞对铁死亡诱导剂敏感度升高
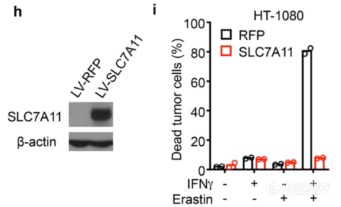
过表达SLC7A11能rescue IFNγ和铁死亡诱导剂引起的细胞死亡,再结合敲除实验,暗示IFNγ通过调节SLC7A11调节铁死亡,接下来该挖IFNγ信号是如何传到SLC7A11的
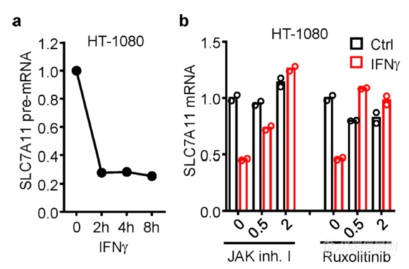
IFNγ作用细胞2h后SLC7A11 pre-mRNA水平就出现明显下降,暗示IFNγ是在转录层面调节SLC7A11的,IFNγ的下游是JAK,实验JAK抑制剂后IFNγ引起的SLC7A11 mRNA水平下降现象消失
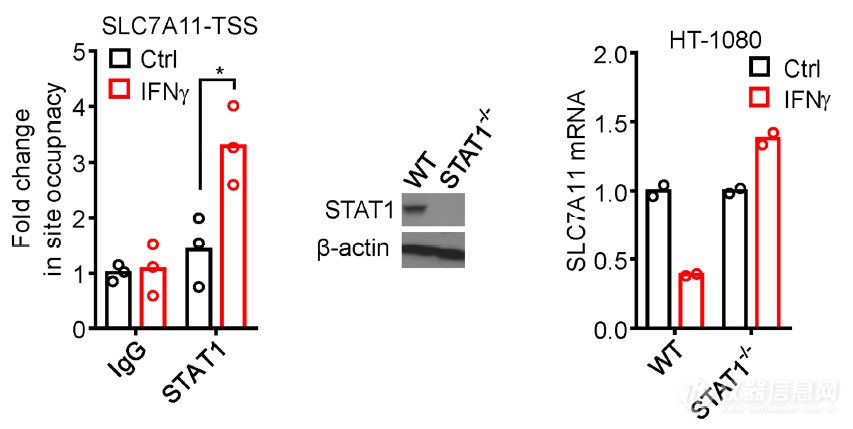
IFNγ通过JAK-STAT1执行其信号,ChIP实验发现IFNγ作用后STAT1与SLC7A11-TSS(转录起始位点)互作增强,敲掉STAT1后IFNγ引起的SLC7A11 mRNA下调现象消失,暗示IFNγ通过激活STAT1,STAT1占据SLC7A11转录起始位点发挥抑制SLC7A11转录的作用,进而再发挥促进铁死亡的作用
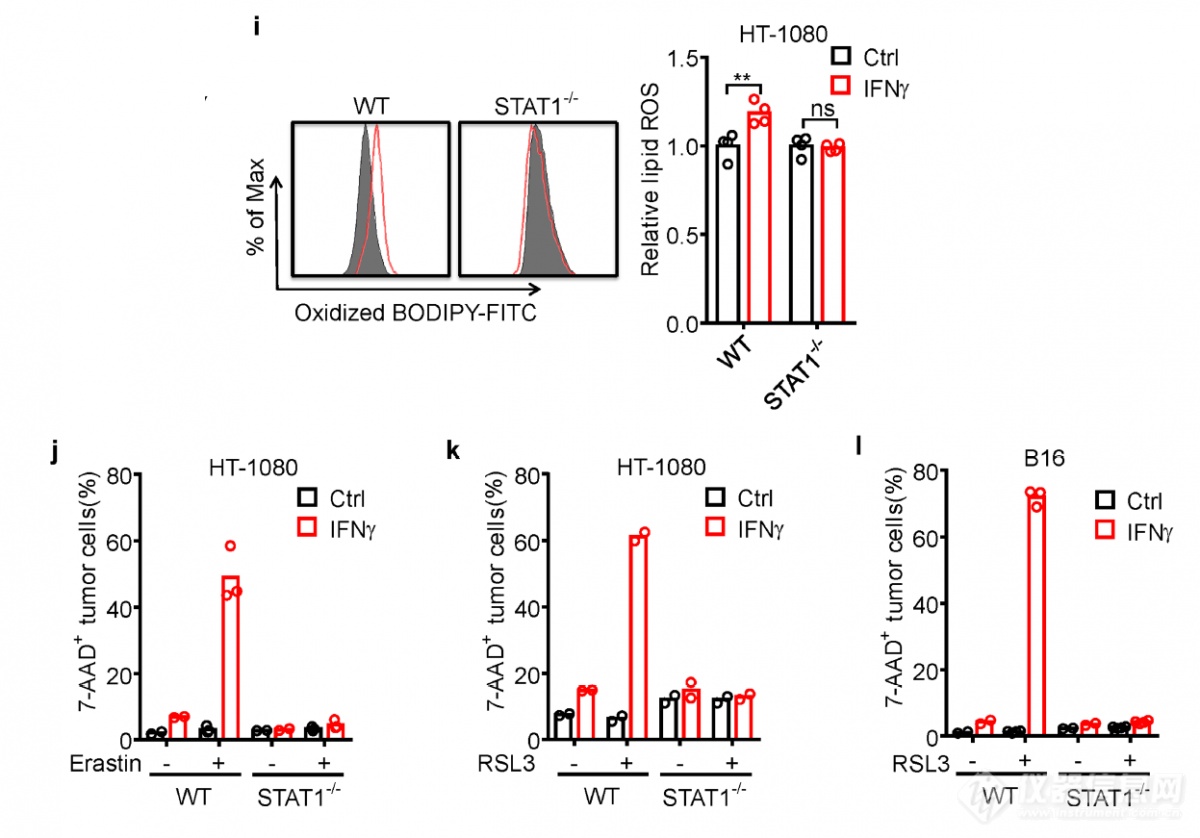
果然,敲掉STAT1的肿瘤细胞铁死亡受到抑制
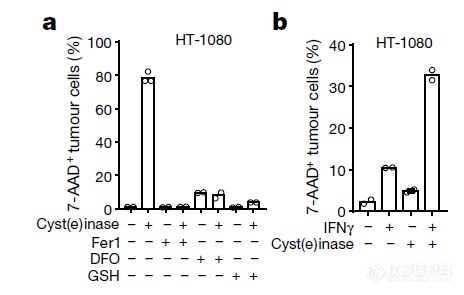
综合上面的数据,文章作者发现肿瘤免疫引起的肿瘤细胞铁死亡是由IFNγ执行的,IFNγ通过在转录层面抑制Cystine转运蛋白SLC7A11的表达,抑制细胞内谷胱甘肽(GSH)的合成,进而阻断了肿瘤细胞内的抗氧化作用,促进了肿瘤细胞的铁死亡,作者换了角度,既然生理条件下肿瘤免疫的效应分子IFNγ是通过抑制Cystine的摄取促进铁死亡,索性用酶直接降解Cystine,看是否能杀死肿瘤细胞:果然,加入酶后肿瘤细胞死亡增多,而铁死亡抑制剂能阻断酶的作用
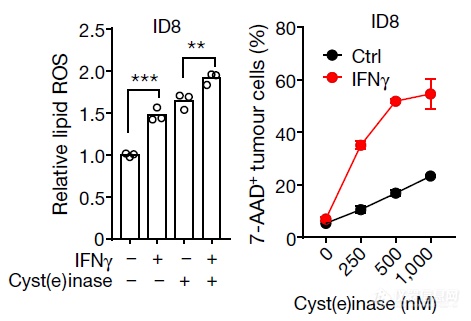
换了个细胞,加入酶后,IFNγ诱导肿瘤细胞铁死亡的作用增强
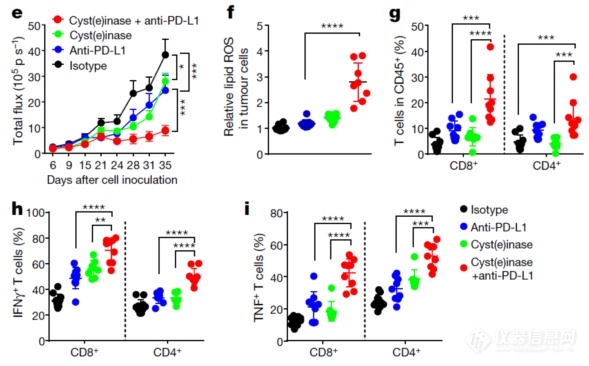
在做个体内实验,发现酶能够改善肿瘤微环境,促进肿瘤细胞发生铁死亡,增强PD-L1单抗的疗效– 初步说明自己这个关于铁死亡的发现对现实的意义
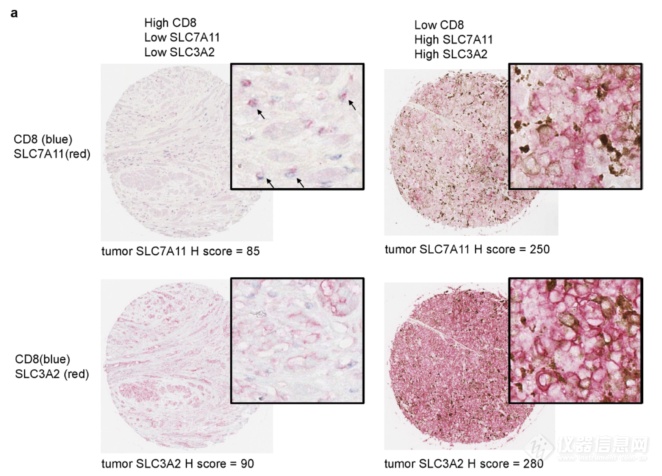
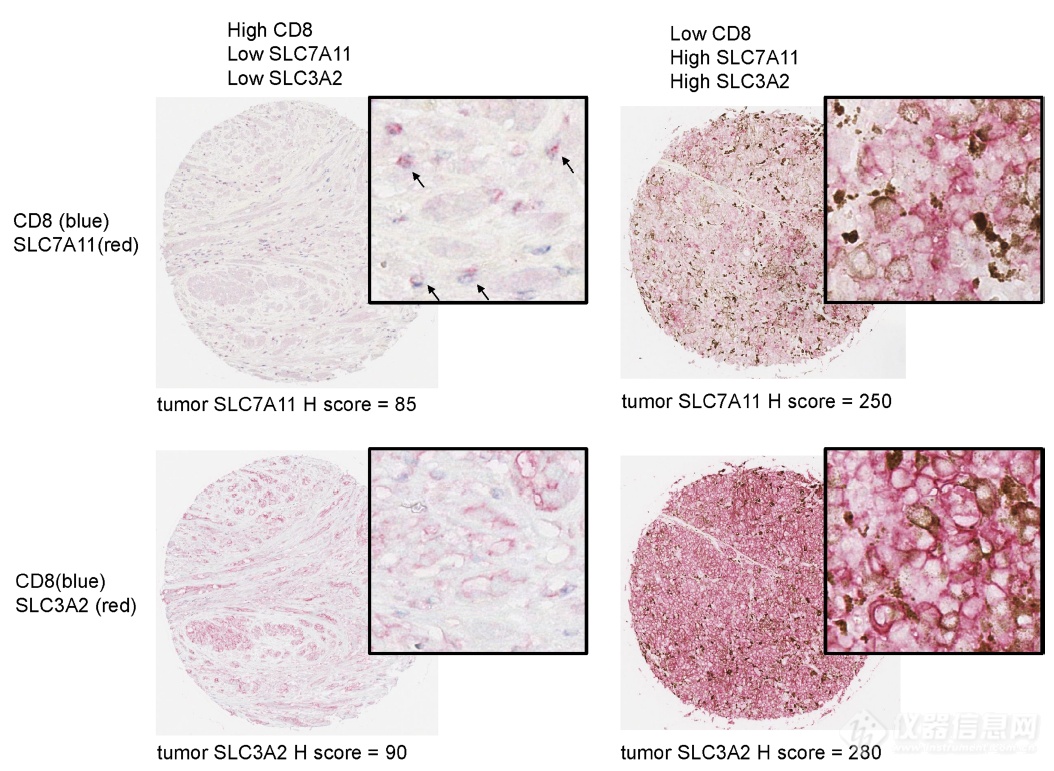
肿瘤免疫引起的铁死亡是通过抑制SLC7A11和SLC3A2组成的Cystine-Glu转运系统而执行的,再到临床样本上放大一下自己研究的意义:选取肿瘤组织切片,发现SLC7A11、SLC3A2水平和CD8 T细胞浸润水平负相关
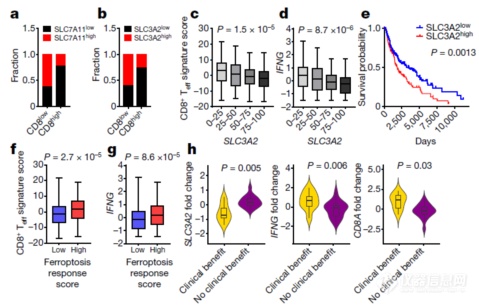
总之就是在茫茫临床数据中去找能将SLC7A11和SLC3A2组成的这个转运系统和免疫、病人存活建立相关性的数据,然后放出来,放大自己研究的价值
肿瘤免疫是个热点,铁死亡很新颖,文章作者很会讲故事,将两个点凑到一起,理清了免疫系统引起肿瘤细胞铁死亡的分子基础,笔者觉得他们应该也涉及凋亡研究了,甚至想研究在肿瘤免疫过程中凋亡、铁死亡两者的关系,但这是后话了,留给下篇文章呗……
Weimin Wang, Michael Green, Jae Eun Choi, Miguel Gijón, Paul D. Kennedy, et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy [J].Nature, 2019.
想了解更多CNS级期刊最新内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568
酶标仪科普专栏丨第二期:荧光偏振(FP)介绍及应用
从分子到疾病:线粒体动力学研究取得新突破
【会议预告】第三届 3D 细胞类器官应用与高内涵成像技术研讨会邀您参加
开学啦|新学期,“心”守护实验室仪器免费巡检报名名额领取中
相关产品
上海美谱达UV-3200扫描型紫外/可见分光光度计
Leica徕卡DM750M正置显微镜
希森美康ExoCounter 全自动外泌体分析仪
智能化共聚焦高内涵成像分析系统
比利时 Bioruptor plus非接触式全自动超声破碎仪
DM3000德国徕卡leica生物显微镜
徕卡生物倒置显微镜LeicaDMi1
希森美康ExoCounter 全自动外泌体分析仪
梅特勒托利多pH 复合电极 LE438
Diagenode全自动核酸剪切仪Megaruptor ®3
化学发光成像仪Amersham ImageQuant 800
BIORUPTOR超声波细胞破碎仪new pico比利时Diagenode
美国博勒飞AMETEK Brookfield CTX质构仪
美国思拓凡 cytiva go蛋白纯化系统
ATS超高压均质机AH-D400

关注

拨打电话

留言咨询