溶酶体在细胞内发挥重要功能,此次整理分享的文章研究的是溶酶体的再形成,文章作者以线虫胚胎发育过程中细胞尸体的清除为研究模型,发现细胞尸体被吞噬后溶酶体的再形成受SLC-36.1和PPK-3调控,具体内容如下:
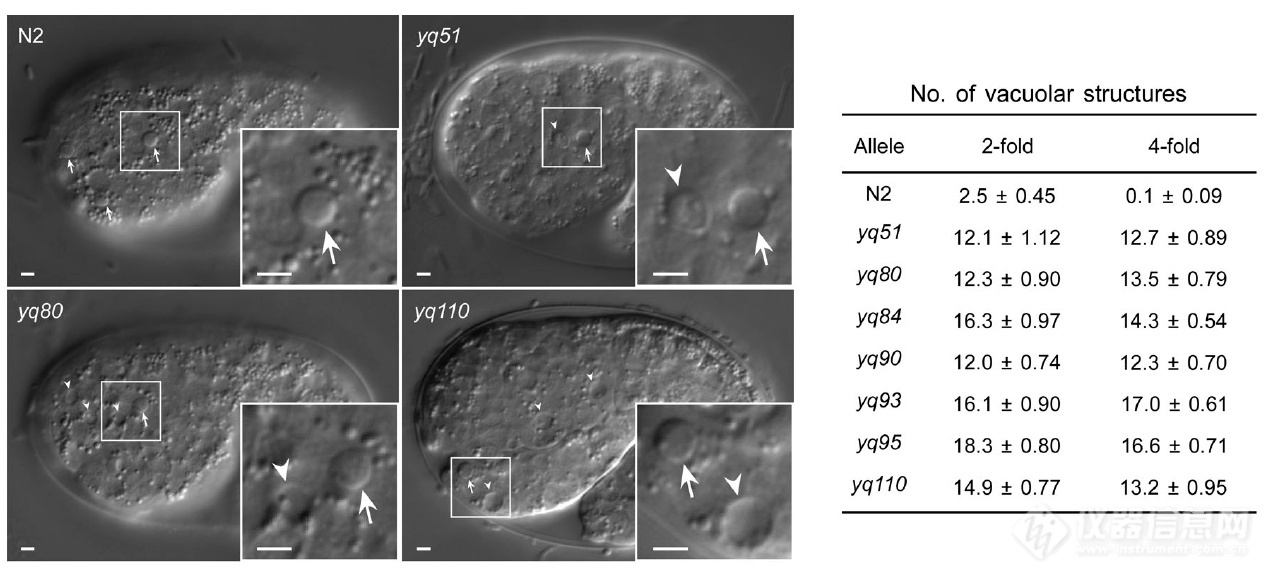
文章作者用烷化剂甲磺酸乙酯(EMS)诱导线虫胚胎发生基因突变,DIC成像观察发现除了凋亡细胞(图中钮扣样突起-已凋亡细胞光反射性增强,因此在DIC呈钮扣状凸起),相较野生型N2有一系列突变体中出现了大量液泡状结构(图中箭头所指凹陷)
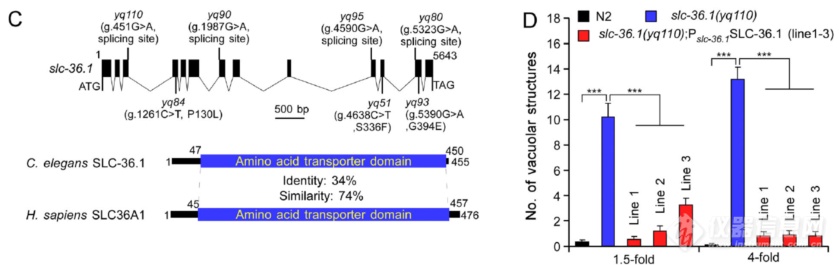
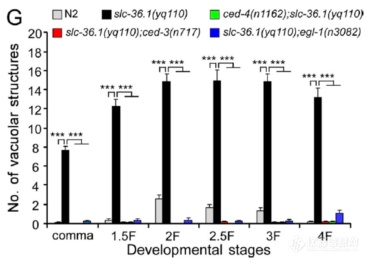
将引起液泡结构的突变定位后发现是SLC-36.1发生了突变:对SLC-36.1基因yq110点突变后液泡状结构显著增加,重新表达野生型SLC-36.1则能rescue突变引起的液泡增加,暗示SLC-36.1参与调节胚胎中液泡结构的生成
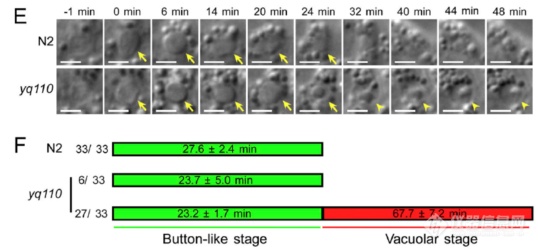
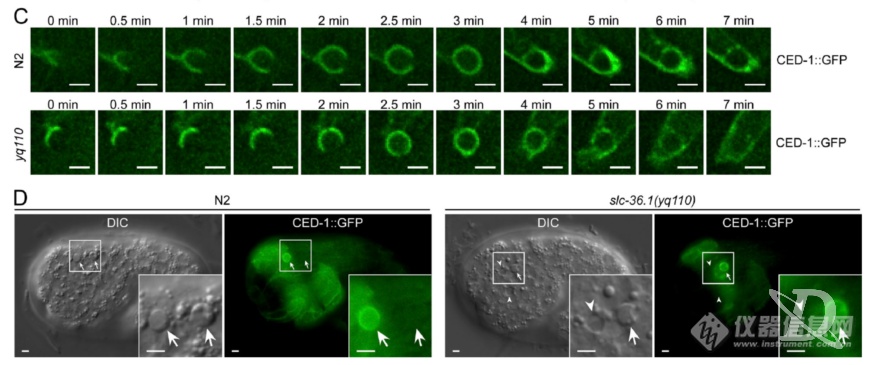
为追溯液泡结构的来源,作者进行了DIC活细胞观察,发现野生型N2中,钮扣状的凋亡细胞30分钟左右后会收缩、消失,而突变组yq110中钮扣状的凋亡细胞不会消失,反而转化成了液泡状结构,暗示液泡状结构来源于凋亡细胞“尸体”
为了确证液泡状结构是凋亡细胞尸体转化而来,作者对凋亡调控基因ced-4、ced-3、egl-1进行了突变,发现当凋亡受抑制后液泡结构几乎不再生成,暗示液泡结构来自于凋亡细胞
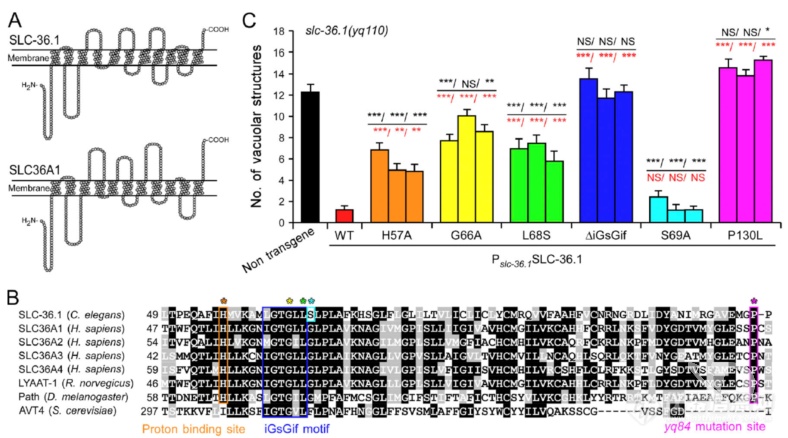
线虫的SLC-36.1和哺乳动物的SLC36A1同源,有相似的结构域用于氨基酸转运,作者用突变体rescue yq110引起的液泡生成,毫无疑问表达野生型SLC-36.1可以rescue突变引起的液泡生成,缺失氨基酸转运结构域的△iGsGif组无法rescue,各个氨基酸转运结构域突变体(除S69A,非保守位点)rescue能力弱于野生型,暗示SLC-36.1的氨基酸转运可抑制液泡结构的形成
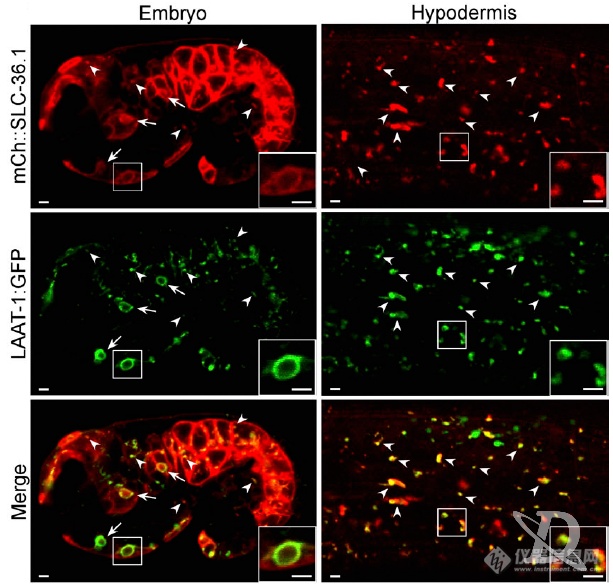
看SLC-36.1的定位情况:定位在细胞膜和溶酶体(LAAT-1是溶酶体表面赖氨酸/精氨酸转运蛋白)
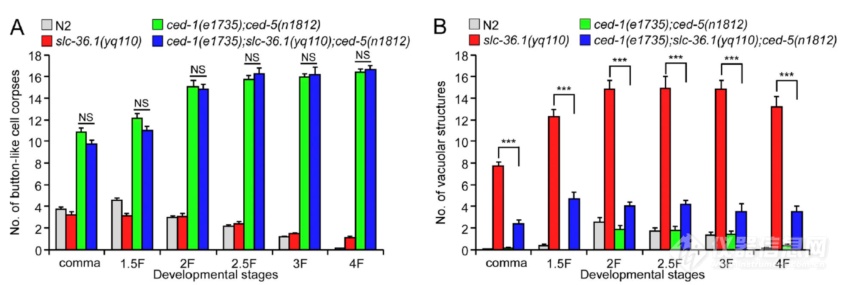
SLC-36.1和参与凋亡后液泡形成、和溶酶体共定位,细胞发生凋亡后产生的尸体是溶酶体消化的,作者开始理SLC-36.1在凋亡过程中的位置:突变凋亡细胞吞噬相关基因后,钮扣状的细胞尸体增多,同时突变凋亡细胞吞噬基因和SLC-36.1细胞尸体数不受影响,但液泡结构减少,暗示SLC-36.1在吞噬蛋白下游发挥作用
CED-1可识别凋亡细胞外翻的磷脂酰丝氨酸,SLC-36.1突变不影响CED-1对细胞尸体的识别,液泡状结构不会被CED-1识别,说明SLC-36.1是在CED-1识别细胞尸体后发挥作用
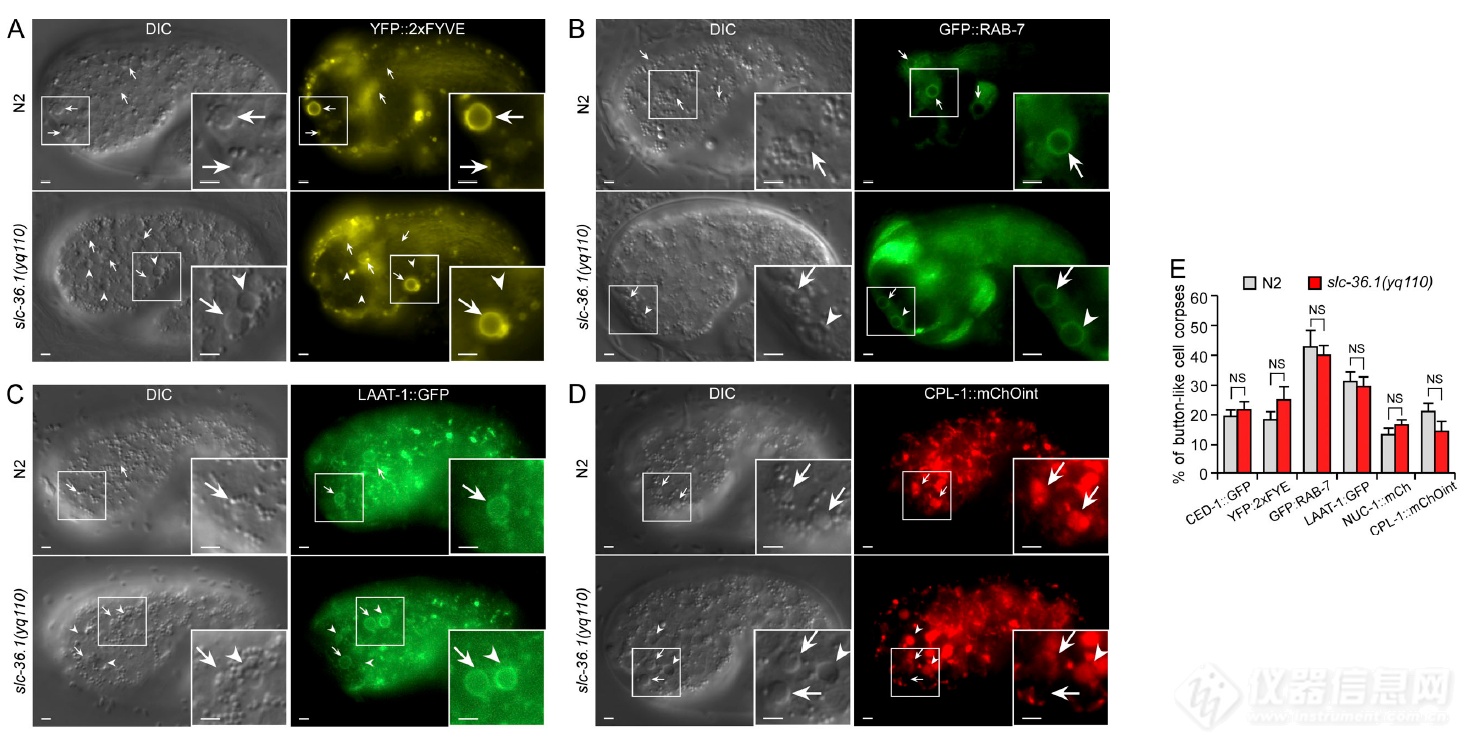
CED-1识别后,细胞尸体会被吞噬,作者开始看SLC-36.1在吞噬体形成中是否发挥作用,让线虫胚胎表达一系列带荧光蛋白标签的吞噬体成熟marker,发现SLC-36.1突变不影响吞噬体的成熟
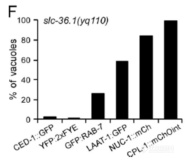
SLC-36.1突变不影响吞噬体的成熟,液泡状结构上溶酶体组分(LAAT-1、NUC-1、CPL-1)含量明显升高,暗示SLC-36.1突变引发的液泡结构为吞噬溶酶体
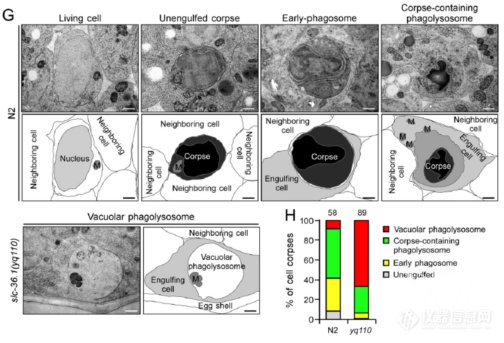
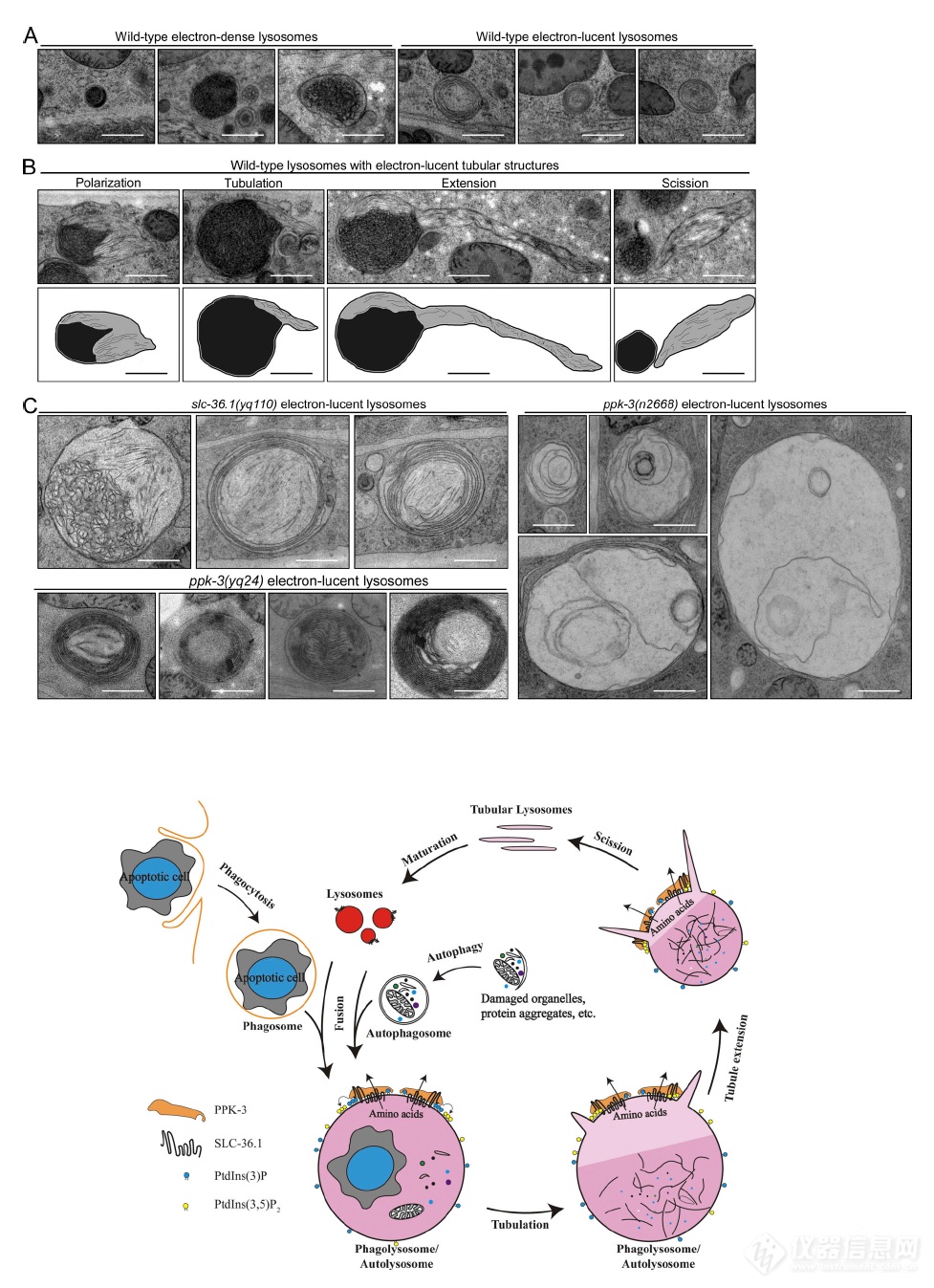
电镜观察野生型和突变型的吞噬溶酶体,野生型吞噬溶酶体形成后随着对细胞尸体的降解吞噬溶酶体收缩,而突变型的吞噬溶酶体大而空,暗示SLC-36.1突变后形成的吞噬溶酶体有降解细胞尸体的能力,但失去了随着降解收缩体积的能力
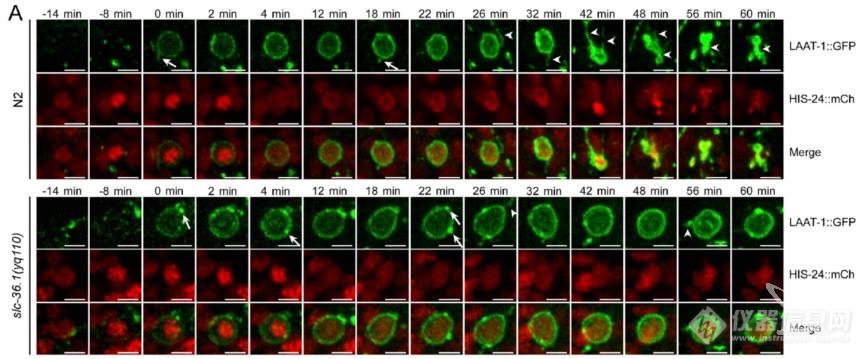
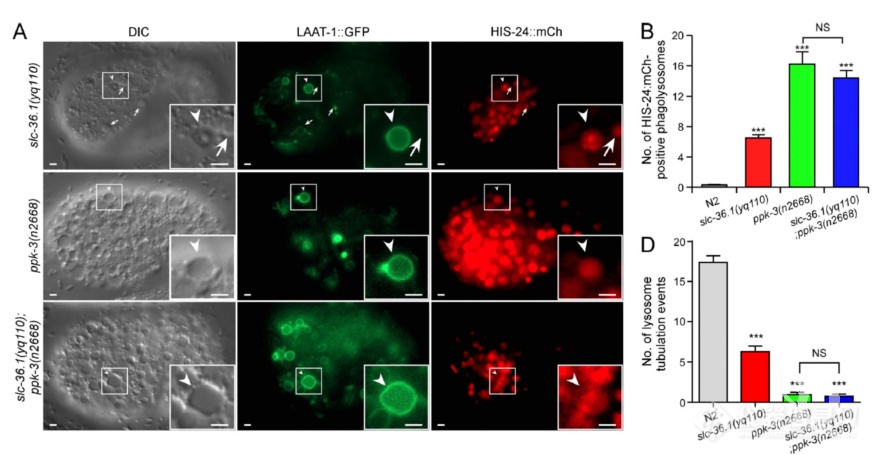
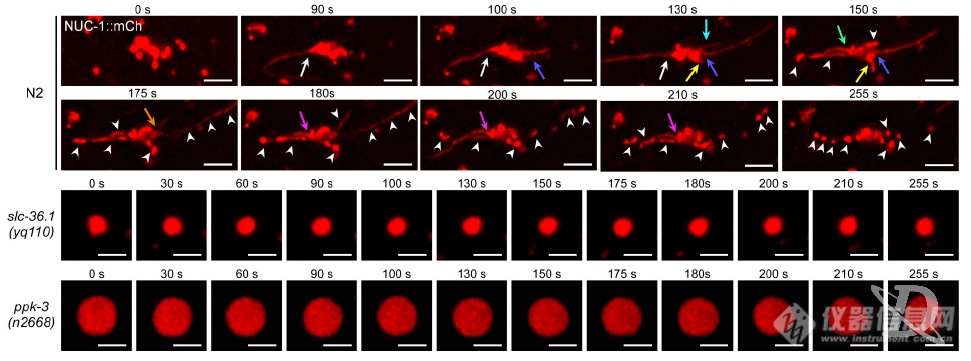
活细胞监测吞噬溶酶体形成及溶酶体再形成过程(溶酶体表面氨基酸转运蛋白LAAT-1标记溶酶体,HIS-24标记细胞尸体):野生型N2中,溶酶体会被召集到细胞尸体处形成吞噬溶酶体,之后吞噬溶酶体伸长、分离再次形成溶酶体;而SLC-36.1突变组溶酶体可被召集的细胞尸体处形成吞噬溶酶体,但吞噬溶酶体无法伸长、分离生成溶酶体
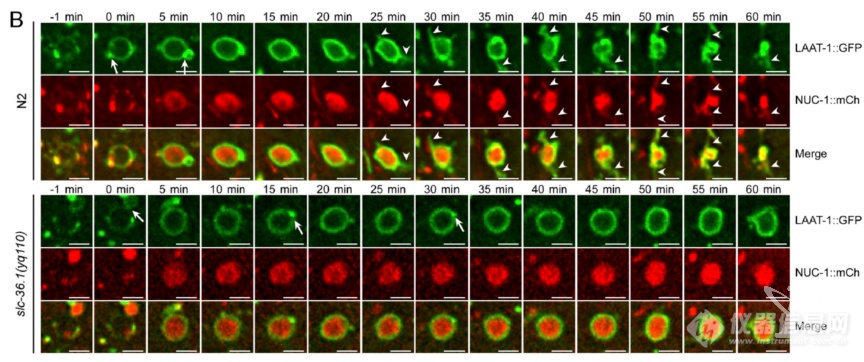
又换了个标记NUC-1(溶酶体内DNA酶),再次发现SLC-36.1突变不影响吞噬溶酶体形成,但抑制溶酶体再生成
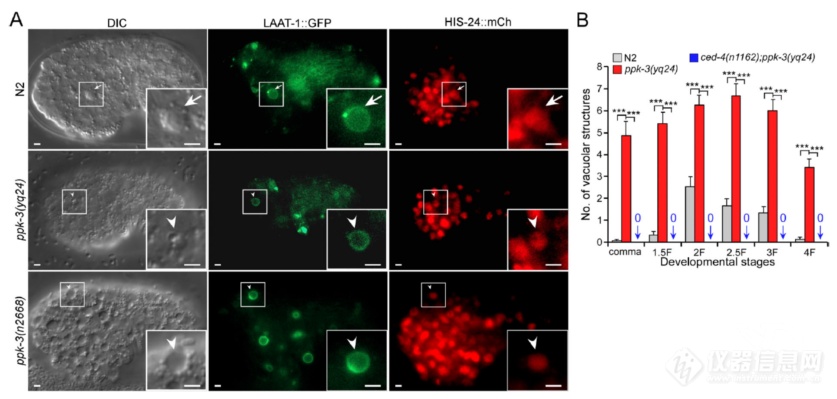
甲磺酸乙酯突变筛选中还发现PPK-3突变也会产生液泡状结构,且液泡状结构LAAT-1和HIS-24“双阳”,暗示PPK-3突变引起的液泡状结构也是吞噬溶酶体,果然,和SLC-36.1类似,同时突变凋亡调控蛋白和PPK-3液泡状结构显著减少,说明PPK-3也在凋亡信号下游
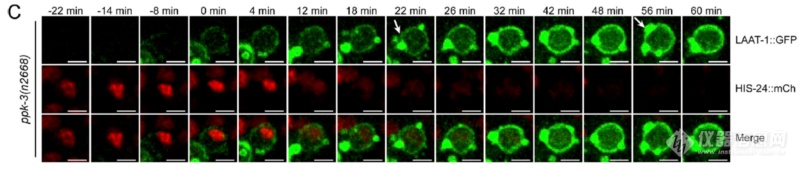
活细胞监测发现和SLC-36.1突变类似,PPK-3突变不影响吞噬溶酶体形成,但影响溶酶体再生成
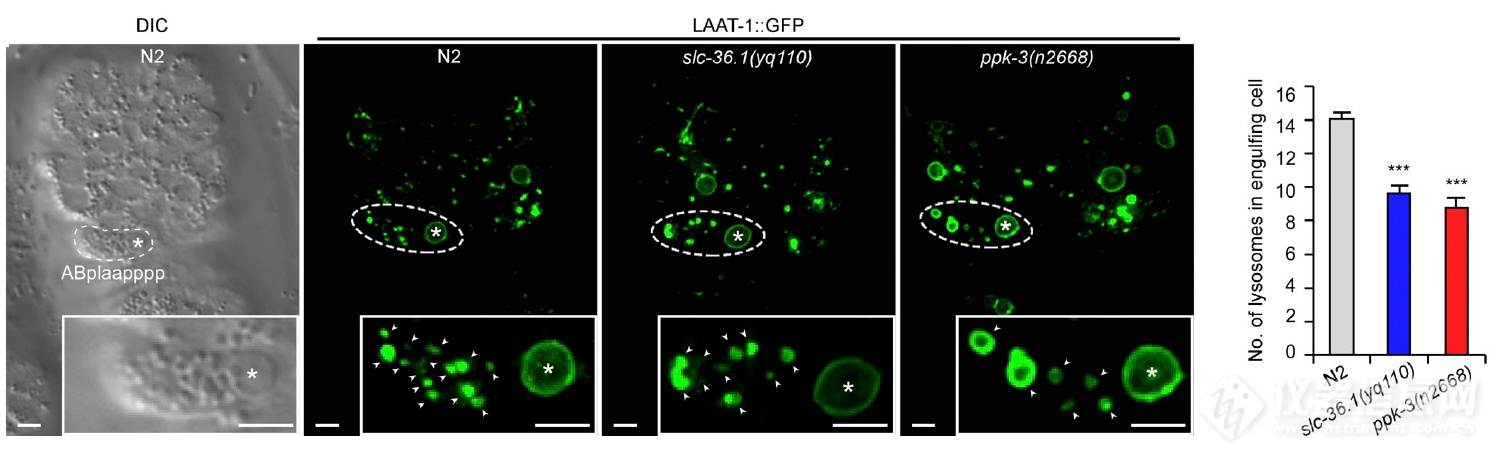
看ABplaapppp细胞对凋亡细胞的吞噬,发现SLC-36.1和PPK-3突变组细胞尸体被吞噬后生成的溶酶体显著小于野生型N2组,再次暗示两者均参与吞噬溶酶体形成后溶酶体的再生成
SLC-36.1和PPK-3均参与溶酶体再生成,那两者有何关系呢,两者同时突变引起的吞噬溶酶体形成及溶酶体再生成抑制和单独突变PPK-3无差异,两者一起调控溶酶体再形成
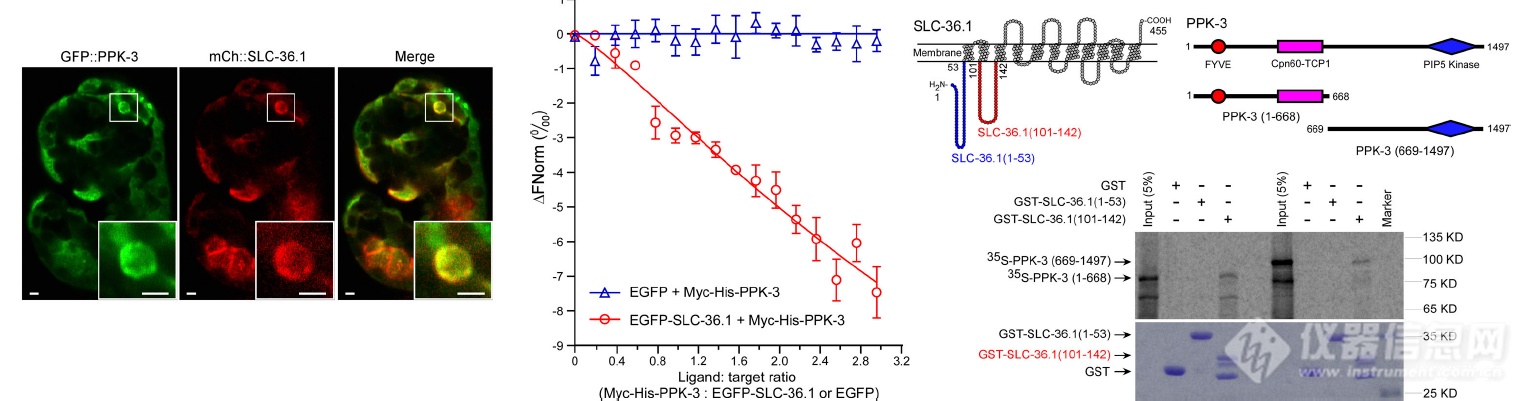
SLC-36.1和PPK-3共定位、发生互作(MST/IP)
作者还研究了SLC-36.1和PPK-3对自噬溶酶体形成及再生的影响,发现两者还参与调节自噬过程中溶酶体的再形成(文章中还按前面凋亡的套路做了其他实验 - 除了突变这两个蛋白,同时突变自噬或沉默自噬调节蛋白、加饥饿变量,看对自噬溶酶体生成的影响,略)
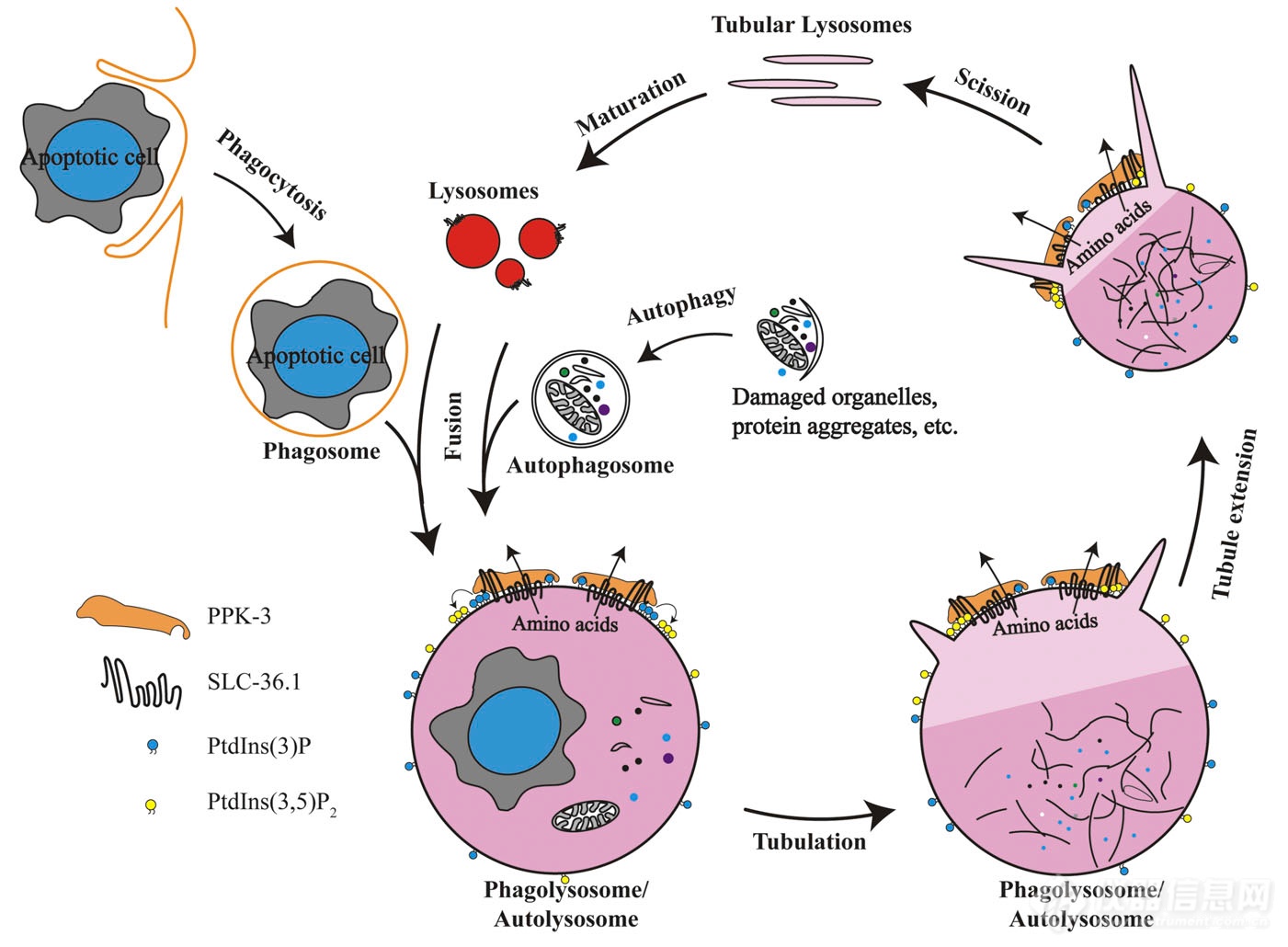
作者就是玩线虫、玩镜子的,电镜上再看一下,然后有分辨率更高的电镜归纳出一个模式图:发生凋亡或自噬后,溶酶体被召集到凋亡体/自噬体,形成吞噬/自噬溶酶体,将细胞尸体、废物等降解成基本的营养成分,SLC-36.1和PPK-3一起将降解产物转运出吞噬/自噬溶酶体,转运出去后,吞噬/自噬溶酶体“肚子”瘪了,开始伸长、剪切,逐步再形成溶酶体
文章作者提到过自噬溶酶体形成后溶酶体再生成的调节已经研究清楚了,吞噬溶酶体形成后溶酶体再生成无人研究。之于我们,工具、模型其实就那么多;之于细胞,细胞器、功能分子就那么多,底层的逻辑其实变化不会太大,差异就在于对这些基本点的把握,工具、模型是open的,只是掌握的水平不同̷̷
Qiwen Gan, Xin Wang, Qian Zhang, Qiuyuan Yin, Youli Jian, Yubing Liu, et al. The amino acid transporter SLC-36.1 cooperates with PtdIns3P 5-kinase to control phagocytic lysosome reformation [J]. J. Cell Biol. 2019.
想了解更多CNS级期刊更新内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568