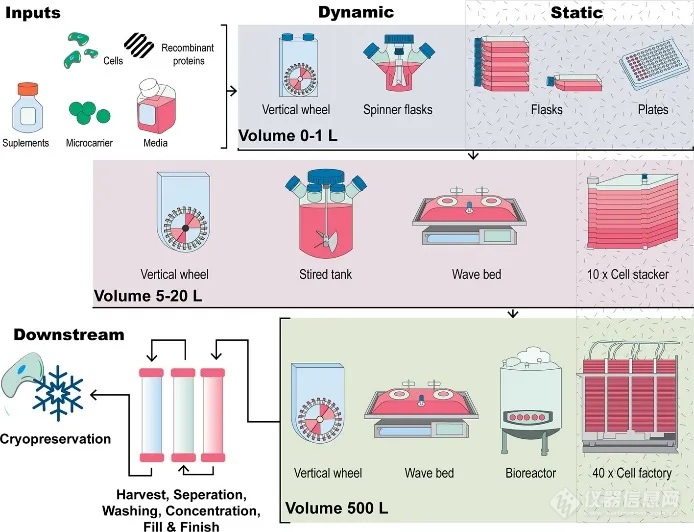
不同体积的人间充质干细胞扩增策略比较1
随着外泌体临床应用的发展,对于外泌体的数量的需求也越来越大。与LNP不同,目前没有特别有效的工业大规模合成外泌体的方法,加之外泌体的产率低,例如MSC只有1012 EVs/L,只能通过大规模的细胞培养的方式来提高外泌体的产量。
如何使用外泌体纯化金标准的超速离心来应对不同规模,特别是大规模的外泌体进行纯化了?今天我们一起来看看有哪些解决方案。
体积:0-1 L

对于实验研究或小试阶段的外泌体离心纯化,可以直接选择合适体积的定角(最大单次离心体积564 ml)或者水平转子(最大单次离心体积231 ml)进行超速离心纯化。即可获得高纯度的外泌体样品进行后续实验。

体积:5-20 L
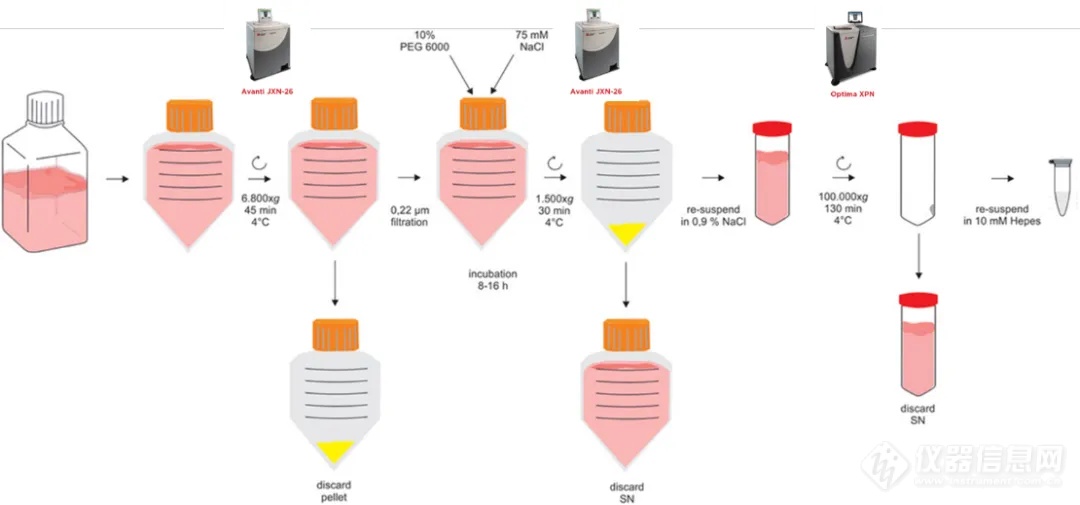
PEG沉淀法经行外泌体纯化2
对于5-20 L的体系,即使是最大的转子也无法在单次离心(通常为 2 小时)中处理超过600 ml的液体,需要对样品进行有效的减容。由于EVs与病毒具有许多共同的物理特性,可以通过聚乙二醇(PEG)沉淀法有效地从较大的上清液中吸附和沉淀EVs。通过该纯化方法得到的MSC-EV,成功的应用与治疗难治性移植物抗宿主病(GvHD) 患者。方法如下:
1
将收获的MSC-CM在6800 ×g、4°C下离心45分钟
2
将上清液(SN)通过0.22 μm孔径过滤器过滤
3
调节至10% PEG 6000和75 mM NaCl的浓度,并在4°C下孵育 8-16小时
4
将悬浮液在1500 ×g、4°C下离心 30 分钟
5
将颗粒重新悬浮并在NaCl溶液中洗涤
6
通过在100,000 ×g、4°C下超速离心130分钟将EV再沉淀
7
将获得的EV 沉淀重悬于缓冲液中并储存在-80°C直至使用

在该方法中1和4步骤时可以考虑采用大容量的Avanti JXN系列高离进行细胞和杂质的去除以及PEG胶体的沉淀(最大单次离心体积6 L)。在第6步骤使用Optima XPN系列超离经行外泌体的再沉淀。

体积:50-500 L
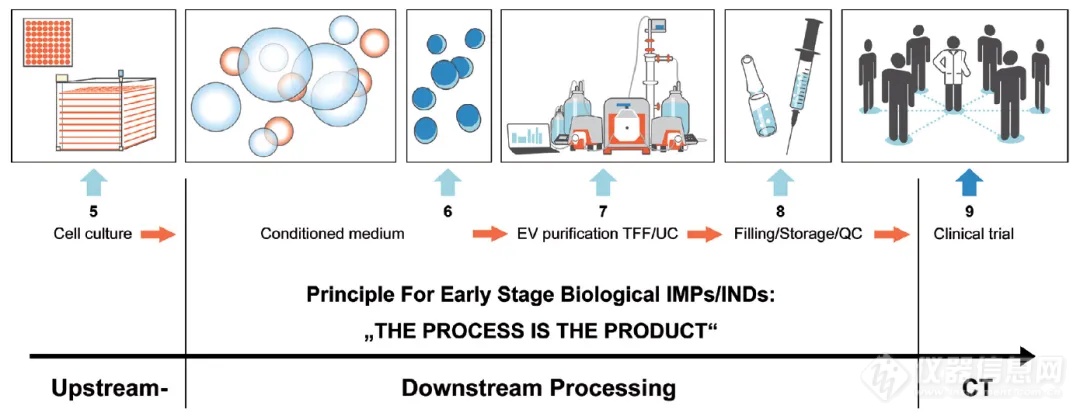
UC-MSC-EV潜在制造流程。下游纯化中使用切向流过滤 (TFF) 结合超速离心 (UC) 步骤进行UC-MSC-EV 大规模纯化4
对于大体量的细胞培养液,最适合的EV富集纯化方法尚未达成共识。TFF与超速离心相结合,是一种高效、可扩展和快速的方法4。TFF 工艺可用于在不到 2 小时的时间内将 10 L 的初始体积减少到约 200 mL5。然后通过超速离心沉淀EV样品。按照一台超速离心机的处理量600 ml离心2 h计算,每个工作日可以进行三个批次的离心,那么单台超离每日的处理通量可以达到接近100 L。除了MSC-EV,TFF/UC的方法同样适用于其他细胞系,比如NK细胞6和脂肪来源干细胞(ASC-sEVs)7。
相比而言,最后一步采用8:
•
尺寸排阻色谱法 (SEC)适用于去除蛋白质聚集体和脂蛋白颗粒9。然而,由于回收率有限,这一步骤通常会导致总颗粒数大幅下降(减少30-70%),并且以体积增加1.5倍为代价。
•
阴离子交换色谱法可产生功能活性的EV10。然而,该技术的一个缺点是大多数血清蛋白也与树脂结合,并在 500 mM NaCl 洗脱条件下与囊泡部分共洗脱。
•
肝素亲和柱似乎更具选择性地与EV的膜组分结合11,但是整个过程非常耗时。

通过4种不同的分离方案从MSC CM中分离sEVs
相应的对比实验也表明:CFF与超速离心相结合的方法(方法Ⅳ) ,能够产生与差速离心结合超速离心法(后者仍被视为sEVs分离的金标准,方法Ⅰ)相似的sEVs特性。PEG与UC(方法II)和CFF与SEC(方法III)的组合都导致了sEV特性的改变,如不同的表面抗原表达,并且在低纯度的sEV制剂中,颗粒与蛋白质的比例较低。相比而言,方法IV的sEV纯度更高12。
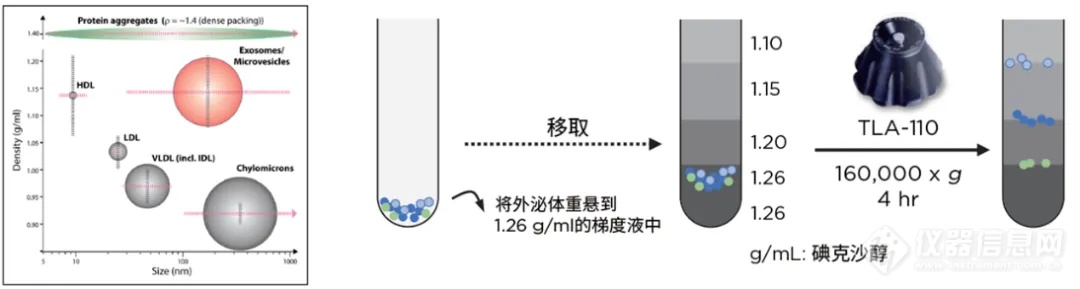
外泌体离心纯化常见杂质与等密度梯度离心流程
除此之外,如果希望进一步提高TFF/UC纯化的外泌体纯化,也可将获取的外泌体悬液进行进一步的等密度梯度离心,利用密度的差异性去除与EV粒径大小相似的乳糜颗粒和其他杂质13。
● 文章来源:
1. Biological Considerations in Scaling Up Therapeutic Cell Manufacturing.
2. Scaled Isolation of Mesenchymal Stem/Stromal Cell-Derived Extracellular Vesicles.
3. MSC-derived exosomes: A novel tool to treat therapy-refractory graft-versus-host disease.
4. Manufacturing and characterization of extracellular vesicles from umbilical cord–derived mesenchymal stromal cells for clinical testing.
5. Benchtop isolation and characterization of functional exosomes by sequential filtration.
6. Large-scale Isolation of Exosomes Derivedfrom NK Cells for Anti-tumor Therapy.
7. Skin rejuvenation and photoaging protection using adipose-derived stem cell extracellular vesicles loaded with exogenous cargos.
8. Manufacturing of Human Extracellular Vesicle-Based Therapeutics for Clinical Use.
9. Size-Exclusion Chromatography-based isolation minimally alters Extracellular Vesicles’ characteristics compared to precipitating agents.
10. Chromatographically isolated CD63CD81 extracellular vesicles from mesenchymal stromal cells rescue cognitive impairments after TBI.
11. Heparin affinity purification of extracellular vesicles.
12. A novel approach for large-scale manufacturing of small extracellular vesicles from bone marrow-derived mesenchymal stromal cells using a hollow fiber bioreactor.
13. Mesenchymal Stromal Cell Exosomes Ameliorate Experimental Bronchopulmonary Dysplasia and Restore Lung Function through Macrophage Immunomodulation.
酶标仪科普专栏丨第二期:荧光偏振(FP)介绍及应用
从分子到疾病:线粒体动力学研究取得新突破
【会议预告】第三届 3D 细胞类器官应用与高内涵成像技术研讨会邀您参加
开学啦|新学期,“心”守护实验室仪器免费巡检报名名额领取中

相关产品
上海美谱达UV-3200扫描型紫外/可见分光光度计
Leica徕卡DM750M正置显微镜
希森美康ExoCounter 全自动外泌体分析仪
智能化共聚焦高内涵成像分析系统
比利时 Bioruptor plus非接触式全自动超声破碎仪
DM3000德国徕卡leica生物显微镜
徕卡生物倒置显微镜LeicaDMi1
希森美康ExoCounter 全自动外泌体分析仪
梅特勒托利多pH 复合电极 LE438
Diagenode全自动核酸剪切仪Megaruptor ®3
化学发光成像仪Amersham ImageQuant 800
BIORUPTOR超声波细胞破碎仪new pico比利时Diagenode
美国博勒飞AMETEK Brookfield CTX质构仪
美国思拓凡 cytiva go蛋白纯化系统
ATS超高压均质机AH-D400

关注

拨打电话

留言咨询