在漫长而充满挑战的药物研发过程中,需要通过确定候选药物对细胞靶点的亲和力以及相互作用的动力学来筛选候选药物。表面等离子体共振(SPR)、生物膜干涉测量法(BLI)、石英晶体微天平(QCM)和表面声波(SAW)等多种有标记和无标记的方法被用于对从细胞中提取的或重组表达分离的蛋白进行动力学研究。这些技术要求将提纯的蛋白质固定在传感器表面,以便测量其与溶液中分析物的相互作用。
不幸的是,异源蛋白的表达和纯化很繁琐,并引入不确定性,如天然构象的改变,这可能会改变表达蛋白的结构和行为。此外,由于各种细胞异质性因素,如细胞表型、生长周期、膜的刚性、受体的可及性和构象以及邻近蛋白的影响,分离提纯蛋白受体的结合动力学可能与细胞原位天然受体的结合动力学大不相同。天然蛋白受体与分离提纯蛋白受体之间的这些生理差异及其对受体功能的潜在影响,使得基于细胞原位的相互作用分析方法更具药理学相关性和生物学意义。
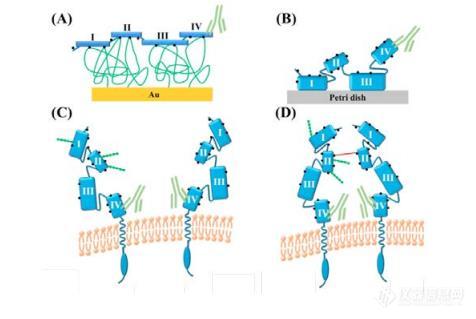
图1,不同形式的抗HER2抗体与HER2分子结合示意图
有几种方法可用于测量细胞天然受体的结合动力学,如表面等离子体共振显微镜(SPRM)、配体示踪剂(LT)和石英晶体微天平(QCM)。然而,SPRM 是唯一具有单细胞分辨率的技术,因此能够直接解决细胞异质性问题。这种固有的异质性会产生范围广泛的结合相互作用行为,而不能像通常的做法那样,简单地将整个细胞群的行为平均处理。
本案例对人表皮生长因子受体 2(HER2)的天然形式和重组形式的结合动力学进行了详细研究和比较。由于各种因素的影响,重组形式和天然形式的 HER2 受体的取向可能不同。图 1 展示了通过(A)胺基偶联固定在葡聚糖基质芯片和(B)静电作用固定在培养皿上的 HER2 重组蛋白。固定化后,重组 HER2(rHER2)受体的结构域 IV 可及性更好。然而,细胞原位天然受体HER2是定向的,结合结构域 IV 非常靠近(C)活细胞和(D)固定细胞的细胞膜。因此,细胞膜可以通过对抗体施加一定的立体位阻影响相互作用。通过对不同受体方向的观察,我们可以发现,提纯的重组 HER2 受体固定后,结合域 IV 比其天然形式更容易接近。
利用 SPRm200 系统研究了抗 HER2 抗体与 SKBR3 细胞原位的 HER2 的结合动力学,并与分离提纯的 rHER2 的结合动力学进行了比较。培养 SKBR3 细胞并让其附着于二分之一的聚赖氨酸涂层传感器表面(图 2A);另一半传感器表面用作参照区。进行系列动力学滴定注射,使细胞先后暴露于6种浓度的anti-HER2-FITC 溶液(1.00、5.00、10.00、20.00 和 50.00 nM)中。
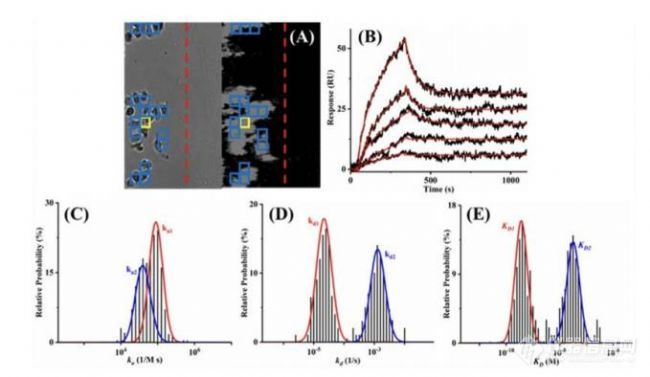
图2,SPRm200细胞原位分子互作动态分析系统实验分析
ImageSPR™ 软件用于分析 SPRM 传感图。图 2B 显示了单个感兴趣区 (ROI) 的代表性结合反应。对蓝色 ROI 中观察到的结合反应进行分析,以生成图 2C-E 中的结合直方图。对直方图进行高斯分布拟合,以确定每个动力学参数的平均值和 95% 的置信区间。抗体与天然 HER2 受体之间的结合相互作用遵循 1:2 结合模型。这一观察与先前的研究结果非常吻合,先前的研究表明赫赛汀与天然和糖基化的 HER2 受体的结构域 IV 的结合方式为 1:2 结合,与非糖基化受体的结合力更强,而与糖基化受体的结合力更弱。
将从 SKBR3 细胞的天然受体获得的动力学相互作用值与从提纯、固定的重组受体获得的值进行了比较。对重组受体rHER2 蛋白的结合研究是在采用 BI-DirectFlow™ 技术的五通道 BI-4500A SPR 系统上进行的。rHER2 分子通过胺基偶联固定在羧甲基葡聚糖(CM-葡聚糖)传感器芯片上。
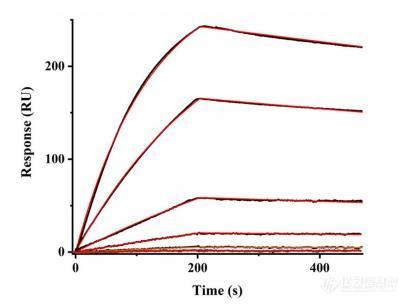
图3,BI-4500A多功能分子互作分析仪实验分析
由于 rHER2 受体上缺乏糖基化修饰,因此采用更简单的 1:1 相互作用动力学模型进行拟合分析(图 3)。如表 1 所示,与重组受体相比,细胞内天然受体的结合速率较慢。这一点在第二组细胞原位动力学峰上表现得尤为明显,这些峰归因于糖基化,其结合率慢约 3.5 倍,亲和力弱约 17 倍。我们怀疑提纯的 rHER2受体固定后的取向和缺乏糖基化阻碍有助于提高 rHER2 受体结合域 IV 的可及性,从而使抗体结合速率更快,亲和力更强。
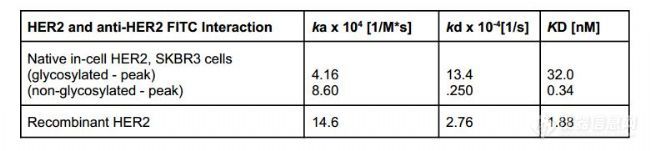
表1,抗 HER2 抗体与细胞原位HER2和重组 HER2 相互作用测得的动力学参数
本案例在细胞原位天然蛋白受体形式和固定重组蛋白受体形式之间观察到了截然不同的相互作用行为。这些差异凸显了基于细胞原位的分子互作动力学研究对药物开发的重要性,从而能更全面地评估药效、生物相关药效代动力学和基本的细胞生物学过程。

SPRm200系统将光学显微镜与分子互作技术相结合,专为观察和测量细胞膜表面蛋白和其他目标分子结合亲和力及动力学常数设计,为分子相互作用的研究开辟了新的前沿。
(1)SPRm200系统无需对观察目标进行标记,可以实时定量的进行检测;
(2)可同时可视化观察细胞结构和局部结合活性;
(3)无需提取细胞膜蛋白,即可在正常活细胞状态下观察和测量药物和膜蛋白的实时相互作用;
(4)探测器测量每个像素的SPR响应,并将其映射到SPR图像中,在每个像素处,记录一个传感图,从而提供更多的局部信息。
SPRM技术使在自然条件下研究细胞表面膜蛋白与其他目标分子结合和相互作用成为可能。SPRm200细胞原位分子互作动态分析系统凭借其卓越的灵敏度和稳定性,助力科学研究新发现,推动药物开发新高度。
参考文献
1) Wang, Qi, et al. "Research advances on surface plasmon resonance biosensors." Nanoscale 14.3 (2022):564-591.
2) Olaru, Andreea, et al. "Surface plasmon resonance (SPR) biosensors in pharmaceutical analysis." Critical reviews in analytical chemistry 45.2 (2015): 97-105.
3) Tao, Yi, et al. "Tailored biosensors for drug screening, efficacy assessment, and toxicity evaluation." ACSsensors 6.9 (2021): 3146-3162.
4) Dong, Tianbao, et al. "Live Cells versus Fixated Cells: Kinetic Measurements of Biomolecular Interactions with the LigandTracer Method and Surface Plasmon Resonance Microscopy." Molecular Pharmaceutics (2023).
会议预告 | 普瑞麦迪与您相约中国神经科学学会第十七届全国学术会议
3D打印多血管网络和功能构建:突破组织工程的新技术
展会回顾 | 祝贺细胞基因及核酸药物北京亦庄峰会圆满落幕
月满中秋·阖家团圆 | 普瑞麦迪提前祝您中秋节快乐

相关产品

关注

拨打电话

留言咨询