
方案摘要
方案下载| 应用领域 | 医疗/卫生 |
| 检测样本 | 全血/血清/血浆 |
| 检测项目 | 生化检验>其他 |
| 参考标准 | 低氧 糖尿病 线粒体活性氧 |
线粒体活性氧(ROS)的过度产生是糖尿病并发症发生的中心机制。最近,缺氧已被证实在糖尿病中发挥额外的致病作用。在这项研究中,我们假设ROS 过量产生是继发于高血糖抑制缺氧诱导因子-1 (HIF-1)导致的缺氧反应受损。研究人员分析了暴露于低氧环境下的健康人和1 型糖尿病患者血液中的ROS 水平。在糖尿病小鼠模型中,研究了肾mIMCD-3 细胞和肾脏中HIF-1、葡萄糖水平、ROS 产生及其功能后果的关系。研究发现在糖尿病患者中,低氧暴露会增加循环ROS,但在非糖尿病患者中则不会;高糖通过HIF 脯氨酸羟化酶(PHD)依赖机制抑制了糖尿病动物的缺氧细胞和肾脏中的HIF-1 的表达;HIF-1 信号通路受损,通过丙酮酸脱氢酶激酶1 (PDK1)介导的线粒体呼吸增加,促进线粒体ROS 的过量产生;在糖尿病患者中,HIF-1 功能的恢复降低了持续高血糖情况下ROS 的过度产生,并对细胞凋亡和肾损伤具有保护作用。表明HIF-1 的抑制在糖尿病线粒体ROS 过剩产生中起着核心作用,并且是糖尿病并发症的潜在治疗靶点。
文章题目:Repression of hypoxia-inducible factor-1 contributes to increased mitochondrial reactive oxygen species production in diabetes
低氧诱导因子-1 的抑制可增加糖尿病患者线粒体活性氧的产生
文章出处:Elife, 2022, 11: undefined.瑞典斯德哥尔摩卡罗林斯卡医学院分子医学与外科学系
工作站使用情况:Ruskinn INVIVO2
使用气体浓度:低氧(1% O2)
摘要:线粒体活性氧(ROS)的过度产生是糖尿病并发症发生的中心机制。最近,缺氧已被证实在糖尿病中发挥额外的致病作用。在这项研究中,我们假设ROS 过量产生是继发于高血糖抑制缺氧诱导因子-1 (HIF-1)导致的缺氧反应受损。研究人员分析了暴露于低氧环境下的健康人和1 型糖尿病患者血液中的ROS 水平。在糖尿病小鼠模型中,研究了肾mIMCD-3 细胞和肾脏中HIF-1、葡萄糖水平、ROS 产生及其功能后果的关系。研究发现在糖尿病患者中,低氧暴露会增加循环ROS,但在非糖尿病患者中则不会;高糖通过HIF 脯氨酸羟化酶(PHD)依赖机制抑制了糖尿病动物的缺氧细胞和肾脏中的HIF-1 的表达;HIF-1 信号通路受损,通过丙酮酸脱氢酶激酶1 (PDK1)介导的线粒体呼吸增加,促进线粒体ROS 的过量产生;在糖尿病患者中,HIF-1 功能的恢复降低了持续高血糖情况下ROS 的过度产生,并对细胞凋亡和肾损伤具有保护作用。表明HIF-1 的抑制在糖尿病线粒体ROS 过剩产生中起着核心作用,并且是糖尿病并发症的潜在治疗靶点。
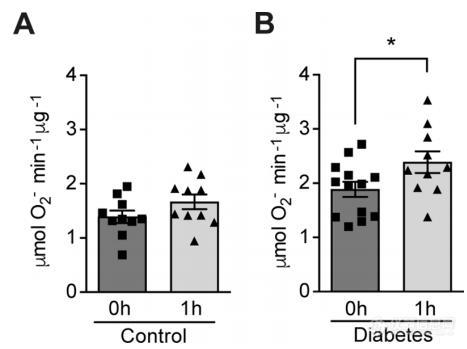
Figure 1. Hypoxia increases circulating ROS in patients with diabetes but not in control subjects without diabetes. Healthy controls (A) and subjects with type 1 diabetes (B) were exposed to intermittent hypoxia for 1 hr. Peripheral blood was taken before (0h) and after (1h) hypoxia exposure. ROS levels were analyzed using Electron Paramagnetic Resonance (EPR) Spectroscopy with CPH spin probes (n = 10–13). Data are represented as mean ± SEM. *, p < 0.05 analysed using unpaired two-sided Student’s t-test. This figure has one figure supplement.
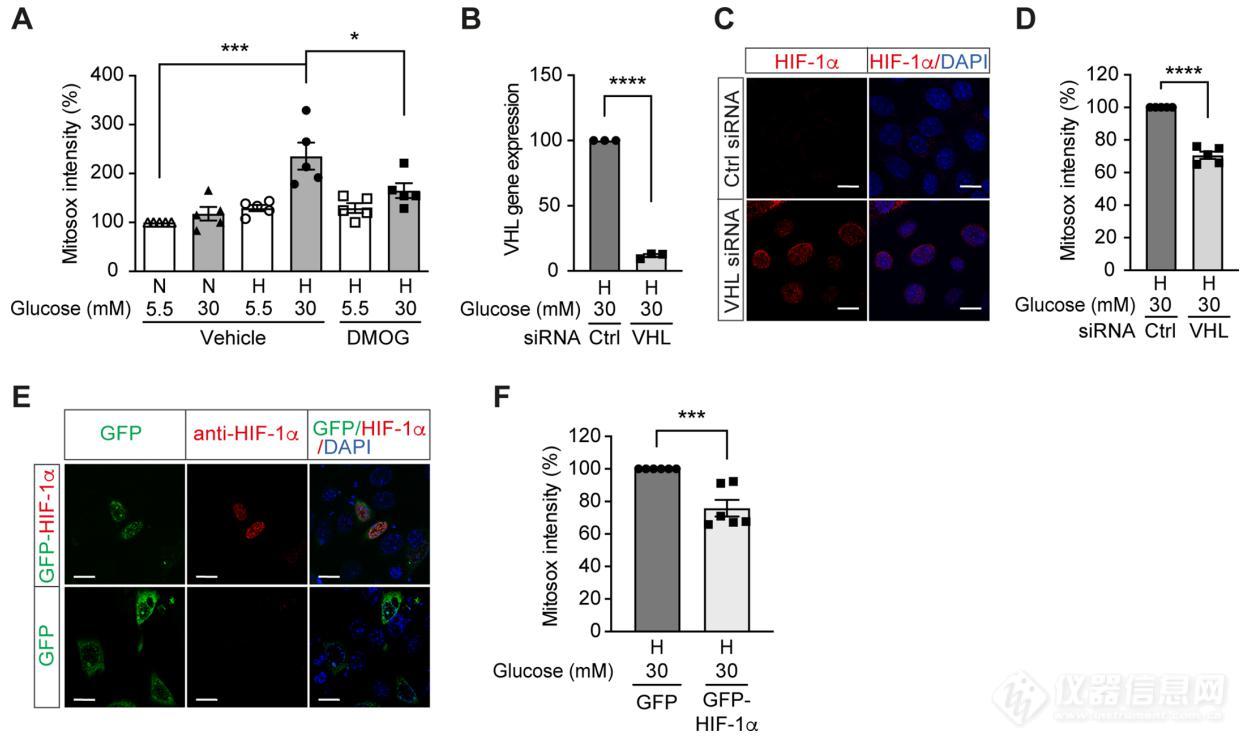
Figure 3. High glucose levels induce mitochondrial ROS overproduction in hypoxia, which can be rescued by promoting HIF-1 function. (A) Mitochondrial ROS levels were measured as mitosox intensity in mIMCD-3 cells cultured in normal (5.5 mM) or high (30 mM) glucose media in normoxia (N) or hypoxia (H) for 24 hr in the presence of DMOG or vehicle (n = 5). (B–D) mIMCD-3 cells were transfected with von Hippel–Lindau tumour suppressor (VHL) or control (Ctrl) siRNA, and exposed to hypoxia (H) and 30 mM glucose for 24 hr. VHL gene expression (B, n = 3), endogenous HIF-1α expression (red) and DAPI staining (blue) (C) and mitochondrial ROS levels (D, n = 5) were assessed using quantitative RT-PCR, fluorescent immunocytochemistry and flow cytometry, respectively. (E and F) mIMCD-3 cells were transfected with plasmids encoding GFP or GFP-HIF-1α,and exposed to hypoxia and 30 mM glucose for 24 hr. (E) Expression of GFP and GFP-HIF-1α (green) were detected using confocal microscopy. The nuclear HIF-1α expression was confirmed by immucytochemistry using anti-HIF-1α antibody (red). Nuclei were stained blue with DAPI. (F) Mitochondrial ROS levels are shown (n = 6). The mitosox intensity of cells cultured under control conditions were considered as 100%.
参与者间歇性低氧(13% O2) 1 小时,研究发现糖尿病患者缺氧时外周血ROS 水平升高。然而,在血糖正常的对照组中,缺氧并没有改变ROS 水平(图1AB);
我们进一步研究了HIF-1 对糖尿病患者线粒体ROS 产生的影响。肾髓质上皮细胞mIMCD-3 细胞低氧(1% O2)培养24 h;研究发现暴露于高糖水平和缺氧的细胞线粒体ROS 水平升高,HIF-1 激活剂DMOG 通过激活HIF,减少缺氧时高糖水平引起的线粒体ROS 过度产生(图3A);在暴露于缺氧和高糖水平的mIMCD3 细胞中,沉默VHL 基因(图3B)后,核HIF-1α表达增加(图3C),导致线粒体ROS下降(图3D);在低氧和高血糖条件下,过表达HIF-1α的mIMCD3 细胞线粒体ROS 减少(图3E-F);表明缺氧和高血糖联合暴露的细胞中ROS 的过度产生依赖于HIF-1 功能的损害,当HIF-1 活性保持时,ROS 可以被减弱。


低氧/厌氧产品案例——阻塞性睡眠呼吸暂停(OSA)与血脑屏障研究
低氧/厌氧产品案例——低氧与心梗研究
低氧/厌氧产品案例——低氧与心梗研究
相关产品

关注

拨打电话

留言咨询