
方案摘要
方案下载| 应用领域 | 制药 |
| 检测样本 | 生物药品药物研发 |
| 检测项目 | |
| 参考标准 | / |
离子分子量小,在细胞中的浓度一般为毫摩尔级,使用传统的表面等离子共振技术(SPR)以及生物膜表面干涉技术(BLI)技术较难检测,而MST技术对小分子的分子量大小没有要求,即便是离子与蛋白的互作也可以轻松检测。
方案标题:MST技术在离子检测中的解决方案
检测样品:蛋白
检测项目:结合亲和力
应用领域:植物学
方案摘要:
离子分子量小,在细胞中的浓度一般为毫摩尔级,使用传统的表面等离子共振技术(SPR)以及生物膜表面干涉技术(BLI)技术较难检测,而MST技术对小分子的分子量大小没有要求,即便是离子与蛋白的互作也可以轻松检测。
方案详情:
MST应用案例——蛋白质和离子互作
植物硝态氮新受体
硝态氮不仅是植物必需的矿质营养盐,从20世纪九十年代,科学家已经可以在基因水平确定硝态氮是一种信号分子,但并不清楚植物感受它的机制。2022年,西北农林科技大学的研究人员发现所有拟南芥NIN样蛋白(NLP)转录因子的突变都破坏了植物的初级硝酸盐反应和发育程序。对NIN-NLP7嵌合体和硝酸盐结合的分析表明,NLP7通过其氨基末端对硝酸盐感知进行去表达。此外,开发的荧光硝酸盐感受器实现了植物中单细胞硝酸盐动力学的可视化,表明NLP7为主要的硝酸盐传感器。
为了证明NLP7可以直接结合硝酸盐,作者使用Monolith来检测NLP7和NO3-亲和力(图A),为了进一步探究NO3-结合位点,研究人员表达了NLP7的N端,结果显示,N-NLP7同样可与NO3-结合,且亲和力与完整NLP7蛋白一致。此外,NLP7不与NO3-类似的ClO3-结合。
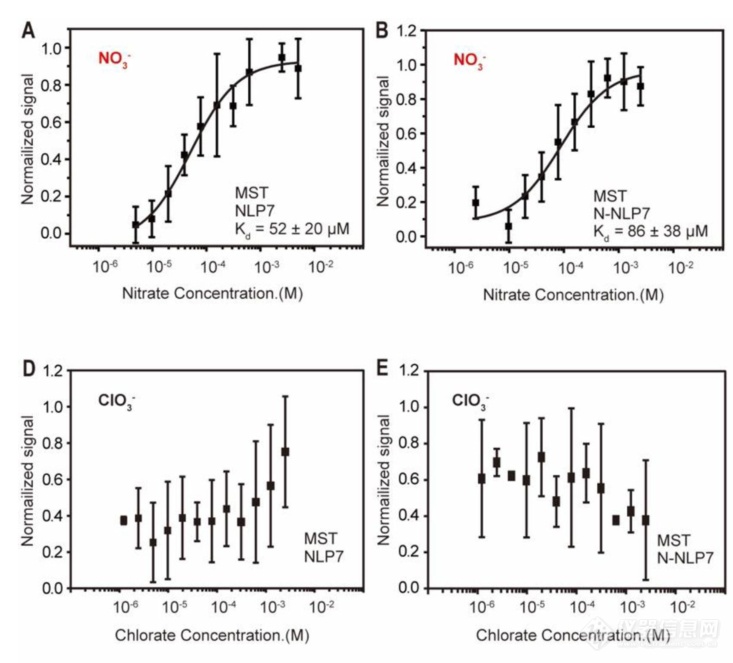
Kun-Hsiang Liu et al., NIN-like protein 7 transcription factor is a plant nitrate sensor.Science377,1419-1425(2022).
植物免疫抑制与广谱抗病机理
植物如何平衡抗病和生长发育平衡,中国科学院分子植物科学卓越创新中心何祖华团队研究揭示了以ROD1为免疫抑制中枢,通过降解超氧活性因子ROS,抑制植物的免疫反应,平衡植物防御和生长之间的冲突。
水稻中,ROD1编码一种Ca2+传感器蛋白,以Ca2+依赖的方式结合到磷酸肌醇脂质,靶向至特定膜区域。ROD1刺激过氧化氢酶CatB的活性,促进活性氧(ROS)清除,抑制免疫;当有稻瘟菌侵染时,植物通过降解ROD1减弱其功能,产生有效的防卫反应。作者使用Monolith检测ROD1可直接与Ca2+结合,并鉴定出活性结果位点。
另一方面,研究发现病原稻瘟菌中具有与ROD1结构类似的毒性蛋白AvrPiz-t,在植物体内盗用ROD1的免疫抑制途径,实现侵染的目的,进而与病原菌共同生存。通过MST检测到AvrPiz-t与Ca2+结合,进而盗用ROD1途径。
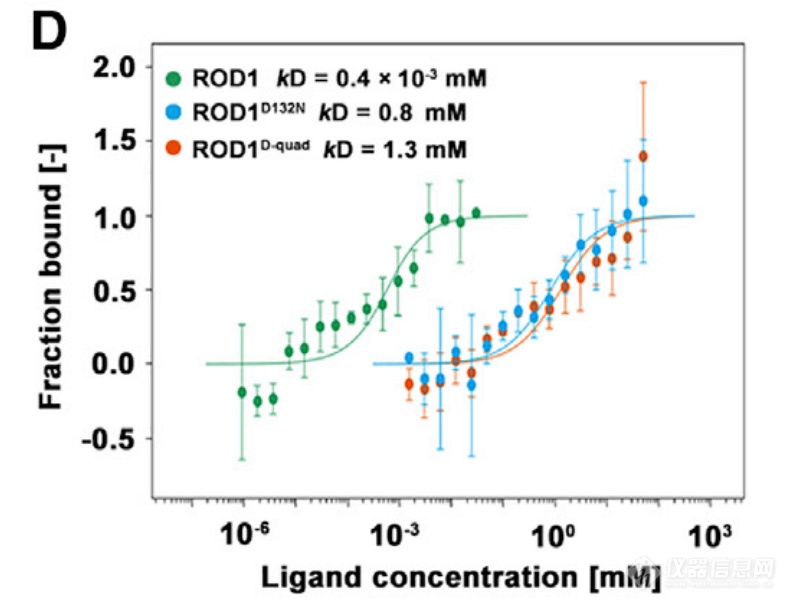
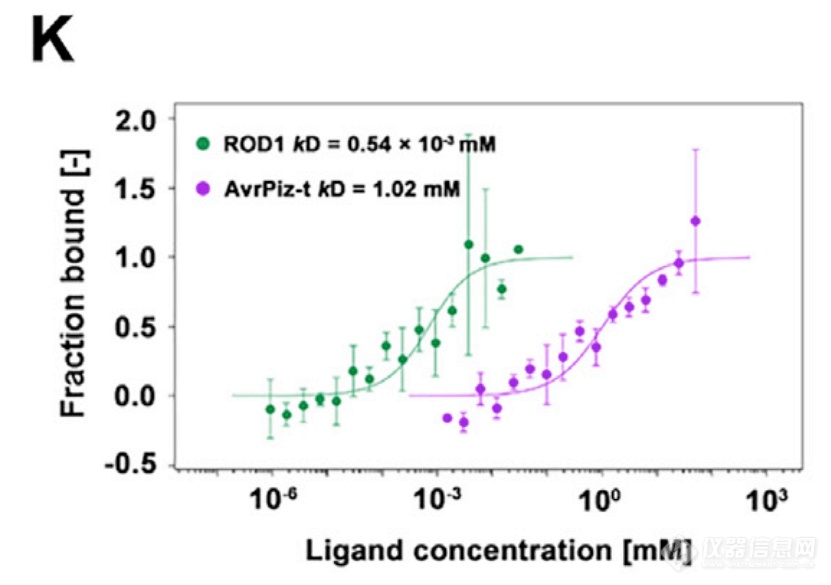
Gao M, He Y , Yin X , et al. Ca 2+ sensor-mediated ROS scavenging suppresses rice immunity and is exploited by a fungal effector. Cell, 2021.
铜元素调节水稻广谱抗病毒的机制
铜是植物生长发育的重要调节剂,然而铜对病毒入侵的反应机制尚不清楚。
2022年,北京大学的研究人员发现SPL9介导的miR528转录激活为已建立的AGO18- miR528 - L- AO抗病毒防御增加了一个调控层。研究发现,Cu2+通过抑制SPL9的蛋白水平来抑制miR528的转录激活,进而提高ROS水平,增强AO积累量及其酶活,从而加强抗病毒反应,阐明了铜稳态的分子机制、调控网络以及SPL9-miR528-AO抗病毒途径。
为了检测SPL9和Cu2+之间的直接相互作用,作者纯化了SPL9 DNA结合区域(SPL9 SBP),使用Monolith分子互作仪检测其与Cu2+的互作。结果显示SPL9 SBP直接与Cu2+结合,但不与Ca2+结合。
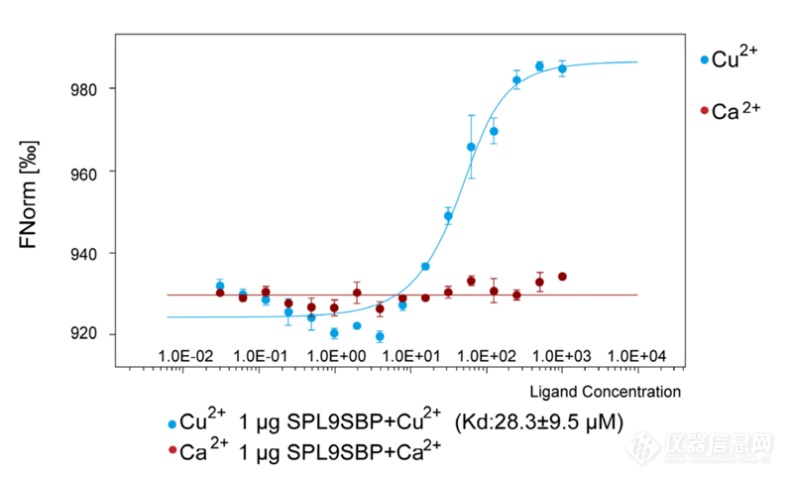
Shengze Yao et al., The key micronutrient copper orchestrates broad-spectrum virus resistance in rice.Sci. Adv.8, eabm0660(2022).
低温特异钙信号的感知和应答机制
暴露在寒冷的环境中会触发细胞质Ca2+的激增,导致植物的转录重编程。然而,Ca2+信号是如何被感知和传递到下游的低温信号通路仍然是未知的。
2022年,中国农业大学的研究人员发现,钙依赖性蛋白激酶28 (CPK28)启动了一个磷酸化级联,从而作用于低温诱导Ca2+信号下游的转录重编程。这项研究阐明了一种先前未知的机制,揭示了植物从质膜到细胞核的快速感知和转导低温信号的关键策略。
研究中,作者通过Monolith分子互作仪检测到CPK28可直接与Ca2+结合,而CPK28 EF-hand位点突变蛋白CPK28EFm与Ca2+亲和力降低了6倍,证明了EF-hand对结合Ca2+非常重要。
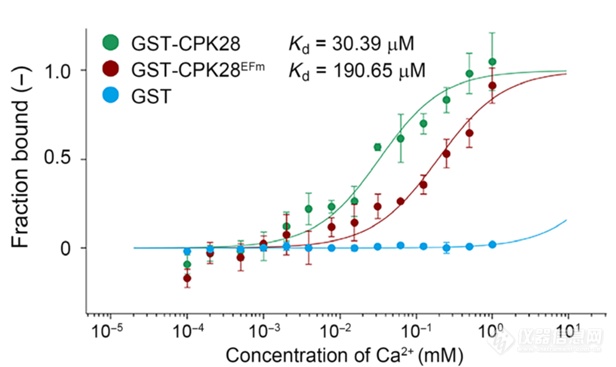
Yanglin Ding et al., CPK28-NLP7 module integrates cold-induced Ca2+ signal and transcriptional reprogramming in Arabidopsis.Sci. Adv.8, eabn7901(2022)


【设备更新】NanoTemper抗体药物开发实验指南
【设备更新】生物制剂研究人员必备宝典-DLS动态光散射技术指南
【设备更新】MST 技术在中药成分靶点检测中的解决方案
相关产品
NanoTemper Monolith X 新一代生物分子互作检测仪
NanoTemper Dianthus高通量分子互作筛选系统
NanoTemper PR Panta蛋白稳定性分析仪
NanoTemper PR Panta 多功能蛋白稳定性分析仪
NanoTemper Monolith 生物分子互作检测仪
NanoTemper PR系列高通量蛋白稳定性分析仪
【新品】蛋白质表达和功能快速筛选系统 Andromeda X
全自动多功能蛋白稳定性平台PR Panta+机械臂自动上样器
超高分辨率蛋白稳定性分析仪 Panta (SLS)
测定蛋白寡聚化结合 生物分子互作检测仪
诺坦普高通量蛋白稳定性分析仪 PR Panta
诺坦普高通量蛋白稳定性分析仪 抗体等蛋白制品制剂筛选
诺坦普高通量分子互作筛选系统Dianthus
诺坦普NanoTemper PR Panta蛋白稳定性分析
诺坦普 生物分子互作新一代检测仪Monolith X

关注

拨打电话

留言咨询