超分辨率荧光显微镜在揭示动物细胞中详细的亚细胞结构方面取得了巨大的成功。然而,由于许多技术挑战,包括植物细胞的一般高荧光背景和细胞壁的存在,其在植物细胞生物学中的应用仍然极其有限。在本文中,作者利用随机光学重建显微术(STORM)对拟南芥幼苗完整根系进行成像,利用超分辨率图像对拟南芥根尖不同部位皮层微管的空间组织进行了定量分析。
一.研究介绍
植物细胞具有高度各向异性的形状,对细胞功能和多细胞发育很重要。皮层微管阵列是决定植物细胞形态发生的关键因素之一。在快速扩张的植物细胞中,皮质微管通常密集排列,彼此平行,横向于生长方向。皮层微管结构和组织的详细定量信息对于理解细胞扩增和定向生长的机制至关重要。因此,在本研究中使用皮质微管阵列作为测试用例,以开发在整个幼苗根尖内进行超分辨率成像的技术。通过将STORM与可变角度落射荧光显微镜相结合,成功地证明了整个植物组织成像中 20-40nm的空间分辨率。如此高的空间分辨率对于解决植物根部活动伸长区致密的皮质微管结构至关重要的。
二.研究结果
皮质微管阵列的图像是根据17-25分钟内捕获的 20,000-30,000帧重建的。由于根样本成像中的背景噪声普遍较高,与之前发表的几种动物细胞 STORM成像相比,当前研究选择了较慢的20Hz帧速率。
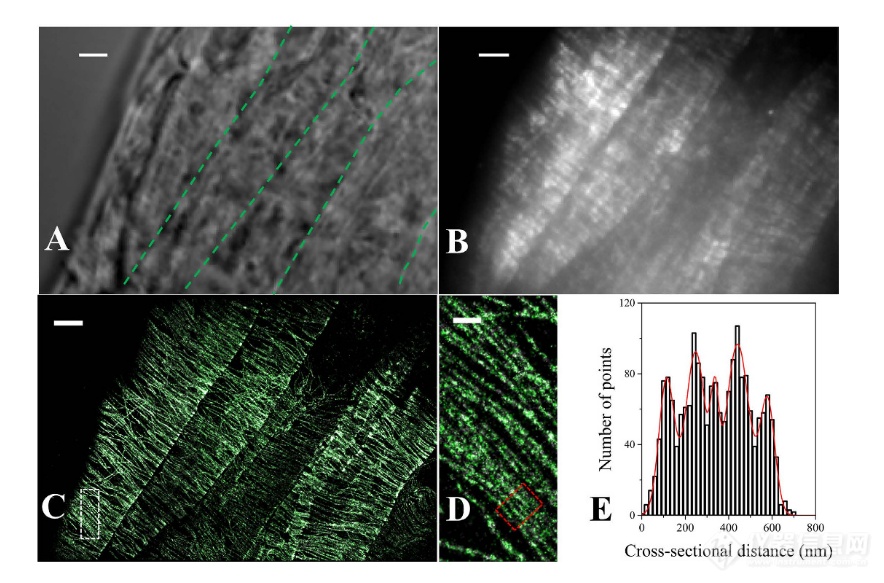
拟南芥根尖伸长区完整表皮植物细胞皮质微管网络的 VAEM-STORM 成像
(A)伸长区细胞的明视场图像。这里所示的单元在图4A中也被突出显示为区域d。在亮场图像中,细胞之间的边界用绿色虚线突出显示。(B)伸长细胞中致密皮层微管网络的落射荧光图像和(C)相应的STORM图像。(D)放大的STORM图像,如(C)中的白色区域所示。(E)细胞中微管束的横截面轮廓[(D)中红色框中突出显示]。直方图显示红框指定区域内位置的横截面分布。红线是五个简单高斯函数的拟合结果,显示了相距80.0 nm ~ 137.9 nm的单个微管的中心。比例尺:3 μ m(A-C)和500 nm(D)。
皮质微管阵列通过直接引导细胞壁物质的沉积,在控制植物细胞生长和各向异性方面起着关键作用。这主要是通过确定纤维素合成和沉积过程中纤维素合酶复合物的定向运动和质膜插入位点而发生的,这限制了植物细胞扩张的方向。

手动和使用微丝分析仪(MFA)软件进行分析。(A)整个根尖的明视场图像。图像是具有与落射荧光和STORM成像相同的光学设置(100×物镜)的单个图像的拼贴。因此,在相同放大倍数下,可以从亮场图像中容易地确定用于STORM成像的细胞在整个根部中的位置。(B,C)显示用于STORM成像的细胞位置的放大明视场图像。(D)亮场图像中突出显示的细胞的VAEM图像和(E)STORM图像,对应于(B)中的红框。(F-G)VAEM图像(F)和STORM图像(G)中微管丝方向的极坐标图,分别在(D,E)的红色框中突出显示。单元的长轴在极坐标图中以紫色轴表示。(H-K)使用MFA软件进行定向分析的结果。偏移角为90 °(长轴),在极坐标图中未校正,与(F,G)一致。主要角度在极坐标图中以绿色星形突出显示。请注意,由于两种不同的测量方法,图(F、G)和图(H-K)的形式不同。比例尺:30 μ m(A)和3 μ m(B-I)。
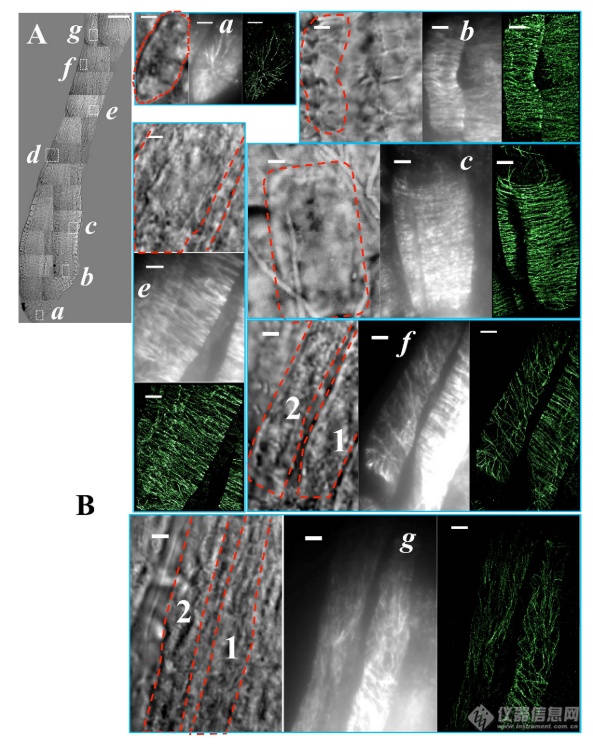
完整拟南芥根部不同部位皮质微管的 VAEM-STORM 成像
(A)根尖明视野图像的拼接。突出显示了穿过根尖的七个区域(a-g),并选择用于dSTORM成像。(B)(A)中白框区域的放大明视场和相应的落射荧光和STORM图像。显示完整拟南芥根尖的帽细胞(a)、分生组织区(b)、伸长区(c-d)、分化区(g)和伸长与分化之间的过渡区(e-f)中的表皮细胞的皮层微管的图像。注意,图1中显示了区域d中细胞的放大明场图像、落射荧光图像和STORM图像。单元格边界以红色虚线突出显示。区域f和g中的细胞显示出不同的微管组织模式,因此它们在图5中被分别分析为f1、f2和g1、g2,如在相应的明场图像中所示。比例尺:50 μ m(A)和3 μ m(B,a-g)。
以上,作者成功地将STORM成像技术应用于拟南芥根细胞皮层微管,分辨率低于50nm。结果表明,不同分化阶段或类型的细胞皮层微管的密度和空间组织存在显著差异。所开发的方法可应用于植物细胞生物学过程,包括细胞骨架、细胞器亚结构和膜结构域的附加元件的成像。我们也期望这些超分辨率成像的进展将使植物细胞中生物过程的详细空间组织取得关键进展。
三. iSTORM预约试拍
目前在国内,随机光学重建显微镜STORM已成功实现商用,有需要STORM成像技术进行实验研究的专家老师们,可预约获得 iSTORM 超高分辨率显微成像系统试拍服务~
力显智能现已发布的超高分辨率显微成像系统 iSTORM,成功实现了光学显微镜对衍射极限的突破,使得在20纳米的分辨率尺度上从事生物大分子的单分子定位与计数、亚细胞及大分子复合物结构解析、生物大分子生物动力学等的研究成为现实,从而给生命科学、医学等领域带来重大突破。

超高分辨率显微成像系统iSTORM具有20nm超高分辨率、3D成像、多通道同时成像光路设计、实时重构、2小时新手掌握等特点,已实现活细胞单分子定位与计数,并提供荧光染料选择、样本制备、成像服务与实验方案整体解决方案,以纳米级观测精度、高稳定性、广泛环境适用、快速成像、简易操作等优异特性,获得了超过50家科研小组和100多位科研人员的高度认可。
参考文献
References
1. Huang, B., Babcock, H. & Zhuang, X. Breaking the Diffraction Barrier: Super-Resolution Imaging of Cells. Cell 143, 1047–1058 (2010). 2. Hell, S. W. Far-Field Optical Nanoscopy. Science 316, 1153–1158 (2007). 3. Rust, M. J., Bates, M. & Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods 3, 793–796 (2006). 4. Bates, M., Huang, B., Dempsey, G. T. & Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science 317, 1749–1753 (2007). 5. Huang, B., Wang, W., Bates, M. & Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science 319, 810–813 (2008). 6. Betzig, E. et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science 313, 1642–1645 (2006). 7. Hess, S. T., Girirajan, T. P. K. & Mason, M. D. Ultra-High Resolution Imaging by Fluorescence Photoactivation Localization Microscopy. Biophys. J. 91, 4258–4272 (2006). 8. Ober, R. J., Ram, S. & Ward, E. S. Localization Accuracy in Single-Molecule Microscopy. Biophys. J. 86, 1185–1200 (2004). 9. Yildiz, A. & Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Acc. Chem. Res. 38, 574–582 (2005). 10. Dedecker, P., Flors, C., Hotta, J.-I., Uji-i, H. & Hofkens, J. 3D Nanoscopy: Bringing Biological Nanostructures into Sharp Focus. Angew. Chem.-Int. Edit. 46, 8330–8332 (2007). 11. Fölling, J. et al. Fluorescence Nanoscopy with Optical Sectioning by Two-Photon Induced Molecular Switching using ContinuousWave Lasers. ChemPhysChem 9, 321–326 (2008). 12. Jones, S. A., Shim, S.-H., He, J. & Zhuang, X. Fast, three-dimensional super-resolution imaging of live cells. Nat. Methods 8, 499–505 (2011). 13. Vaziri, A., Tang, J., Shroff, H. & Shank, C. V. Multilayer three-dimensional super resolution imaging of thick biological samples. Proc. Natl. Acad. Sci. USA 105, 20221–20226 (2008). 14. Ehrhardt, D. W. & Frommer, W. B. New Technologies for 21st Century Plant Science. Plant Cell 24, 374–394 (2012). 15. Durst, S. et al. Organization of perinuclear actin in live tobacco cells observed by PALM with optical sectioning. J. Plant Physiol. 171, 97–108 (2014). 16. Liesche, J., Ziomkiewicz, I. & Schulz, A. Super-resolution imaging with Pontamine Fast Scarlet 4BS enables direct visualization of cellulose orientation and cell connection architecture in onion epidermis cells. BMC Plant Biol. 13, 226 (2013). 17. Gustafsson, M. G. L. Nonlinear structured-illumination microscopy: Wide-field fluorescence imaging with theoretically unlimited resolution. Proc. Natl. Acad. Sci. USA 102, 13081–13086 (2005).
关于我们
About us
新品清华发布!国产超分辨iSTORM之路,虽千万人吾往矣~
国产超分辨iSTORM新品!力显智能于清华发布新品活细胞超高分辨率显微成像系统!
端午钜惠|1000元细胞优惠券限时大放送!
解放双手篇|都2023年了,你还在用手动计数?

相关产品

关注

拨打电话

留言咨询