
神经元离子通道受到细胞内信号分子的精细调节,例如蛋白激酶A (PKA)、蛋白激酶C (PKC)、脂质和钙离子,所有这些都使用支架蛋白来协调实现时空特异性的蛋白质组装。然而,由于光的固有衍射极限,尚未实现对单个AKAP79/150蛋白质复合物(<100 nm)与这些蛋白质的光学观察。
本文使用STORM和电生理学直接可视化包含AKAP79/150、L通道、M通道、TRPV1通道和G蛋白偶联受体的单个信号复合物。根据这些发现,本文观察了这些不同通道的功能耦合取决于AKAP79/150。
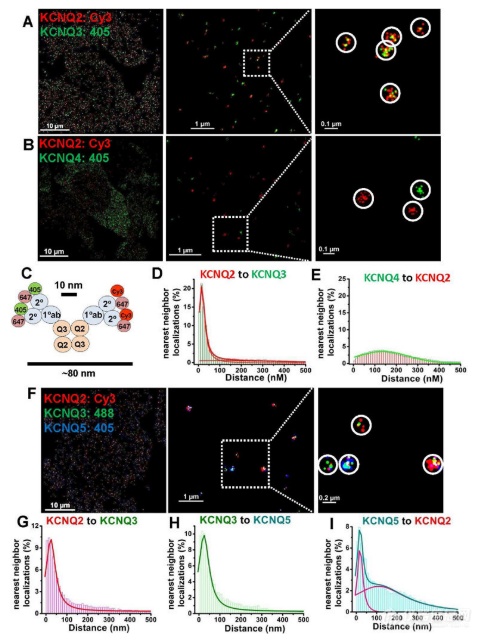
图1 STORM 区分那些密切相关或不密切相关的蛋白质
CHO 细胞用低密度的 KCNQ2+KCNQ3 (A)、KCNQ2+KCNQ4 (B)或 KCNQ2+KCNQ3+ KCNQ5 (F)共转染,并用一抗标记,然后用与 Alexa405/Alexa647、Cy3/ 偶联的二抗标记Alexa647 或 Alexa 488/Alexa647 染料对,如图所示。(A) KCNQ2/3 异聚体被可视化为两种不同颜色的定位簇,或(B) KCNQ2 和 KCNQ4 同聚体在双标签 STORM 下被可视化为相同颜色的独立定位簇。(C)共定位方案预测在 STORM 下使用一抗和二抗标记 KCNQ2/3 异聚体的细胞的近似簇大小。(D–E)用 KCNQ2+KCNQ3 (D) 或KCNQ2+KCNQ4 (E)共转染的细胞的最近邻距离。(F)显示的是在三重标签 STORM 下用 KCNQ2+KCNQ3+KCNQ5 共转染的细胞图像,显示代表几种类型的异聚通道的定位簇。(G–I)对于F中的单元格,显示的是KCNQ2-KCNQ3 定位(G)、KCNQ3-KCNQ5 定位(H)或 KCNQ5-KCNQ2 定位(I)的最近邻距离直方图。(n = 5、4 和 5 个细胞,分别用于 D、E 和 G–I 中的分析)。其他最近邻柱状图可以在图S2中找到. 有关拟合曲线的详细信息在表S1中进行了描述,其聚类分析在图 S3中进行了描述。
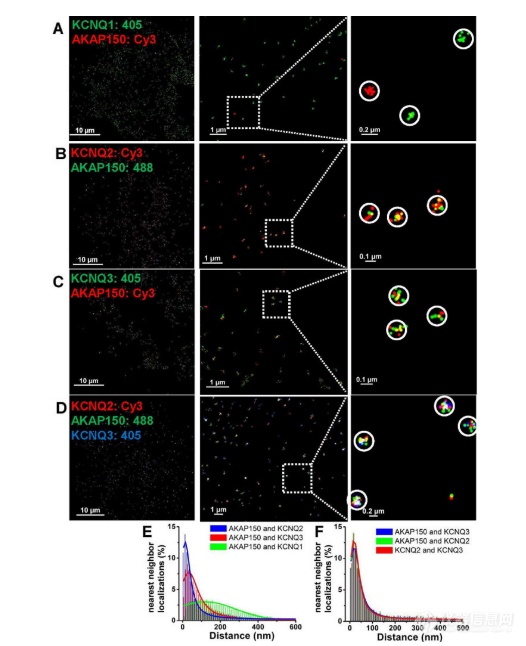
图2 STORM 观察到的
单个 KCNQ 通道/AKAP150蛋白复合物
使用转染AKAP150 和 KCNQ1 ( A )、KCNQ2 ( B )、KCNQ3 ( C ) 或 KCNQ2+KCNQ3 ( D )的 CHO 细胞的双重或三重标记成像的 STORM 图像。可见定位簇代表 AKAP150 与 KCNQ2 或KCNQ3 同聚体,或 KCNQ2/3 异聚体,但不是KCNQ1 同聚体。在A中,单个 KCNQ1 或 AKAP150 分子被视为孤立的相似颜色定位簇。( E, F ) 绘制的是 ( E ) 中 A–C 中双标签实验或D ( F )中三标签实验的最近邻距离直方图。对于 A–D 中的实验,n = 5、4、4 和 8 个细胞。
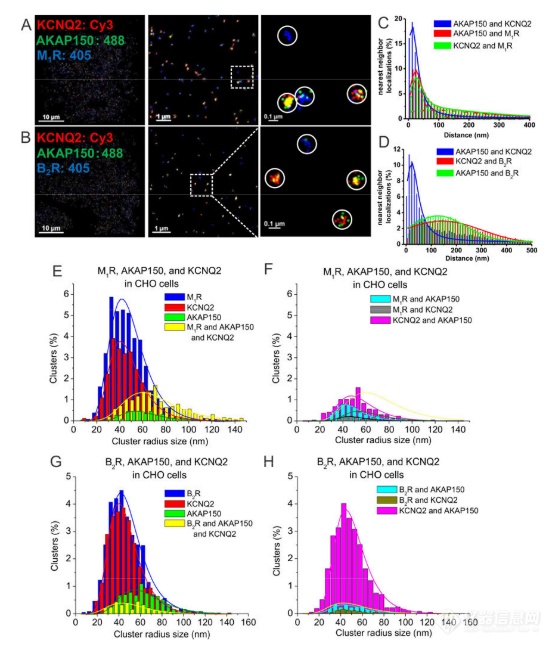
(A–B)用 KCNQ2、AKAP150和(A) M 1或(B) B 2受体共转染和三重标记的 CHO 细胞的 STORM 图像。图像显示 KCNQ2 与 AKAP150 和 M 1受体密切相关,但与 B 2受体无关。(C)绘制的是 AKAP150-KCNQ2、AKAP150-M 1 R 和 KCNQ2-M 1 R 的最近邻距离。n= 4 个单元格。(D)绘制的是 AKAP150-KCNQ2、AKAP150-M 1 R 和 AKAP150-B 2 R 的最近邻距离。n= 8 个单元格。(E–F)绘制的是M 的簇半径分析的直方图1 R、AKAP150 和 KCNQ2 标记的图像定位,例如A、C中的图像。在F中看到 ,M 1 R-AKAP150 集群和 M 1 R-KCNQ2 集群被解释为处于“本底噪声”之下。(G–H)绘制的是 B 2 R、AKAP150 和 KCNQ2 标记的定位的簇半径分析的直方图。在H中看到,代表 KCNQ2-AKAP150、B 2 R/AKAP150 和 B 2 R/KCNQ2 复合体的簇,后两者被解释为低于本底噪声。
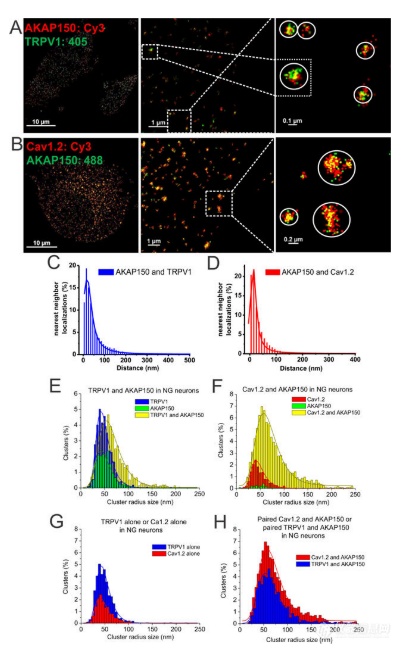
(A–B)来自 WT 小鼠的 NG感觉神经元的 STORM 图像,双重标记为 AKAP150 和 TRPV1 (A)或 Ca V 1.2 通道(B)。STORM 图像显示AKAP150 与 TRPV1 (A)或 Ca V 1.2 通道(B)的聚类。注意许多 AKAP150-Ca V 1.2 通道簇的尺寸较大,表明多通道“超级复合体”。(C–D)绘制的是 KCNQ2-TRPV1 (C)和 AKAP150-Ca V 1.2 (D)的最近邻距离直方图。(五)绘制的是A中数据的 AKAP150 和 TRPV1 定位的簇半径大小的直方图。(F)绘制的是B中数据的 AKAP150和 Cav1.2 定位的簇半径直方图。(G)集群分布的交叉比较代表 TRPV1-单独或 Ca V 1.2-单独的未配对集群,没有共定位的 AKAP150。TRPV1 单独的簇占总簇的百分比明显高于 Ca V 1.2 单独的簇 (p<0.05)。(H)表示成对 TRPV1/AKAP150 或 Cav1.2/AKAP150 共定位的簇分布的交叉比较。TRPV1 和 Ca 之间的平均簇半径没有显着差异包含V 1.2 的簇。然而,Ca V 1.2+AKAP150 簇的数量 (14.01 ± 0.77%) 代表极端尾部(平均大小的 > 2 个标准差)显着大于 TRPV1/AKAP150 簇 (6.29 ± 0.32%, p < 0.01) . n = 5 和 8 个单元格。
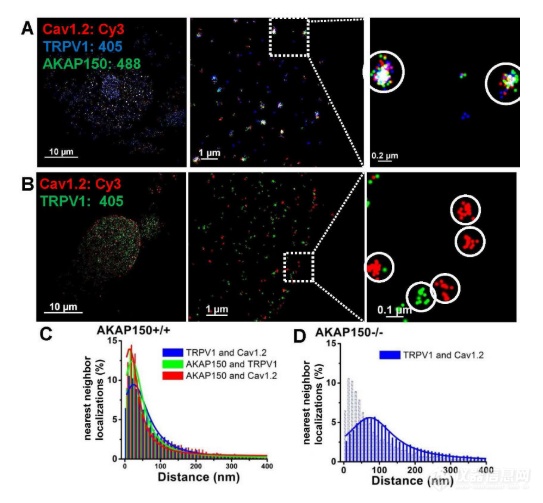
(A)显示的是三色 STORM 图像,显示 AKAP150 介导的多通道复合物,其中包含来自从 WT 小鼠分离的 NG 感觉神经元的 Ca V 1.2 和 TRPV1 通道。(B)显示的是双色STORM 图像,显示包含 Ca V 1.2 的离散通道复合物,或来自从 AKAP150 KO 小鼠分离的 NG 神经元的 TRPV1 通道。(C–D)绘制的是来自 WT 神经元(C)的AKAP150/TRPV1、Ca V 1.2/TRPV1 和AKAP150/Ca V 1.2 或来自 AKAP150 KO 神经元(D)的Ca V 1.2 和 TRPV1的 STORM 最近邻距离分布, 表明Ca V的密切关联1.2 和 TRPV1 通道和 AKAP150,在来自 WT 的细胞中,但不是 AKAP150 小鼠。n=4 和 5 个细胞。
iSTORM预约试拍
目前在国内,随机光学重建显微镜STORM已成功实现商用,有需要STORM成像技术进行实验研究的专家老师们,请文末填写问卷,即可预约获得 iSTORM 超高分辨率显微成像系统试拍服务~
力显智能现已发布的超高分辨率显微成像系统 iSTORM,成功实现了光学显微镜对衍射极限的突破,使得在20纳米的分辨率尺度上从事生物大分子的单分子定位与计数、亚细胞及大分子复合物结构解析、生物大分子生物动力学等的研究成为现实,从而给生命科学、医学等领域带来重大突破。
双12特惠👉iSTORM免费试拍:每个课题组都有1次免费试拍机会,需要用户提供样本和一抗,需提前沟通。
超高分辨率显微成像系统iSTORM具有20nm超高分辨率、3D成像、多通道同时成像光路设计、实时重构、2小时新手掌握等特点,已实现活细胞单分子定位与计数,并提供荧光染料选择、样本制备、成像服务与实验方案整体解决方案,以纳米级观测精度、高稳定性、广泛环境适用、快速成像、简易操作等优异特性,获得了超过50家科研小组和100多位科研人员的高度认可。
参考文献
References
[1]Brandao KE, Dell’Acqua ML, Levinson SR. A-kinase anchoring protein 150 expression in a specificsubset of TRPV1- and CaV 1.2-positive nociceptive rat dorsal root ganglion neurons. J CompNeurol. 2012; 520:81–99.
[2]Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor: aheat activated ion channel in the pain pathway. Nature. 1997; 389:816–824.
[3]ChaudhuryS,BalM,BeluginS,ShapiroMS,JeskeNA.AKAP150-mediatedTRPV1sensitizationisdisruptedbycalcium/calmodulin.MolPain.2011.
[4]Cheng EP, Yuan C, Navedo MF, Dixon RE, Nieves-Cintron M, Scott JD, Santana LF. Restoration ofnormal L-type Ca2+ channel function during Timothy syndrome by ablation of an anchoringprotein. Circ Res. 2011; 109:255–261.
[5]Dani A, Huang B, Bergan J, Dulac C, Zhuang X. Superresolution imaging of chemical synapses in thebrain. Neuron. 2010; 68:843–856.
[6]Davare MA, Dong F, Rubin CS, Hell JW. The A-kinase anchor protein MAP2B and cAMP-dependentprotein kinase are associated with class C L-type calcium channels in neurons. J Biol Chem. 1999;274:30280–30287.
[7]Davare MA, Horne MC, Hell JW. Protein phosphatase 2A is associated with class C L-type calciumchannels (Cav1.2) and antagonizes channel phosphorylation by cAMP-dependent protein kinase. JBiol Chem. 2000; 275:39710–39717.
[8]Delmas P, Brown DA. Pathways modulating neural KCNQ/M (Kv7) potassium channels. Nat RevNeurosci. 2005; 6:850–862.
[9]Dempsey GT, Vaughan JC, Chen KH, Bates M, Zhuang X. Evaluation of fluorophores for optimalperformance in localization-based super-resolution imaging. Nat Methods. 2011; 8:1027–1036.
[10]Dittmer PJ, Dell’Acqua ML, Sather WA. Ca2+/calcineurin-dependent inactivation of neuronal L-typeCa2+ channels requires priming by AKAP-anchored protein kinase A. Cell Rep. 2014; 7:1410–1416.
[11]DixonRE,MorenoCM,YuanC,OpitzArayaX,BinderMD,NavedoMF,SantanaLF.GradedCa2+/calmodulin-dependentcouplingofvoltage-gatedCaV1.2channels.Elife.2015.
[12]DixonRE,YuanC,ChengEP,NavedoMF,SantanaLF.Ca2+signalingamplificationbyoligomerizationofL-typeCav1.2channels.ProcNatlAcadSciUSA.2012;109:1749–1754.
[13]Ester M, Kriegel HP, Sander J, Xu X. A density-based algorithm for discovering clusters in largespatial databases with noise. KDD-96 Proceedings. 1996.
新品清华发布!国产超分辨iSTORM之路,虽千万人吾往矣~
国产超分辨iSTORM新品!力显智能于清华发布新品活细胞超高分辨率显微成像系统!
端午钜惠|1000元细胞优惠券限时大放送!
解放双手篇|都2023年了,你还在用手动计数?
相关产品

关注

拨打电话

留言咨询