外泌体是由细胞分泌的富含蛋白质的小膜囊泡。考虑到外泌体在不同生理活动中的重要作用以及在诊断药物递送方面的潜在价值,研究者们在体外追踪和内容物分析方面投入了大量的精力。近年来,各种超分辨率显微镜的出现为外来体的研究提供了强有力的工具。在这里,研究者展示了基于单分子定位的超分辨率成像技术(PALM/STORM)在癌症来源的外泌体的成像和跟踪中的应用。在实验中,首先,从肿瘤细胞的培养基中提取癌症来源的外泌体。然后,外泌体膜受体用光可切换探针标记,其允许通过光激活定位显微镜(PALM)或随机光学重建显微镜(STORM)对这些膜受体进行超分辨率成像。通过使用人乳腺癌细胞来源的外泌体,研究者展示了外泌体膜上的两种膜受体的同时双色PALM/STORM成像。此外,外泌体的成功标记和成像使得可以观察癌症来源的外泌体与正常细胞之间的相互作用。同时,研究者利用PALM/STORM成像实现了癌源性外泌体和溶酶体在受体细胞中的共定位。由于外泌体在细胞间通讯中起着至关重要的作用,研究者预计所提出的基于PALM/STORM的外泌体成像和跟踪在研究外泌体介导的癌症转移机制中具有巨大的潜力。
#01
外泌体是直径为30-100 nm的小细胞外囊泡(EV)。外泌体由多种培养的细胞在多泡体(MVB)与细胞膜融合时分泌。由于它们的来源,外泌体富含蛋白质的子集,包括四跨膜蛋白家族的成员(CD 9、CD 63和CD 81)、内体运输蛋白的成员(ESCRT相关蛋白/阿利克斯)和热休克蛋白Hsp 60、Hsp 70和Hsp 702。这些小囊泡代表了细胞间通讯和物质交换(例如胞质蛋白质、脂质和核酸的递送)的重要方式,而没有直接的细胞间接触,并且对于一些实际临床应用(例如诊断和药物递送)是潜在的。几个世纪以来,光学显微镜极大地促进了我们对分子和细胞生物学的理解以及对外泌体的研究。与其他成像技术相比,荧光显微镜的突出优势是其与样品的兼容性,这确保了非侵入性成像和高生化特异性。
然而,对于常规光学显微镜来说,几百纳米的中等分辨率限制了外来体的准确定位和成像,因为它们的尺寸相对较小(〈100 nm)。近年来,一系列新颖的光学超分辨成像技术克服了光学衍射极限。具体地,通过单分子定位显微镜已经实现了20 nm至50 nm的横向成像分辨率,这有利于可视化超小细胞结构。典型的光学超分辨成像技术包括近场扫描光学显微镜(NSOM)、受激发射损耗(STED)显微镜 、光激活定位显微镜(PALM)、随机光学重建显微镜(STORM)等,其中PALM和STORM共享类似的工作原理。首先,进行具有光可切换性质的单个荧光团的顺序成像和定位。然后,可以从这些激活的荧光团的位置重建具有亚衍射极限分辨率的图像。到目前为止,许多具有不同光开关原理的荧光团已被用于基于单分子定位的超分辨率显微镜,包括有机染料,荧光蛋白,和量子点。如今超分辨率显微镜已被用于亚细胞结构的定性或定量分析。随着多色、3D和活细胞成像的进步,这项技术在构建纳米尺度的细胞结构图和提供以前未解决的生物结构和过程细节方面具有巨大潜力。在不同的超分辨率成像技术中,PALM/STORM可以提供最高的分辨率(20-50 nm),这很好地适合外泌体的大小。在此,研究者展示了PALM/STORM技术在癌症来源的外泌体的成像和追踪中的应用。第一次,外泌体描绘和跟踪细胞内的超分辨率显微镜。
2.1.外泌体的分离和TEM分析
在实验中,使用两种癌细胞系,即人乳腺癌细胞(SKBR 3细胞)和人宫颈癌细胞(HeLa细胞)。由于其小尺寸,外泌体纯化曾经是具有挑战性的。到目前为止,已经开发了用于从细胞培养上清液、尿液或其他生物流体纯化外来体的可靠且方便的方法,包括超速离心、超滤、在抗体偶联的磁珠上捕获、和基于聚合物的沉淀。对于特定的应用,具有不同隔离结果的每种方法都有其优点和缺点。外泌体的纯化基本上通过基于聚合物的沉淀完成。考虑到它们的小尺寸(30至IOOnm),外泌体可以用电子显微镜表征,并且提取的外泌体在图1中可视化。TEM结果证实,从细胞培养基中成功提取了外泌体。
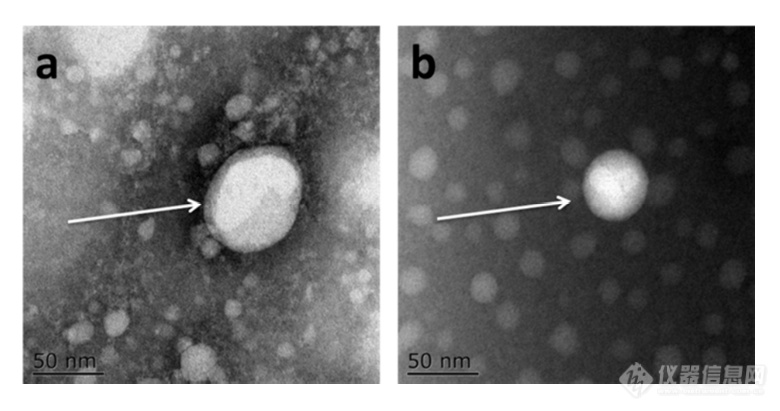 图1 从HeLa细胞(a)和SKBR3细胞(b)分离的外来体的透射电子显微镜(TEM)图像
图1 从HeLa细胞(a)和SKBR3细胞(b)分离的外来体的透射电子显微镜(TEM)图像
2.2基于PALM/STORM的癌症来源的外来体的超分辨率成像
2.2.1.HeLa外泌体中CD63的超分辨率成像
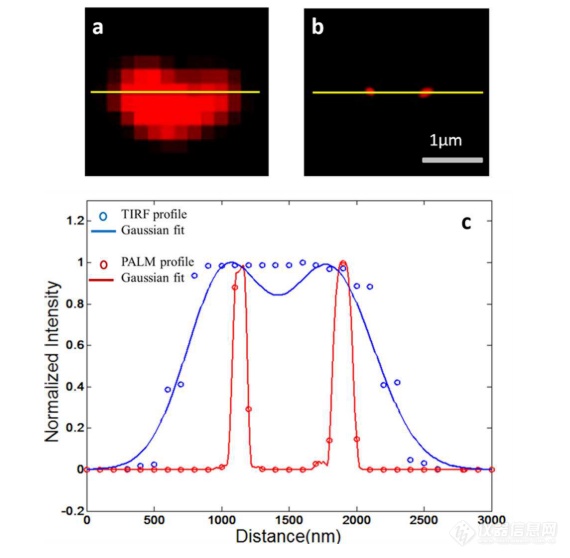
单个HeLa衍生的外来体的成像结果示于图2中。在膜染料CM-Dil的帮助下,研究者可以鉴定外泌体的存在。图2b示出了通过用561 nm激光激发CM-Dil的外来体的TIRF图像。在定位外泌体后,进行这些外泌体的PALM/STORM成像,结果示于图2c中。图2c的左下图是从15000帧重建的CD 63的PALM/STORM图像。而图2c的右上图是如图2b所示的相同区域的宽场TIRF图像。显然,与TIRF图像相比,PALM/STORM图像提供了高得多的空间分辨率。从免疫荧光样品中获得了特异性的进一步证据。通过用PBS替换兔抗CD 63抗体并保持其他程序和反应条件不变来制备对照样品。对照样品的结果示于图2d和2 e中。CM-Dil通道证实了外来体的定位,然而,观察到Alexa Fluor 647的荧光可忽略不计(图2 e)。这充分证明了在没有一抗的情况下,Alexa Fluor 647标记的二抗不能与外来体膜蛋白反应。结果,在图2c中观察到的Alexa Fluor 647的荧光真正来源于CD 63,并且IF反应显示出良好的特异性。
根据图2g和2 h中所示的PALM/STORM成像的外来体的横截面图,外泌体的最终重建超分辨率图像达到70 nm的半峰全宽(FWHM),这与外泌体的直径(30-100 nm)很好地对应。相反,CD 63的TIRF图像远大于单个外来体的大小(图2f和2 h)。这证明与常规宽场TIRF相比,PALM可以提供更可靠的外泌体结构信息。
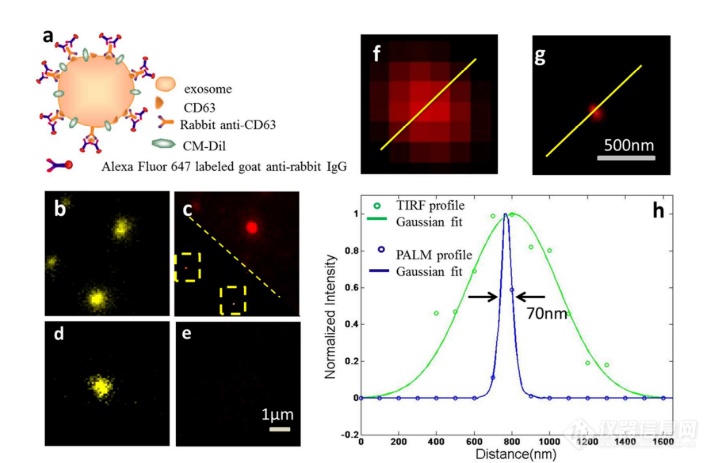 图2 HeLa外来体的TIRF和PALM/STORM成像
图2 HeLa外来体的TIRF和PALM/STORM成像
(a)用CM-Dil染色的CD 63和外来体膜的间接IF标记的示意图。(b)用CM-Dil染色的HeLa衍生的外来体的TIRF图像。(c)用Alexa Fluor 647标记CD 63,常规衍射限制图像(右上)和PALM/STORM图像(左下)。(d)不含特异性检测用一抗的免疫荧光对照样品,CM-Dil通道。(e)不含特异性检测用一抗的免疫荧光对照样品,Alexa Fluor 647通道。(f)单个外泌体上CD 63的宽场TIRF图像。(g)(f)中相同区域的PALM图像。(h)f和g中示出了外泌体的横截面轮廓。
传统显微镜的分辨率约为几百纳米,大约是亚细胞区室的大小,因此不足以确定许多细胞内细胞器的纳米级位置和数量。外泌体的PALM/STORM成像的优越性可以通过对两个相邻的外泌体进行成像来更好地证明。如图3所示,呈现了两个紧密堆积的外来体上的CD 63的TIRF和PALM/STORM图像。根据两个外泌体的截面轮廓,由于衍射极限,常规TIRF显微镜无法识别这两个紧密堆积的外泌体。而PALM/STORM图像清楚地显示了两个外泌体的存在定位。因此,由于能够分辨超出细胞器水平的亚细胞结构,PALM/STORM已经满足了外来体的纳米级定位精度,即使它们彼此相邻。
图3两个相邻外来体的成像(a)常规TIRF图像;(B)PALM/STORM图像
2.2.2.SKBR 3外泌体中CD 63和HER 2/C-erbB-2的双色超分辨成像
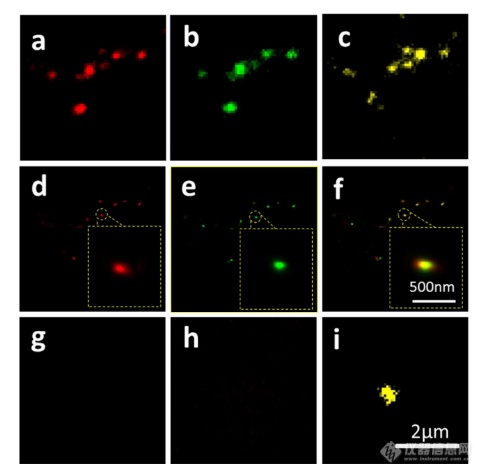
荧光显微镜的一个明显优势是通过用光谱上不同的荧光团标记两种或更多种成分同时成像的优异性能。在癌症疾病的研究中,同时监测不同的受体/生物标志物可以提供关于患者的生理状态的更可靠的信息。例如,乳腺癌的诊断需要同时分析各种受体/生物标志物,例如人表皮生长因子受体-2(HER 2)、表皮生长因子受体(EGFR)、雌激素受体(ER)和孕酮受体(PR)。由于外泌体在肿瘤转移中起重要作用,因此外泌体上不同受体的同时成像可以为研究外泌体介导的癌症转移提供信息。因此,证明了外泌体上两种受体的同时双色PALM/STORM成像。为了实现双色PALM/STORM成像19,除Alexa Fluor 647外,还使用了Alexa Fluor 488。先前的研究表明,Alexa Fluor 488也适用于PALM/STORM成像。此外,它的荧光信号可以很好地与Alexa Fluor 647区分开来,这可以大大防止双色成像中的串扰。来源于SKBR 3细胞的外泌体在此用作模型外泌体,并且待成像的靶受体是CD 63和HER 2(人表皮生长因子受体-2)。由C-erbB-2/HER 2阳性肿瘤细胞系SKBR 3释放的外来体表现出HER 2/C-erbB-2过表达。此处,如材料和方法部分中所述,CD 63用Alexa Fluor 647 IF标记,HER 2用Alexa Fluor 488 IF标记。为了构成有效标记的额外证据,我们使用共聚焦显微镜的波长扫描功能来描绘Alexa Fluor 488、Alexa Fluor 647和CM-Dil标记的外来体的荧光发射强度。与理论分析一致,两种染料的荧光信号可以很好地区分,这防止了多色成像中的串扰。外泌体膜用CM-Dil染色。此处还添加空白对照以证明IF的特异性。
双色PALM/STORM成像结果见图4。红色通道是CD 63,绿色通道是HER 2,黄色通道是外来体膜。可以看出,Alexa Fluor 488和Alexa Fluor 647的荧光信号都可以在SKBR 3外来体上检测到(图4a、d和b、e)。虽然在空白对照中没有检测到对应于这些荧光团的荧光(图4g和h),但证实IF标记具有优异的特异性并且双色标记是成功的。与图4d和4 e中所示的PALM/STORM图像相比,图4a和4 b中所示的宽场TIRF图像表现出不令人满意的分辨率。图4f中所示的合并的双色PALM/STORM图像表明CD 63和HER 2都在SKBR 3外来体上表达。上述实验结果表明,使用PALM/SORM和IF技术可以实现外泌体上不同蛋白质的同时双色超分辨率成像。
图4 SKBR 3衍生的外来体中CD 63和HER 2的双色超分辨率成像
用Alexa Fluor 647对CD 63进行荧光标记,常规衍射受限图像(a)和PALM/STORM图像(d)。用Alexa Fluor 488对HER 2进行荧光标记,常规衍射受限图像(b)和PALM/STORM图像(e)。(c)用CM-Dil染色的SKBR 3衍生的外泌体膜。(f)两个超分辨率通道的合并图像。(g-i)空白对照样品,Alexa Fluor 647通道(g)、Alexa Fluor 488通道(h)和CM-Dil通道(i)的荧光图像。
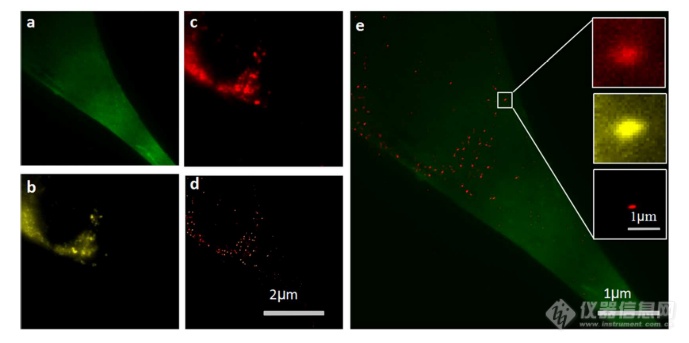
通过超分辨率成像细胞内追踪癌症来源的外来体最近的研究表明外来体在不同的生理和病理过程中起重要作用,例如免疫应答的调节、肿瘤转移和炎症。由于外泌体的功能取决于它们与受体细胞相互作用的能力,因此研究已经非常重视外泌体摄取的机制。在遇到它们的目的地时,外泌体可以与受体细胞的膜融合,然后将内容物直接释放到细胞质中或通过内吞途径有效地内化。最近的报告表明,肿瘤细胞可以释放液(富含蛋白质和rna)的一个子集为pre-metastatic利基preparation瀑特异性细胞。调查的细胞间tumor-derived液囊和正常细胞之间的通信是一个液的主要工作理解角色在威胁生命的癌症转移。所以我们用人类胚胎肺成纤维细胞(MRC-5)作为模型正常细胞观察的细胞吸收SKBR3液由正常细胞,可以更好的展示超分辨率成像技术的潜在应用液相关的生物过程的研究。在实验中,CD63 SKBR3液如果贴上Alexa萤石647,和外来体膜沾CM-Dil在材料和方法部分描述。然后他们被MRC-5培养细胞。MRC-5细胞的膜与PKH67染色。孵化后1小时,对这些MRC-5细胞进行TIRF和PALM/STORM成像。在图5中,研究者意识到内化的colocalization SKBR3液和MRC-5细胞。如图5 c和d,获得了更高的空间分辨率成像,通过手掌/风暴更准确地观察和细胞内液的分布与传统相比TIRF形象。图5 e显示了合并TIRF MRC-5单元的图像和棕榈/风暴的形象内化SKBR3液,这清楚地表明,这些SKBR3液已经被MRC-5细胞。此外,如扩大区域如图5所示,执行的外来体膜受体超分辨率成像比传统TIRF图像。所以研究者相信,棕榈液胞内可以提供更可靠的位置信息可视化。
图5 SKBR 3外泌体的细胞内追踪
(a)PKH 67染色的MRC-5细胞的TIRF图像(绿色)。(b)CM-Dil染色的SKBR 3外来体的TIRF图像(黄色)。(c)内化的SKBR 3外来体的常规TIRF图像。(d)如(c)中所示的相同区域的PALM/STORM图像。(e)MRC-5细胞(绿色)和内化的SKBR 3外来体(红色)的共定位。以及外泌体膜受体的放大的TIRF图像(右上)、CM-Dil染色的外泌体(中右)和单个外泌体的PALM/STORM图像(右下)。
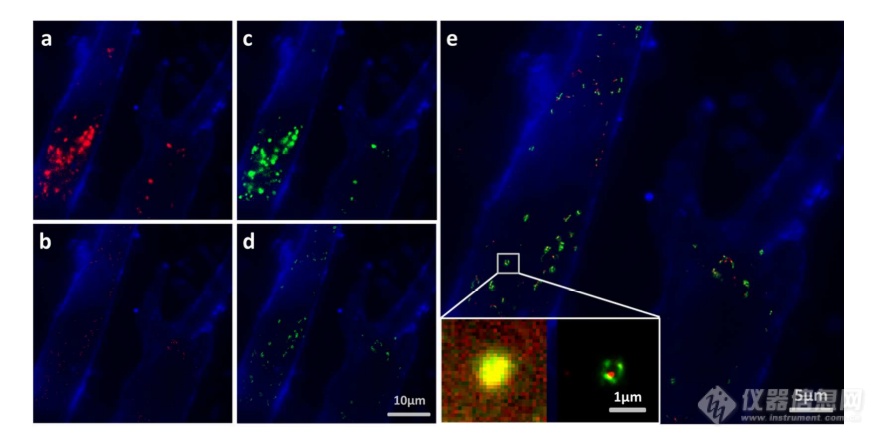
先前的研究表明细胞摄取外来体依赖于内吞作用和吞噬作用,一旦内吞,大量外来体随后被转运到溶酶体中进行降解。然而,常规荧光显微镜的中等分辨率阻碍了对外来体的溶酶体运输的直接监测。在这里,使用PALM/STORM成像,研究者进一步实现了MRC-5细胞的内化SKBR 3外泌体和溶酶体的共定位。类似地,用Alexa Fluor 647 IF标记SKBR 3外来体,并用LysoTracker Red标记MRC-5的溶酶体。MRC-5的膜用PKH 67染色。由于两个原因,选择LysoTracker Red作为溶酶体染料。首先,它对溶酶体的酸性膜具有高度选择性。其次,它可以通过561 nm照明成像和关闭,并通过405 nm光重新激活,这使得它适合于PLAM/STORM成像。实验结果如图6所示。观察到外泌体和溶酶体的良好共定位,这意味着大部分外泌体定位在溶酶体内。此外,如图6 e中放大的双色PALM/STORM图像所示,在溶酶体内部清楚地看到外来体.所获得的超分辨率图像为以下结论提供了更有力的证据:在与受体细胞结合后,外泌体将被转运到溶酶体中以进一步降解。
图6 SKBR 3外来体和MRC-5溶酶体的共定位
(a)内化的SKBR 3外泌体(红色)和MRC-5膜(蓝色)的TIRF图像。(b)如(a)中所示的相同区域的PALM/STORM图像。(c)MRC-5溶酶体(绿色)和MRC-5膜(蓝色)的TIRF图像。(d)如(c)中所示的相同区域的PALM/STORM图像。(e)MRC-5溶酶体(绿色)和内化的SKBR 3外来体(红色)的共定位。
上述实验结果证实,即使在被其他细胞摄取后,标记的外泌体的PALM/STORM成像仍然可以实现,并且内化的外泌体的分布可以通过所提出的基于PALM的方法直接可视化,这表明PALM/STORM技术在研究外泌体及其内容物(即miRNA、DNA、蛋白质等)的细胞内动力学中的潜在应用。
使用IF和PALM/STORM技术实现癌症来源的外来体的基于单分子定位的超分辨率成像。与传统的视场显微镜相比,PALM/STORM为观察外来体提供了更好的空间分辨率,其尺度可达纳米级。此外,还呈现了癌症来源的外泌体的同时双色PALM成像。通过与传统的宽视野显微镜相比,很明显,使用PALM/STORM成像技术,研究者可以更精确地可视化掺入的外泌体的细胞内位置。因此,PALM/STORM是一种新的强大的方法,用于细胞内跟踪外来体和其他纳米结构,具有优异的空间分辨率。此外,凭借这些优异的特性,我们有充分的理由相信,超分辨率成像将非常适用于后续的外泌体和外泌体相关生理过程的研究。
力显智能现已发布的超高分辨率显微成像系统 iSTORM,成功实现了光学显微镜对衍射极限的突破,使得在20纳米的分辨率尺度上从事生物大分子的单分子定位与计数、亚细胞及大分子复合物结构解析、生物大分子生物动力学等的研究成为现实,从而给生命科学、医学等领域带来重大突破。


 图1 从HeLa细胞(a)和SKBR3细胞(b)分离的外来体的透射电子显微镜(TEM)图像
图1 从HeLa细胞(a)和SKBR3细胞(b)分离的外来体的透射电子显微镜(TEM)图像 图2 HeLa外来体的TIRF和PALM/STORM成像
图2 HeLa外来体的TIRF和PALM/STORM成像