开谱首席冻干专家罗春博士,专注研究冻干工艺,现推出“罗博讲冻干”专栏,不定期连载,欢迎交流探讨。
今天是本专栏的第六篇。
1.前言
在之前的内容中【罗博讲冻干005:真空冷冻干燥过程介绍(四)】,我们为大家介绍了真空冷冻干燥过程的主要过程,相信大家对真空冷冻干燥过程有了一定的了解。但是仅仅了解这些过程对做好冻干过程是远远不够的。因为冻干过程的影响参数众多,包括但不限于物料装填高度、添加剂类型、浓度这些物料参数,还包括冷却速率、搁板温度、真空室压力这些冻干过程参数。
那么如何在这么多的参数组合中选取合适的参数进行冻干呢?传统冷冻干燥在开发过程中是一个尝试-失败-失败的不断重复(Trial and error)过程,即尝试不同的参数组合,虽然这种方法能够生产出在接受范围内的产品,但这种方法耗时耗能,很可能得不到高质量的产品或最佳的冷冻干燥工艺。为了解决这一问题,很有必要引入质量源于设计(Quality by Design, QbD)的概念了。
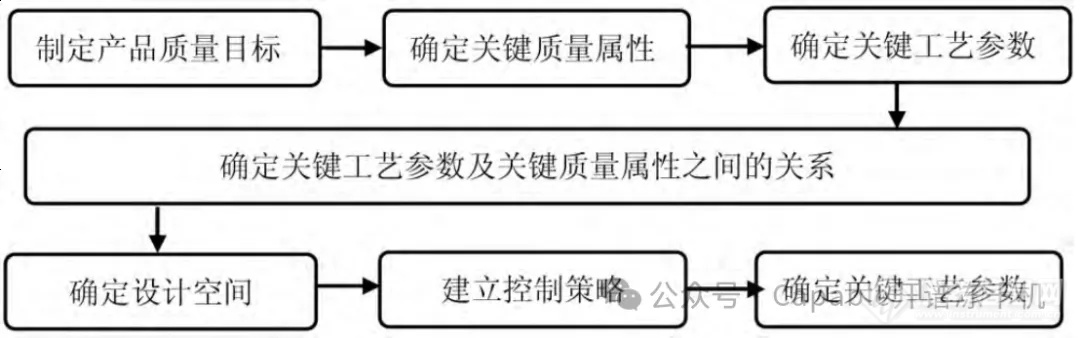
2 QbD的概念和作用
QbD的理念主要由美国食品药品监督管理局(Food and Drug Administraion, FDA)提出,在FDA和人用样品注册技术要求国际协调会(International Conference on Harmonization,ICH)的推动下,QbD逐渐成为了制药界的共识,由于冻干机的一大主要用途便是制备生物药品,冻干技术方面也逐渐引入了QbD的理念。
ICH Q9指出,质量不是通过检验注入到终产品中的,而是通过设计赋予的。换句话说,产品的质量并不是有最终的检验过程决定的,而是由产品的生产过程所决定的。因此QbD是从预先确定的目标出发,基于科学和质量风险管理,把研究重点放在对产品和生产工艺的理解和控制策略上。
而要获得良好的设计,必需增加对产品和生产的全过程控制。FDA认为,QbD是从产品开发到形成工业化的精心设计,是对产品属性及其与
关系透彻理解。同时QbD也是动态药品生产管理规范(Current Good Manufacture Practice,cGMP)的基本组成部分,有助于GMP更好的实施。
【专业赋能】开谱冻干开展销售工程师培训分享会
以用户体验为中心,开谱冻干机的那些人性化设计细节!
罗博讲冻干007:什么样的冷阱是一个“好的”冷阱?——冷阱常见问题解答
罗博讲冻干005:真空冷冻干燥过程介绍(四)

相关产品
实验室基础台式冻干机、冷冻干燥机
实验室基础台式冻干机 、冷冻干燥机
实验室基础立式冻干机 、冷冻干燥机
单仓硅油原位冻干机、冷冻干燥机
单仓硅油原位冻干机、冷冻干燥机
单仓硅油原位冻干机、冷冻干燥机
双仓硅油研发型冻干机 、冷冻干燥机、原位冻干机
双仓硅油研发型冻干机、冷冻干燥机、原位冻干机
不压盖型小圆腔 小型台式实验室型冻干机 开谱仪器 Capable
压盖型小圆腔 小型台式实验室型冻干机 开谱仪器 Capable
圆底冻干瓶 250ml 冻干机 真空冷冻干燥机专用 开谱仪器 Capable
广口瓶 300/500/1000ml 冻干机 规格可选 透明含适配器 开谱仪器 Capable
厚壁茄型瓶 1000ml 冻干机 真空冷冻干燥机专用 开谱仪器 Capable
真空泵 实验室型冻干机 标配油雾过滤器 耐腐蚀低噪音 开谱仪器 Capable
泵油 冻干机 真空泵 真空冷冻干燥机专用 开谱仪器 Capable

关注

拨打电话

留言咨询