微生理系统或器官芯片技术能够复制3D人体组织的关键结构和功能,比不易控制的3D细胞聚合模型具有更高的再现性,为成为替代动物模型的高级药物毒性和疗效测试平台提供了巨大潜力。
2023年5月4日,YongTae Kim教授及其团队在《Lab on a Chip》杂志上以题目“Manufactured tissue-to-tissue barrier chip for modeling the human blood–brain barrier and regulation of cellular trafficking”发表封面文章。文章介绍了一种用于模拟血脑屏障(BBB)的三维(3D)细胞模型的设计,该模型通过注射成型微流体芯片(MEPS-TBC)实现。文章主要包括芯片的设计,稳定的残余培养基层的形成,BBB外周单位的构建和BBB功能评估。
1 制造BBB形成的芯片设计
BBB由三层组成:内血管内皮细胞、包绕血管的周细胞和延伸到血管的星形胶质细胞。
以往的BBB模型使用PDMS软微影技术制备,但这种方法难以用于注射成型塑料芯片,因为其分辨率有限。
为了构建3D BBB模型,设计了一种MEPS-TBC芯片,由上部单元和下部单元组成。
上部单元有一个多孔膜上的微流体通道,而下部单元具有与上方多孔膜对齐的中央通道和两个额外的短侧通道,中央通道中的明胶固定通道可防止培养基泄漏。
使用该芯片,将人脑血管内皮细胞(hBVPs)悬浮液注入下部中央通道,然后将含有人脑星形胶质细胞(hAs)的Matrigel注入通道。在上下两侧通道中加入培养基,以形成3D BBB构型。
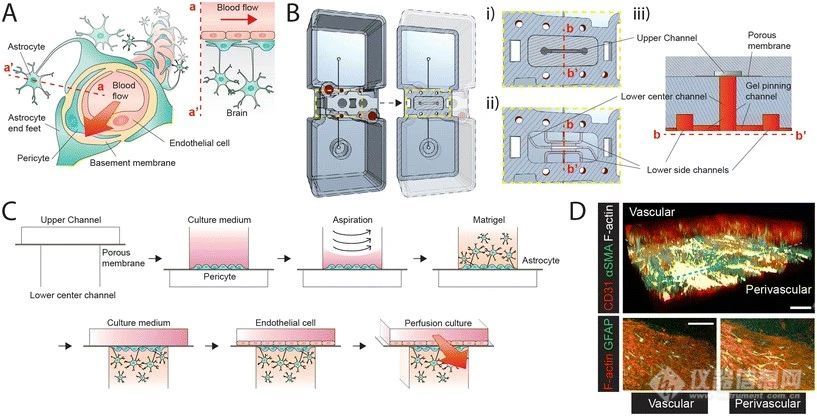
图1:在MEPS-TBC中构建人血脑屏障(BBB)模型
2 通过抽吸形成稳定的残余培养基层
为了在hBVPs附着后注射3D-hA载体Matrigel,开发了抽吸诱导的下部中央通道中薄层培养基的形成。
抽吸施加在下部侧通道上,设计了通道尺寸以去除细胞悬浮液而不影响hBVPs的完整性,从而形成薄层残余培养基。
使用计算流体动力学分析,确定了抽吸诱导液气界面的位置,并验证了在适当的条件下(100μm明胶固定通道高度)不会影响hBVPs附着。
确定了明胶固定通道高度和下部中央通道宽度,以控制残余培养基层的高度。
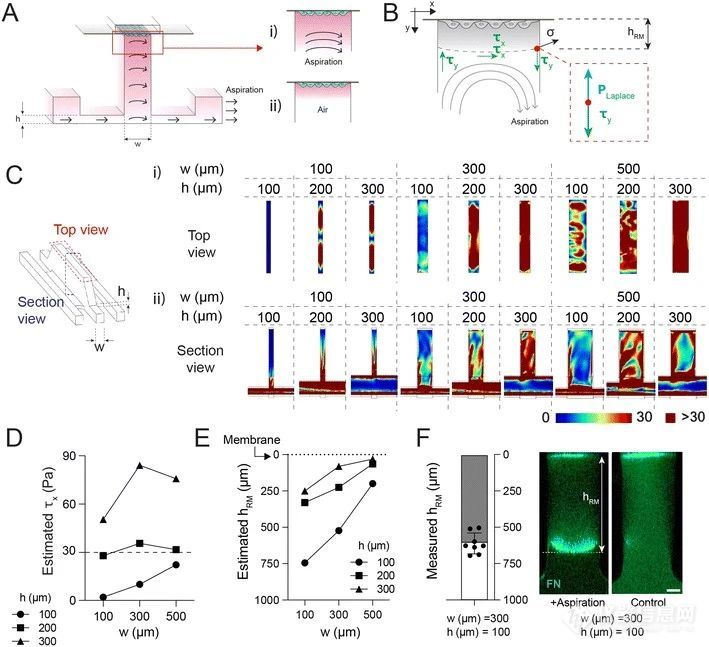
图2:通过抽吸形成残留介质层
3 抽吸介导的BBB外周单位构建
通计算流体动力学结果优化了通道结构,成功使用抽吸技术构建了MEPS-TBC中BBB的外周单位。
外周单位的构建过程包括将hBVPs播种到下部中央通道、附着后进行抽吸,然后注入含有hAs的Matrigel。
使用免疫荧光染色分析了每个阶段的细胞位置和覆盖情况,结果表明hBVPs可以成功附着,不受抽吸影响,而hAs可以成功形成3D构型。
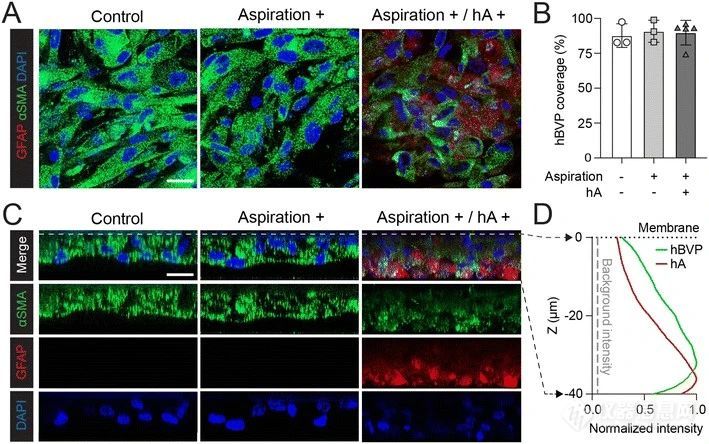
图3: 通过抽吸在MEPS-TBC中构建的血管周围单元。
4 BBB功能评估
构建了BBB模型,包括上部通道中的hBMEC层,显示了与实际BBB相关的蛋白表达。
在4 dynes cm^-2的剪切应力下培养hBMECs,其覆盖率在静态培养和低剪切应力下保持高稳定性。
在生理剪切应力下,BBB模型的TEER值在第2天较hBMEC模型高出两倍,表明BBB模型的屏障性能得到显著增强。
4 kDa和40 kDa FITC-葡萄糖聚合物的渗透性结果与TEER值一致,表明BBB模型对剪切应力更为敏感。
表达了更多的紧密连接蛋白和转运蛋白,表明BBB模型的屏障功能得到了提高。
研究发现,BBB模型可以调节炎症性细胞在模型中的粘附,从而保护大脑免受潜在的炎症性损伤。
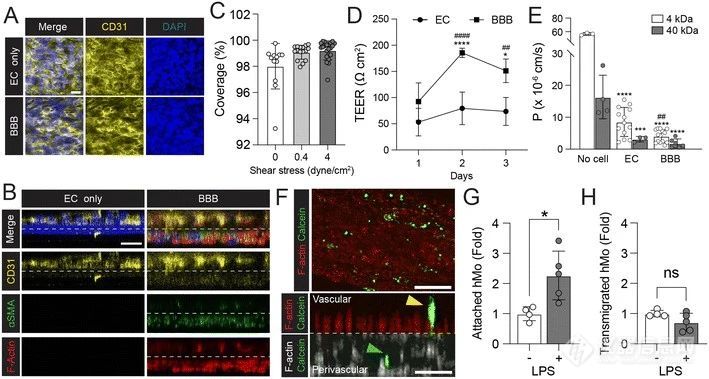
图4:在MEPS-TBC中构建的BBB模型的功能评估。
结论:本研究设计了一种MEPS-TBC芯片,成功构建了3D BBB模型,该模型具有良好的屏障性能,可用于研究BBB功能以及炎症性细胞的粘附和迁移。
论文索引:KIM, Jaehoon, et al. Manufactured tissue-to-tissue barrier chip for modeling the human blood–brain barrier and regulation of cellular trafficking. Lab on a Chip, 2023.
打破“反摩尔定律”,艾玮得生物器官芯片为药物研发提质增效
日程会场更新!2024微生理系统国际研讨会暨第七届类器官与器官芯片学术会议通知
预热9月 | 艾玮得生物市场活动日历大公开,精彩连连,邀您同行!
艾玮得生物血管芯片:用“芯”出发,探索血管奥秘
相关产品

关注

拨打电话

留言咨询