人体器官芯片免疫模型构建
COVID-19 大流行凸显了病原体和微生物对人类社会及健康的持续危害。为了研发新的抗感染治疗方法,我们需要更深入地了解人体免疫系统在感染过程中的先天和适应性免疫反应。已证实器官芯片(OOC)等人体离体模型是有价值的组织建模工具。为了提升OOC模型的仿真能力,使其能够模拟复杂的生物反应,必须引免疫组分。
伯尔尼大学的Olivier T. Guenat教授团队2023年6月1日在《Frontiers in Bioengineering and Biotechnology》(影响因子:5.7)杂志上发表了题为“Integration of immune cells in organs-on-chips: a tutorial”的综述,介绍了构建急性感染OOC模型的基本单元,以研究循环免疫细胞在感染组织中的招募情况。除芯片设计、化学引力梯度的创建以及内皮细胞、上皮细胞和免疫细胞的引入外,重点关注水凝胶细胞外基质(ECM),以准确模拟免疫细胞穿越向感染部位间质空间。

研究内容
· 体内免疫细胞级联外渗
免疫细胞与非免疫细胞(如上皮细胞和内皮细胞)之间进行复杂的相互作用,形成炎症级联。病原体激活组织内的免疫细胞,释放细胞因子激活局部血管内皮,增加其黏附分子和趋化因子的表达,吸引循环免疫细胞。免疫细胞穿越内皮层,穿过基底膜,朝着感染部位迁移。
在先天免疫和适应性免疫反应中,先天免疫反应是对感染的快速响应,而适应性免疫反应是特定病原体的响应,生成记忆细胞以解决将来的感染。本综述关注先天免疫反应,其中主要的先天免疫细胞(中性粒细胞和单核细胞)从血管系统被招募到感染部位。病原体检测通过病原体相关分子模式(PAMPs)和模式识别受体(PRRs)实现,激活内皮细胞和引导免疫细胞穿越。免疫细胞在组织间质迁移时通过ECM网络追踪趋化因子,与定居细胞互动,产生矩阵修饰酶,可能促进免疫细胞在组织中的迁移。
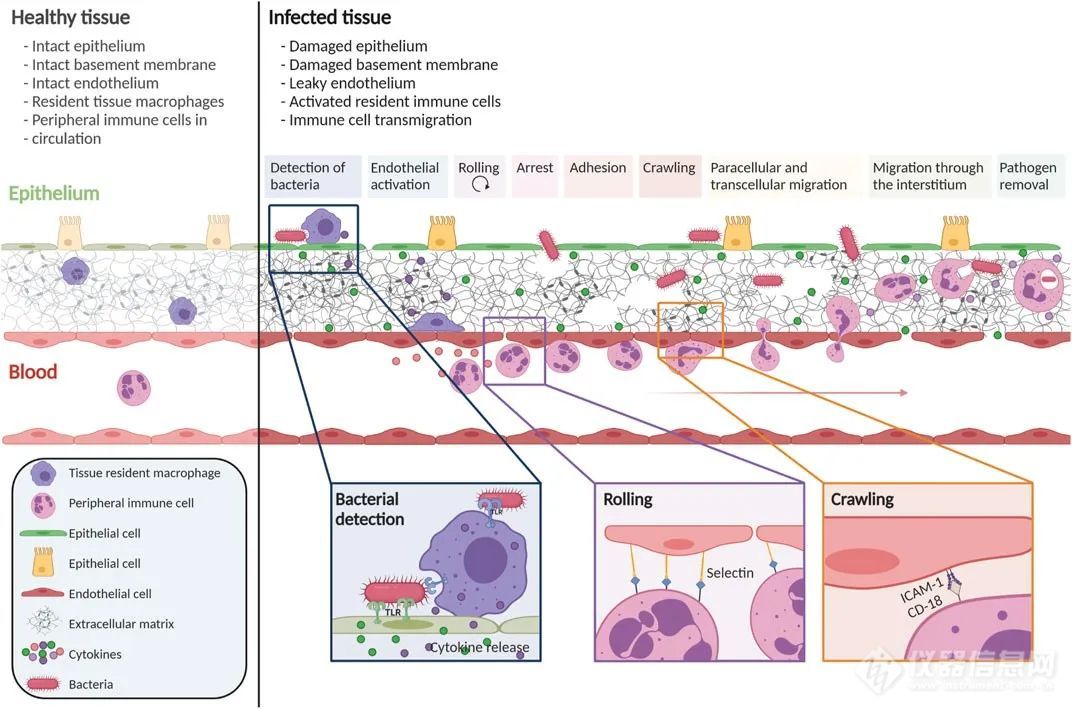
免疫细胞在感染后发生级联迁移
· 免疫细胞外渗的体外模型
体外免疫细胞越过血管壁的两种主要模型是静态模型和基础流动室模型,其中BECs被培养成一层,免疫细胞在静态或流动条件下引入以产生先天免疫反应,而适应性免疫细胞需要促炎刺激激活。免疫细胞越过过程通过显微镜观察和分析。静态模型包括双室迁移实验,BECs生长在过滤器插入物中,免疫细胞穿越内皮细胞,然后穿过插入物孔隙到达下隔间,但不涉及ECM环境。更复杂的胶原水凝胶经内皮迁移实验在胶原水凝胶上形成内皮细胞单层,使免疫细胞迁移到水凝胶中。在血液中,层流流动室实验研究流动条件下免疫细胞黏附和迁移,OOC模型提供更先进平台,支持多种细胞类型的共培养,模拟软的间质空间,包括生理流体流动和软水凝胶ECMs中的细胞培养。
· 芯片上器官的免疫细胞外渗
在接下来的章节中,将讨论感染的OOC模型的发展。模型的各个组成部分包括芯片设计、水凝胶ECM、微血管内皮、上皮、组织内和循环免疫细胞,以及通过化学梯度诱导炎症或模拟病原体感染。这些组成部分及其在实验室中建立的实际方面将在本综述的后续部分中详细阐述。用于模拟感染期间免疫细胞越过和迁移的微流控芯片应是多室的,以创建内皮-水凝胶-上皮屏障,并且可灌注,以对免疫细胞进行灌流并创建化学梯度。有几种商业化的微流控芯片可用,例如Mimetas、AimBiotech和BEOnChip。然而,如果需要特定设计,可以开发定制的微流控芯片。图3概述了可能的芯片设计。有关芯片制造的信息通常可以在其他地方找到。简而言之,通过3D打印或光固化创建模具,并填充聚二甲基硅氧烷(PDMS)混合固化剂。固化的PDMS经过后处理,并与另一个PDMS部分或玻璃幻灯片结合以关闭通道结构。芯片的设计基于上述要求:多室化,具有水凝胶ECM并且可灌注。一般而言,设计可以分为两组:在水凝胶结构内创建通道的芯片和具有水凝胶屏障分隔微流控通道的芯片。
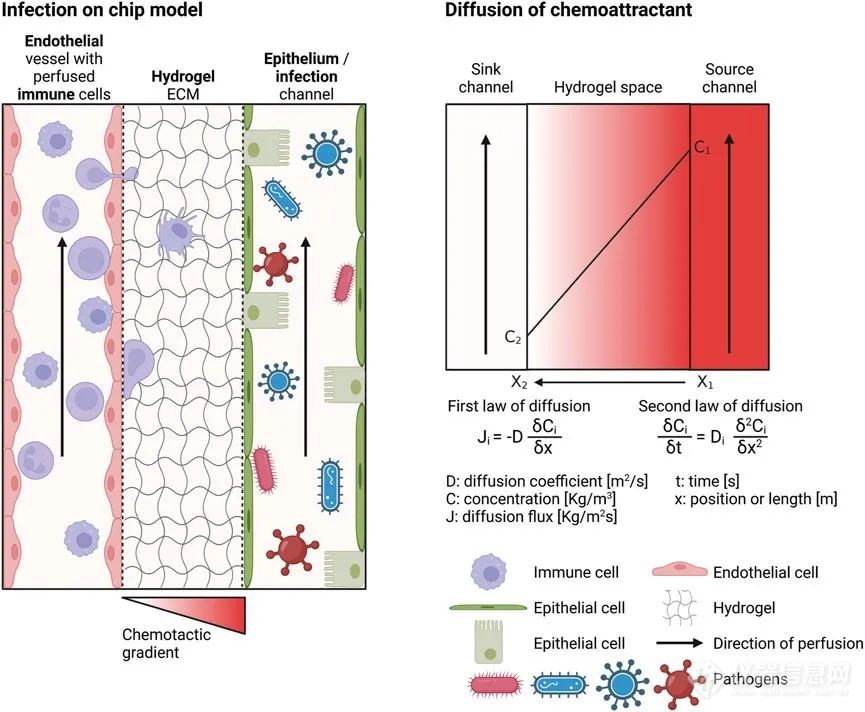
芯片感染模型的要求
· 在水凝胶芯片中形成血管
在基于水凝胶的芯片中,微流控通道是在水凝胶中创建的,PDMS等结构材料主要用于封装,便于处理。这种设计可用于评估细菌和哺乳动物细胞的趋化性,模拟微血管,并创建多个血管以研究免疫细胞迁移。通过表面张力限制水凝胶在一个通道内,用户可以创建内皮和上皮屏障,并观察免疫细胞在水凝胶中的迁移。此外,悬挂的水凝胶模型和激光切割可用于在芯片上模拟气道和形成特定结构。
· 带有水凝胶屏障隔室的微流控芯片
大多数设计尚未包括泵辅助的单向流,调整芯片连接泵后可用于研究免疫细胞越过内皮层。在芯片设计实验方面,通过表面张力可将水凝胶包含在微流控隔间中,需要计算接触角的变化。建议在移液管和水凝胶入口之间保持紧密连接,同时对PDMS进行表面改性,如预处理和ECM涂层,以提高细胞附着性,避免细胞脱落和水凝胶收缩。
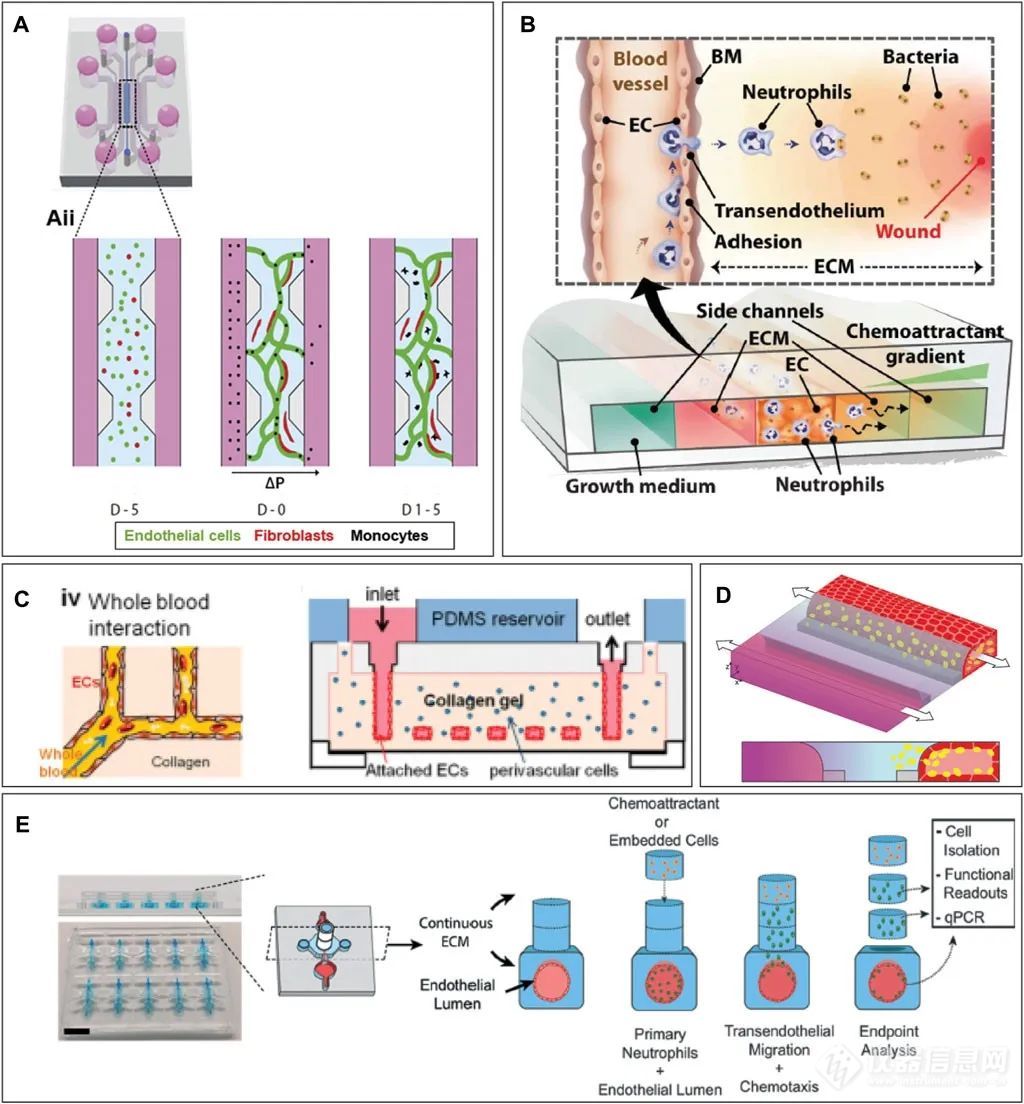
结合水凝胶的器官芯片设计的例子
· 水凝胶性质对免疫细胞迁移的影响
免疫细胞与水凝胶中的蛋白质等其他细胞一样发生相互作用。在2D水凝胶表面上,细胞受到较少的约束;另一方面,封装在3D水凝胶内的细胞受到更多约束,但有更多与基质粘附的点,可用于免疫细胞迁移,但这并非迁移所必需(Caliari和Burdick,2016)。图4概述了影响免疫细胞迁移的水凝胶属性。合成水凝胶主要由非天然聚合物制成,如聚丙烯酰胺(PA)或聚乙二醇(PEG);而天然衍生的水凝胶则使用胶原、纤维蛋白原或明胶等材料制成。合成水凝胶通常是生物惰性的,除非通过向其中添加特定肽段来激活与免疫细胞的相互作用。混合水凝胶通过混合不同的水凝胶,例如胶原和纤维蛋白原,创造了具有独特性质的混合物。水凝胶化学上的功能化,特定肽段的引入可以改善粘附并调整细胞行为。水凝胶的孔隙度影响机械结构、氧气和营养的扩散,可以通过调整水凝胶中胶原的浓度或整合可溶颗粒来修改。基质刚度是影响免疫细胞迁移的关键因素,水凝胶通常具有低刚度,可通过调整水凝胶分子的浓度或使用交联剂进行微调。在较硬的水凝胶上,中性粒细胞更扁平且更散开,总迁移较少,更具定向性;而在软水凝胶上,它们保持圆形,表现出随机行走的行为。
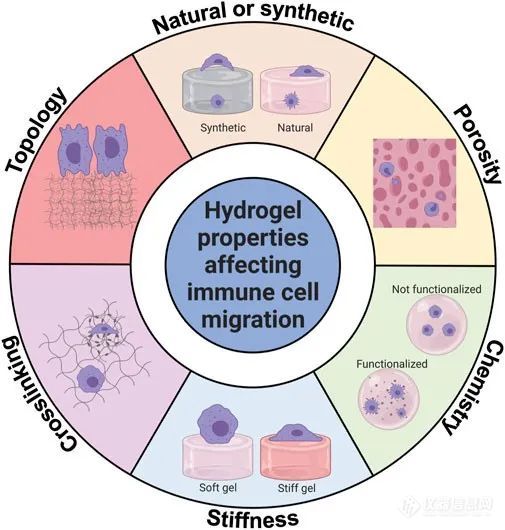
影响先天免疫细胞迁移的水凝胶特性
OOC模型产生的数据正在与动物研究和临床试验的数据进行比较,特别是在感染领域。未来发展方向包括模拟先天和适应性免疫应答,使用全血替代细胞培养基,添加组织内免疫细胞,整合淋巴系统,并通过在OOC中灌注全血来增加相关性。研究者们已进行初步测试,尤其关注中性粒细胞迁移到感染部位的潜在前景。总体而言,OOC模型作为更精确研究人类生理学的替代方案,强调了将其与临床数据相关联的挑战。
文献索引:Van Os L, Engelhardt B, Guenat OT. Integration of immune cells in organs-on-chips: a tutorial. Front Bioeng Biotechnol. 2023 Jun 1;11:1191104. doi: 10.3389/fbioe.2023.1191104. PMID: 37324438; PMCID: PMC10267470.
关于艾玮得生物
作为一家专注于人体器官芯片及生命科学设备研发与生产的创新科技公司,艾玮得器官芯片应用全场景解决方案已能够全面覆盖新药研发评价、临床药敏检测、基础科学研究等应用领域,为科研、临床、药企等客户提供一站式解决方案。
打破“反摩尔定律”,艾玮得生物器官芯片为药物研发提质增效
日程会场更新!2024微生理系统国际研讨会暨第七届类器官与器官芯片学术会议通知
预热9月 | 艾玮得生物市场活动日历大公开,精彩连连,邀您同行!
艾玮得生物血管芯片:用“芯”出发,探索血管奥秘
相关产品

关注

拨打电话

留言咨询