高分辨SID-EMR Orbitrap仪器研制及大蛋白复合物结构测定
导读:Vicki H. Wysocki课题组与赛默飞Alexander A. Makarov博士合作,首次将SID解离源装配到EMR Orbitrap仪器上,并对Streptavidin和L-GlutamateDehydrogenase蛋白复合物进行了质谱分析。
近日俄亥俄州立大学化学和生物化学系的VickiH. Wysocki教授课题组在AC上发表了一篇文章,题目为Surface-InducedDissociation of Noncovalent Protein Complexes in an Extended Mass RangeOrbitrap Mass Spectrometer。
获取蛋白质复合物的四级结构信息,对于理解其生物功能来说至关重要。与传统的CID/HCD通过多次碰撞沉积能量以实现解离相比,表面诱导解离(Surface induceddissociation,SID)是通过使复合物离子撞击一个具有化学惰性、刚性的表面,经过单次高能撞击后,产生相比于CID和HCD技术电荷更均匀分布的蛋白亚基(如图1),从而提供化学计量比和互作网络等信息。此外,相比于CID常常导致小分子配体丢失,SID可以产生保留小分子配体的复合物亚基。
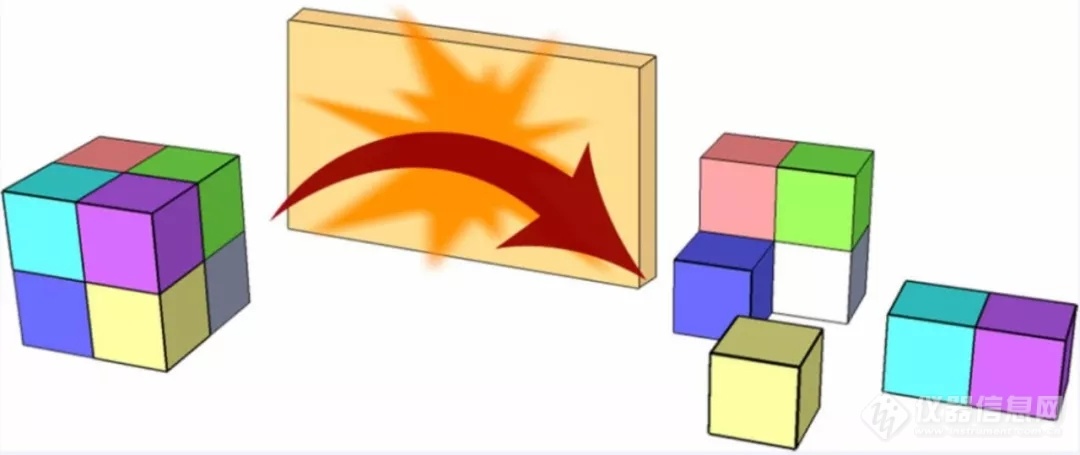
图1. SID示意图
目前,SID技术在蛋白复合物方面的工作主要是在飞行时间质谱(TOF MS)上完成,但随着蛋白复合物的分子量越来越大,结构解析深度越来越深入,对质谱仪器的分辨率也提出了更高的要求。每一种类型的质量分析器(TOF、FTICR或者Orbitrap)都有它们的优劣势,而仪器的选择主要依赖于待解决的问题本质。为此,Vicki H. Wysocki课题组与赛默飞公司Alexander A. Makarov博士合作,首次将SID解离源装配到Exactive Plus Extended Mass Range(EMR)Orbitrap仪器上(如图2)。这套SID即可用来传输离子又可用来进行SID。值得一提的是,SID装置并未影响离子进入HCD池和一级质谱分析。

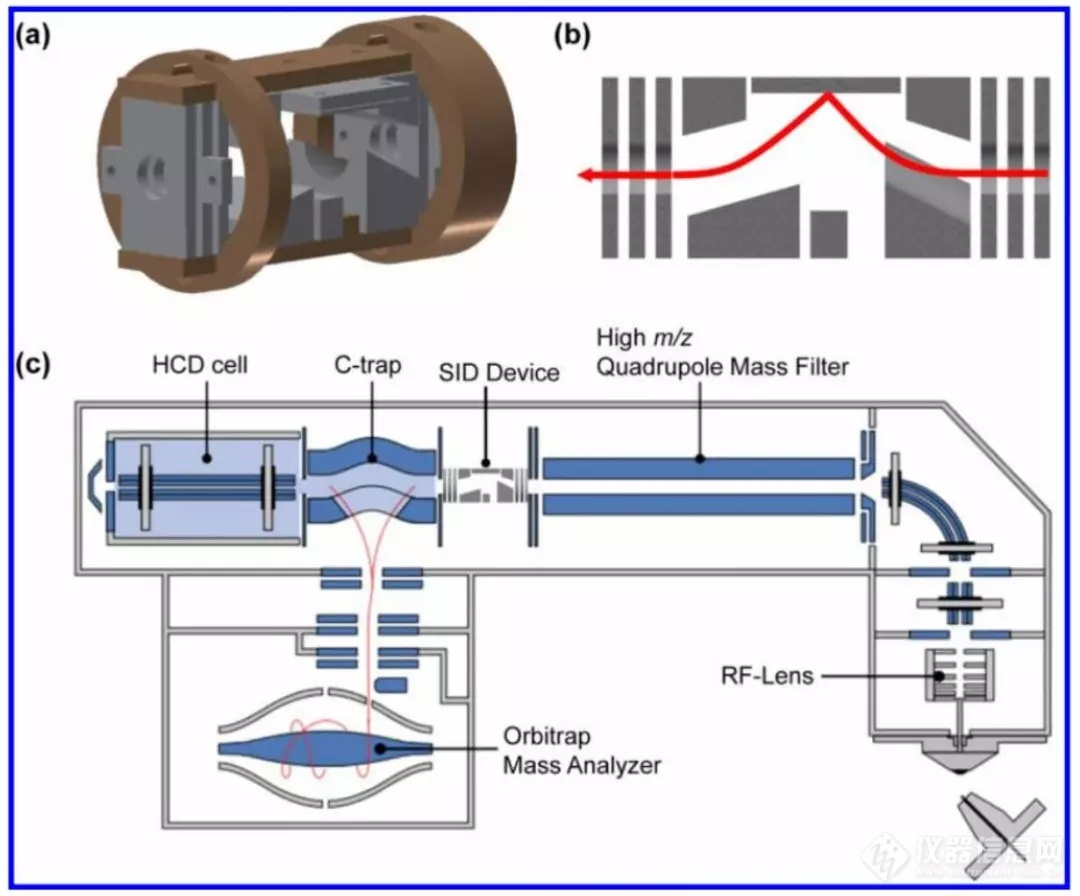
图2. a)SID装置3D设计图,b)SID模式下离子轨迹图,c)SID改造后EMR Orbitrap仪器图。
随后,作者利用该仪器对Streptavidin和L-GlutamateDehydrogenase蛋白复合物进行了质谱分析。其中,前者是具有D2对称性的同源四聚体,后者是具有D3对称性的同源六聚体。图3为Streptavidin的一级谱及其SID谱图。先前的文献表明,通过CID主要产生的是streptavidin复合物的去折叠单聚体和三聚体,但这一结果显然不能支持streptavidin是由同源二聚体组成的结构。而11+的母体streptavidin复合物经过SID会解离成两个二聚体,分别为5+和6+,证明SID更能反映他们真实的拓扑结构(图3a-c)。值得一提的是,之前对于谱图中出现的3+单聚体和6+同源二聚体,由于TOF MS分辨率不高所以要依靠IMS才能进行分辨3,但现在EMR Orbitrap在高分辨率模式(R=140,000 at m/z 200)下就可直接对它们二者进行分辨(图3d),甚至盐加和离子或者N末端Met修饰与否都可以在高分辨谱图中完全获得(图3e)。
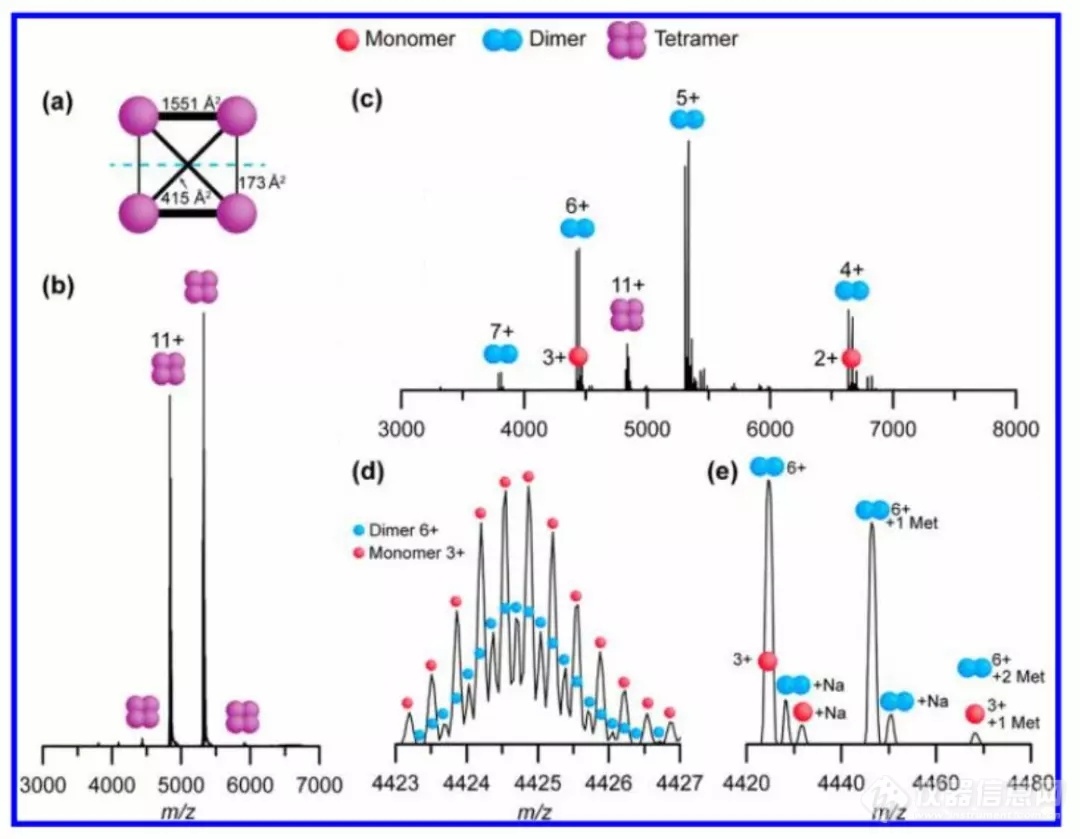
图3. a)Streptavidin四聚体拓扑结构(PDB ID:1SWB),b)Streptavidin四聚体一级质谱图,c)11+价态Streptavidin四聚体的SID谱图(45 V,495 eV),d)高分辨率模式下3+价态Streptavidin单聚体和6+价态的二聚体,e)3+价态单聚体和6+价态二聚体的N末端蛋氨酸修饰和Na离子加和谱图。
此外,作者还考察了L-Glutamate Dehydrogenase同源六聚体的拓扑结构。HCD结果表明,该六聚体很难在气相中发生解离,需要较高HCD能量和高电荷态,常常导致先失去一个去折叠单体,无法真实反映亚基组成。而通过SID可以获得比较稳定的三聚体信号,反映出L-GlutamateDehydrogenase同源六聚体的拓扑结构主要为三聚体-三聚体界面,在低能量下主要断裂较弱的三聚体界面(图4a),当能量逐渐升高单体会从三聚体亚基中解离出来(图4b)。
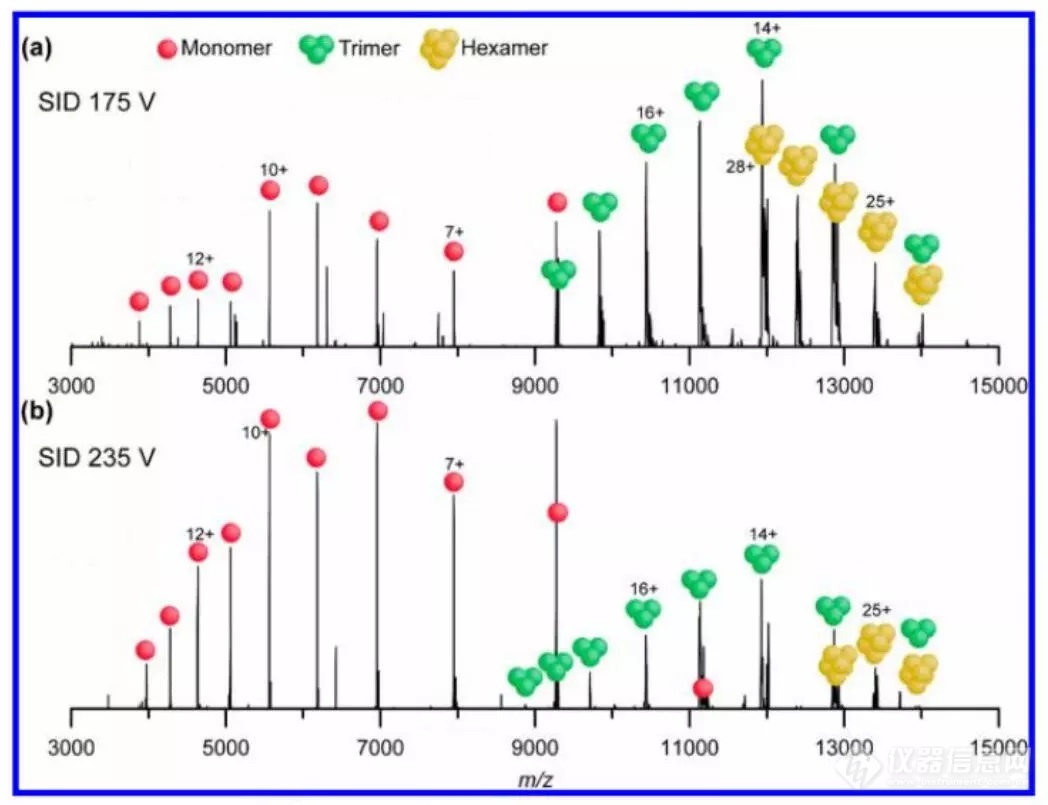
图4. 28+价态L-Glutamate Dehydrogenase同源六聚体在a)175 eV和b)235 eV能量下的SID谱图。
综上所述,相比于SID-TOF MS仪器,具有更高质谱分辨率的SID–EMR Orbitrap仪器后续将为大蛋白复合物提供更丰富的四级结构信息。此外,Vicki H. Wysocki课题组先前还报道了将SID装载到FTICR-MS仪器,在SID谱图中可对霍乱毒素(Cholera toxin B,CTB)多种亚基进行同位素分辨(R=210,000 at m/z 5803.7),例如8+四聚体、6+三聚体、4+二聚体和2+单聚体4,感兴趣的学者们可进一步了解。得益于Orbitrap和FTICR的超高质量分辨率,相信SID源将在蛋白-蛋白、蛋白-金属离子、蛋白-小分子配体复合物体系中发挥越来越重要的作用。
参考文献:
[1] VanAernum, Z.;Gilbert, J.; Belov, M.; Makarov, A. A.; Horning, S.; Wysocki, V.; Anal. Chem., 2019, DOI: 10.1021/acs.analchem.8b05605.
[2] Zhou, M.;Wysocki, V. H. Acc. Chem. Res., 2014, 47, 1010-1018.
[3] Quintyn,Royston S.; Yan, J.; Wysocki, Vicki H. Chem. Biol., 2015, 22, 583-592.
[4] Yan, J.;Zhou, M.; Gilbert, J. D.; Wolff, J. J.; Somogyi, Á.; Pedder, R. E.; Quintyn, R.S.; Morrison, L. J.; Easterling, M. L.; Pa?a-Toli?, L.; Wysocki, V. H. Anal. Chem., 2017, 89,895-901.
文献链接:
https://pubs.acs.org.ccindex.cn/doi/10.1021/acs.analchem.8b05605
(文献原文可联系仪器信息网编辑部提供,联系电话:010-5165-4077-8223)
文中提及的赛默飞ExactivePlus(EMR)Orbitrap相关信息可点击链接:
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐













