国家药监局批准颁布首批160个配方颗粒国家标准 11月1日起正式实施
进入 #2021重要标准汇总阅读更多话题内容
导读:4月29日,国家药监局官网发布消息,批准颁布第一批中药配方颗粒国家标准。
仪器信息网讯 4月29日,国家药监局官网发布消息,批准颁布第一批中药配方颗粒国家标准。此前,国家药监局、国家中医药局、国家卫生健康委、国家医保局四部门共同发布了《关于结束中药配方颗粒试点工作的公告》(以下简称《公告》),结束了中药配方颗粒试点工作,对配方颗粒品种实施备案管理,其质量监管纳入中药饮片管理范畴。
《公告》也提到,要求配方颗粒有国家标准的,应当符合国家标准。国家药典委员会(以下简称药典委)将结合试点工作经验组织审定配方颗粒的国家药品标准,分批公布。配方颗粒应当按照备案的生产工艺进行生产,并符合国家药品标准。
近日,第一批160种国家标准公布。消息指出,国家药监局在前期工作的基础上,组织国家药典委员会按照《中药配方颗粒质量控制与标准制定技术要求》和国家药品标准制定相关程序,开展中药配方颗粒国家标准制定工作。经过标准研究起草、生产验证、标准复核、专业委会审评、公开征求意见、审核等,近日批准颁布了第一批中药配方颗粒国家标准(160个)。
中药配方颗粒国家标准充分体现了中药质量的控制特点和质量全程管控理念,以“标准汤剂”为基准衡量配方颗粒与饮片汤剂的“一致性”,建立量值传递数据表与特征图谱控制指标,实现配方颗粒质量专属性与整体性的综合管控,提高了中药质量整体控制水平。
第一批中药配方颗粒国家标准颁布后,设置6个月的过渡期,将于2021年11月1日起正式实施。按照《关于结束中药配方颗粒试点工作的公告》规定,自实施之日起,省级药品监督管理部门制定的相应标准即行废止。
标准执行过程中生产企业进一步积累数据并报送国家药典委员会以逐步完善和提高标准。后续国家药监局将加快推进中药配方颗粒标准制定工作,保障配方颗粒结束试点工作顺利实施。
相应,中国药典委也于4月29日,发布《关于执行中药配方颗粒国家药品标准有关事项的通知》。
通知表示:
一、按照《关于结束中药配方颗粒试点工作的公告》第一条“中药配方颗粒的质量监管纳入中药饮片管理范畴”的要求,其标准中有关农药残留、重金属及有害元素、真菌毒素及二氧化硫残留等均参照现行版《中国药典》中药饮片的规定执行。
二、标准正文中特征图谱项所附对照图谱,下方标注的标准研究及复核中用到的色谱柱供标准执行时参考使用。标准正文中亦采用对照药材或对照饮片做随行参照物,标准执行中应综合研判。
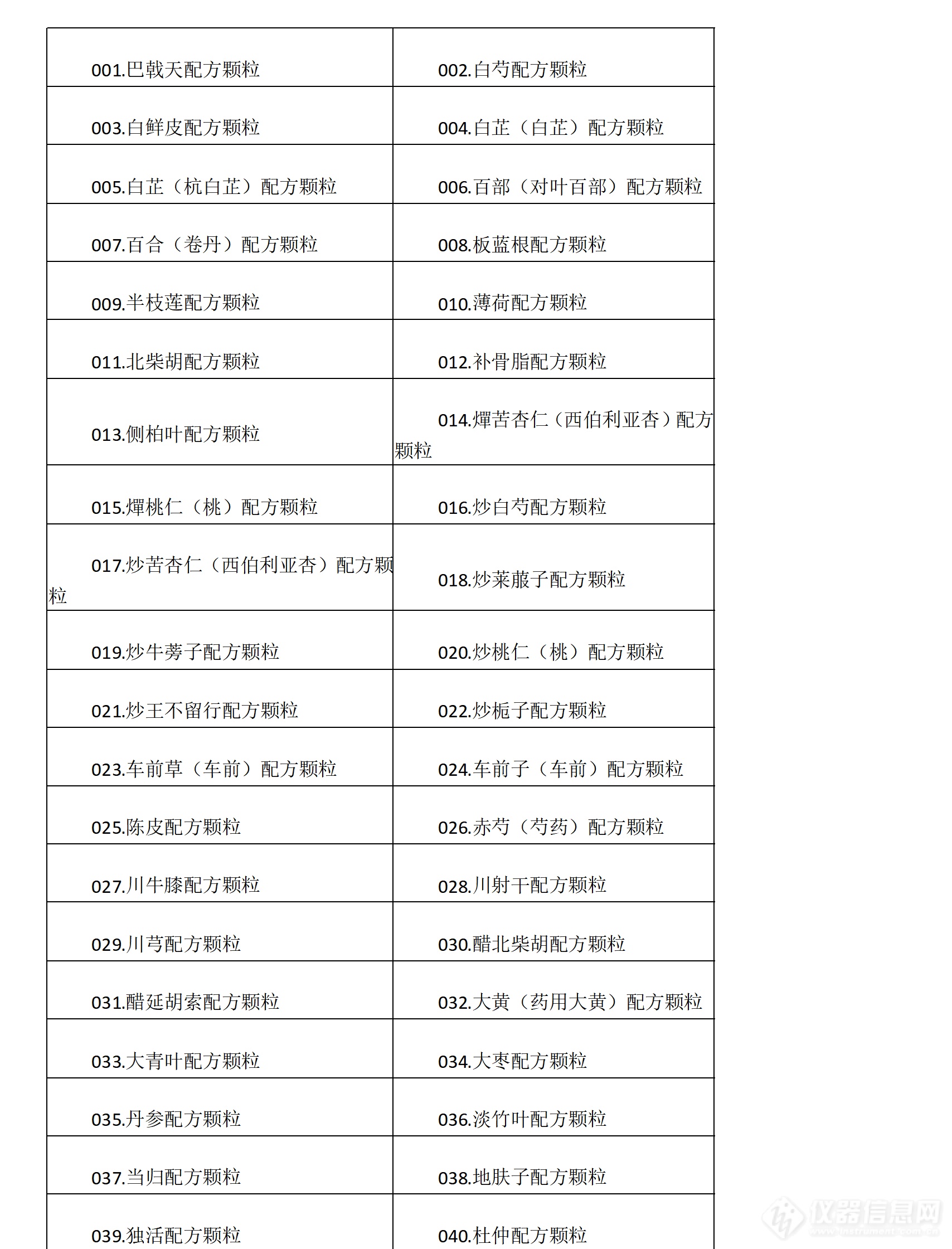
同时,药典委也就在通知中随附了160个中药配方颗粒国家药品标准全文,标准列表如下:



来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐