颠覆经典学说,李晓江团队揭示遗传性帕金森疾病新机制
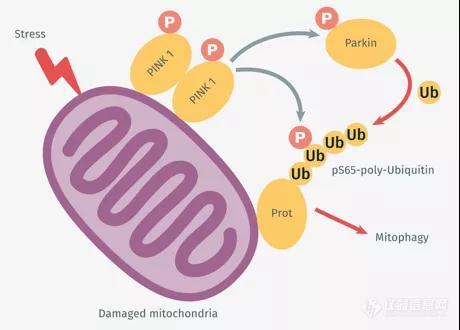
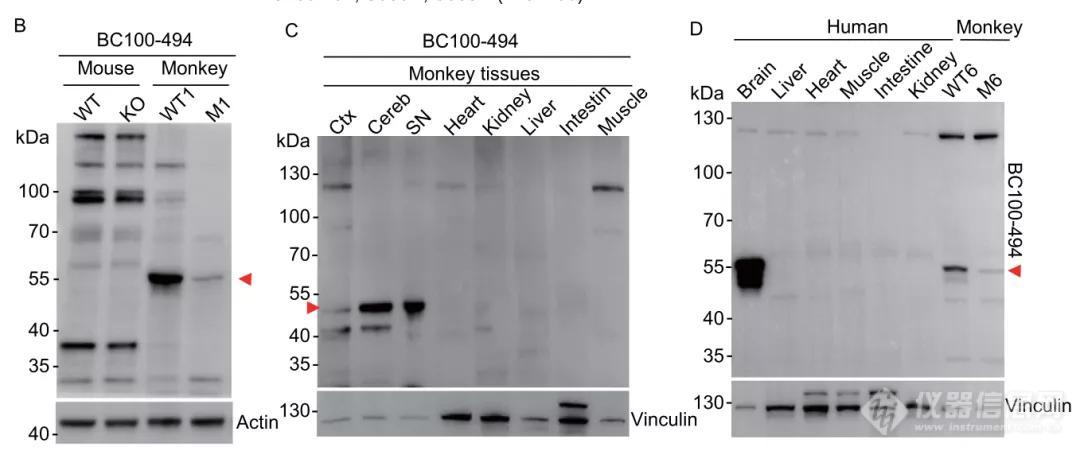
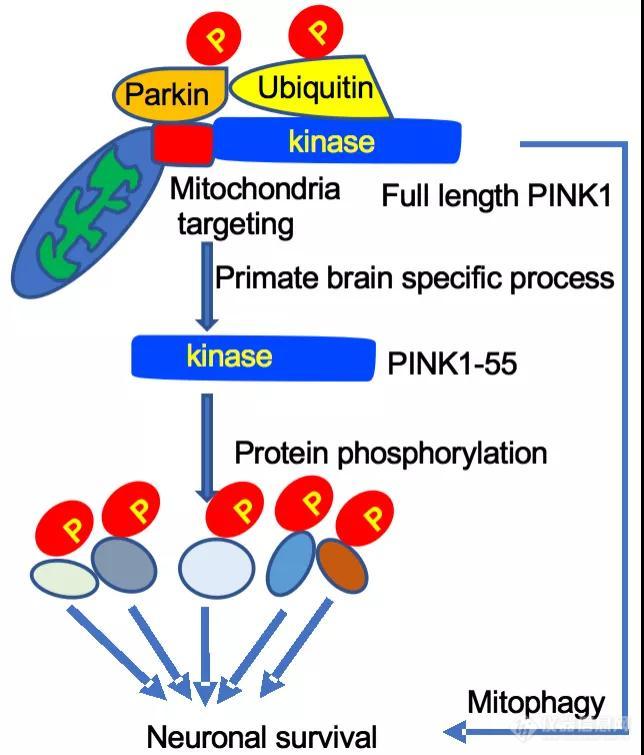
导读:该项研究利用基因编辑猴模型与死亡人脑组织深入研究帕金森病致病基因PINK1的表达与功能,颠覆了长期以来建立在体外与小动物实验基础上的经典理论,为治疗帕金森疾病提供了新的思路及依据。


来源于:BioArt
热门评论
最新资讯
新闻专题
更多推荐
写评论…
0
导读:该项研究利用基因编辑猴模型与死亡人脑组织深入研究帕金森病致病基因PINK1的表达与功能,颠覆了长期以来建立在体外与小动物实验基础上的经典理论,为治疗帕金森疾病提供了新的思路及依据。





来源于:BioArt
热门评论
最新资讯
新闻专题
更多推荐