Cell Stem Cell | 有神经、有腺体、有肌肉的人胃类器官诞生!
导读:该团队开发了由源自人类多能干细胞的三原胚层的细胞组装而成的包含功能性肠道神经元、平滑肌层和分化腺体的人胃类器官,利用该系统证明人类肠神经嵴细胞对胃上皮和间充质发育的关键作用。
胃肠道(gastrointestinal, GI)所有器官均由胚胎发育过程中源自三原胚层的细胞组装而成,且是正确执行胃肠道复杂功能所必需的。比如说,胃以化学和机械方式分解食物的关键功能取决于内胚层形成的上皮细胞之间复杂的相互作用以产生胃酸和蛋白酶,中胚层发育而来的平滑肌控制缩放,而外胚层而来的肠道神经负责协调前两个过程。
近端胃肠道的先天性和获得性疾病包括食管闭锁、胃轻瘫和胃食管反流病,这些疾病可能由上皮、肠道神经系统(enteric nervous system, ENS)或平滑肌发育不当引起。尽管动物模型对于研究胃食管的发育和疾病非常重要,但不同物种在该器官中存在巨大的结构和功能差异,例如啮齿动物就具有人类不存在的前胃,Hedgehog信号在鸡和小鼠胚胎中胃肠平滑肌的发育中也具有不同作用【1】。因此,创建一种可在体外操作的遗传易处理且复杂的人类GI 组织模型可以加速改善胃食管功能药物的开发和研究。然而,当前的胃和食管类器官模型的局限性在于它们仅包含上皮组织【2, 3】,因此,迫切需要在体外整合来自其他两个胚层的祖细胞从而增加食管类器官的复杂性。
2021年12月1日,来自美国辛辛那提儿童医院医学中心的James M. Wells团队在Cell Stem Cell杂志上发表了一篇题为 Functional human gastrointestinal organoids can be engineered from three primary germ layers derived separately from pluripotent stem cells的文章,该团队开发了由源自人类多能干细胞的三原胚层的细胞组装而成的包含功能性肠道神经元、平滑肌层和分化腺体的人胃类器官,利用该系统证明人类肠神经嵴细胞(enteric neural crest cells, ENCCs)对胃上皮和间充质发育的关键作用,并为其他复杂类器官的开发提供了一个强大的范例。

胃肠道发育的第一个,也是最关键的步骤之一是将上皮细胞和间充质组装成原始肠道管。尽管多能干细胞衍生的人胃类器官具有完整的上皮细胞类型,但它们本质上并没有形成强大的间充质【2, 3】。为此,作者根据最近建立的一种方法,直接将人多能干细胞分化为胃间充质细胞的来源,即内脏间充质细胞(splanchnic mesenchyme, SM)【4】,并尝试将间充质纳入胃类器官发育,通过标记物鉴定确认具有间充质包裹上皮的胃窦类器官(hAGOs)生成(图1)。紧接着,作者将有无间充质的hAGOs移植到小鼠体内培养,结果显示约60%没有添加间充质的hAGOs 没能继续生长,即使存活下来也仅有简单的未完全分化的结构,相反,那些具有间充质的hAGOs具有100%的存活率,说明间充质的的掺入能促进hAGOs在体内的生长。
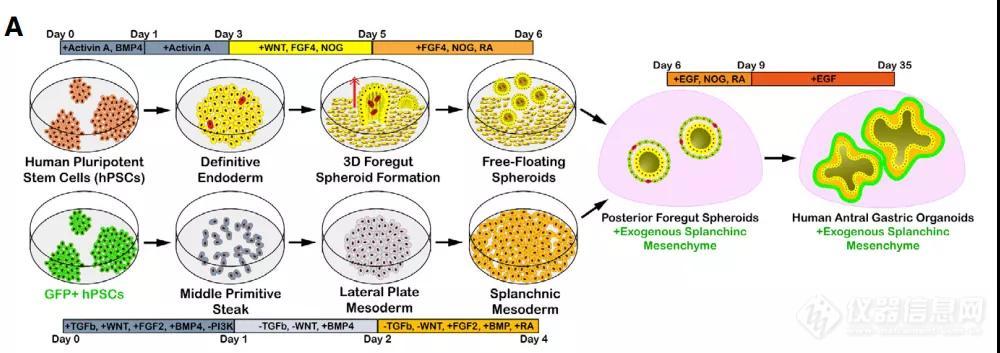
图1. 由人多能干细胞衍生hAGO+SM类器官方法示意图
需要注意的是,尽管SM能促进hAGOs的生长,但上皮并未发育成类似于人胃的腺体结构。为了解决这个问题,作者基于先前的研究从人多能干细胞中获取ENCCs,将其与hAGOs+SM在体外重组后再次移植到小鼠体内,并惊喜地发现hAGO+SM+ENCCs移植物具有嵌入肠道神经元网络的平滑肌层,且其组织方式类似于人38周的胎儿胃,并包含胃窦细胞类型,比如粘液细胞、表达生长素释放肽、组胺和胃泌素的内分泌细胞等。采用类似的方法,作者还生成了胃底类器官(hFGOs),hAGOs和hFGOs在移植后仍能保持它们的区域特性,通常将人类胃底与胃窦区分开来的细胞类型比例也同样能将hAGOs与hFGOs区分开。
从组织结构上来看hAGOs和hFGOs类似于人胃,那么功能上呢?胃对食物的机械分解和十二指肠的排入涉及ENS对平滑肌的收缩控制。作者将从hAGOs分离的组织置于器官水浴系统检测其收缩性,来判断是否存在功能性神经肌肉单位。可以观察到源自hAGO+SM+ENCC的组织存在高度规则的自发收缩振荡,而hAGO+SM的收缩活动则是不规则的。此外,将分离的组织暴露于电场刺激(EFS),仅导致hAGO+SM+ENCC收缩活动增加,表明ENS对平滑肌的调节,如果添加神经毒素TTX阻断ENS功能,也消除了平滑肌的收缩活动。
在构建类器官的过程中,作者还发现ENCCs能引起上皮周围的间充质细胞增加2-4倍,且与胃间充质细胞基因BARX1、NKX3-2等的表达水平增加相关,说明肠道神经元在促进对于生成胃特异性间充质细胞。此外,作者将hAGO+ENCC移植到小鼠体内,研究在没有间充质的条件下ENCCs如何影响上皮发育。作者发现,在21个移植物中有5个存在明显的腺上皮形态发生,而19个没有ENCCs的hAGO均未有上皮形态发生,这一发现说明如果没有足够的间充质参与,单独添加ENCCs不会导致正常胃的发育,但也会促进hAGO的存活和部分移植物中腺上皮的发育。然而,这些腺上皮并不表达关键的胃或肠特异性上皮标志物,而与十二指肠近端黏膜下层,靠近幽门连接处的Brunner腺体相似,说明ENCCs需要强大的间充质细胞群来促进胃腺形态发生,即间充质和ENCCs的信号协同作用对于维持胃特征而言十分重要。
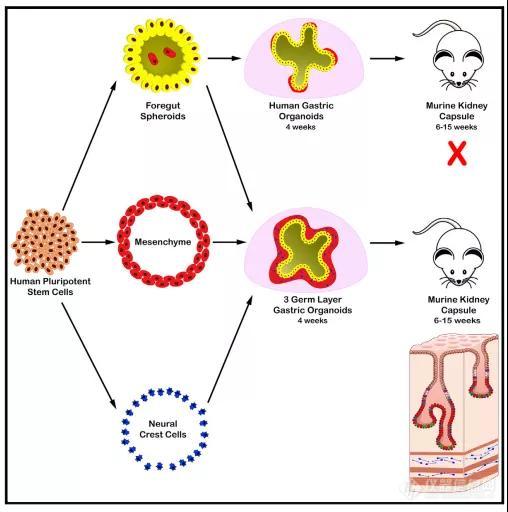
除了胃窦和胃底类器官,作者还利用上述方法设计了食管类器官,说明通过组合三个胚层祖细胞来设计不同胃肠道器官的可行性,同时也强调了上皮、间充质和ENCCs细胞间通讯对于胚胎器官的正确组装和功能的重要性,为重建先天性GI疾病和上消化道急性损伤模型提供了研究材料。
来源于: BioArt
热门评论
最新资讯
新闻专题
更多推荐













