【指南与共识】流式细胞术在CAR-T细胞免疫治疗相关检验中的应用专家共识
进入 #流式细胞技术进展阅读更多话题内容
导读:流式细胞术(FCM)在CAR-T细胞免疫治疗相关检验的每一个步骤中都起到非常重要的作用,包括靶点筛查、CAR-T细胞产品成分鉴定、毒性预估、微小残留病(MRD)检测、免疫功能评价、免疫微环境研究等。
文章来源:中华检验医学杂志, 2022,45(8) : 790-801
作者:中国中西医结合学会检验医学专业委员会
摘要
嵌合抗原受体(chimeric antigen receptor,CAR)-T细胞免疫治疗是近年来肿瘤治疗领域一个举世瞩目的重大成果[1, 2, 3, 4, 5, 6, 7],尤其是CD19-CAR-T细胞免疫治疗难治复发B细胞急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)获得了90%左右的缓解率[1, 2, 3],单独使用或者桥接异基因造血干细胞移植均极大程度地提高了患者的完全缓解率和生存率;CAR-T细胞免疫治疗其他类型白血病、淋巴瘤、骨髓瘤以及实体瘤也在不断探索并取得巨大进步[4, 5, 6, 7]。流式细胞术(flow cytometry,FCM)在CAR-T细胞免疫治疗相关检验的每个步骤中都起到非常重要的作用 [1, 2, 3, 4, 5, 6, 7]。
作为一项免疫治疗,CAR-T细胞免疫治疗相关检验中涉及的FCM与临床常规不同,体现在靶点评估需要精确设门并且同时关注正常细胞的表达,CAR-T细胞免疫治疗后微小残留病(minimal/measurable residual disease,MRD)需要考虑靶点丢失以及输入的CAR-T细胞影响,而CAR表达细胞比例和数量的检测以及免疫相关检测均缺乏规范化,给临床工作带来不确定性等。为了能使更多相关领域的科研、临床和实验室检测人员认识FCM在CAR-T细胞免疫治疗中的作用和注意事项,规范在每项检验中的实验方案和技术操作,进一步促进其在CAR-T细胞免疫治疗中的应用,中国中西医结合学会检验医学专业委员会组织专家结合文献学习和多家医疗机构的临床工作实践制定了本专家共识。
适用范围、术语和定义
一、适用范围
各类医疗机构临床实验室、商业化实验室和科研单位在使用FCM进行CAR-T细胞免疫治疗相关临床检验时,均可采用或参照使用本专家共识。鉴于CAR-T细胞生产过程中的创新性和复杂性,并且该步骤极少在临床诊断实验室中进行,本共识不涉及此研发过程。
二、术语和定义
1.多参数流式细胞术(multiparametric flow cytometry,MFC):虽然MFC的术语出现于20世纪80年代,当初指代两色以上FCM,后期对此也没有明确定义,但是现在普遍建议采用三激光八色或者以上机型。
2.CAR-T细胞免疫治疗:人体免疫细胞(来自自体或异体均可),在体外经过基因修饰后具备了特异性识别和杀伤表达特定抗原的肿瘤细胞的能力,输入患者体内以实现清除肿瘤细胞或者其他病态细胞的免疫治疗方法[1, 2, 3, 4, 5, 6, 7]。CAR-T细胞免疫治疗技术包括几个步骤:(1)从患者或者供者血液中分离出自体或者异体T淋巴细胞;(2)用CAR编码的病毒载体进行体外修饰、培养;(3)最后输入患者体内。近年来为了增强治疗效果降低副作用,已发展到第4代CAR-T细胞免疫治疗技术。
3.细胞因子:细胞因子是由多种免疫细胞分泌的一类小分子蛋白质,具有介导和调节免疫过程等作用。目前已经发现的人类细胞因子有200多种。根据结构和功能一般可分为白细胞介素(interleukin,IL)、干扰素(interferon,IFN)、肿瘤坏死因子(tumor necrosis factor,TNF)、集落刺激因子、趋化因子和生长因子等。
4.细胞因子释放综合征:细胞因子释放综合征(cytokine release syndrome,CRS)是一种发生在任何免疫治疗后,由于内源性或者输注的T细胞和/或其他免疫效应细胞活化或者聚集导致的超生理反应。症状多样,但是必须包括初发时发热,可能伴有低血压、毛细管渗漏(低氧)和终末器官衰竭。尽管没有将细胞因子检测纳入定义,而CRS分级也主要是根据临床表现,但是鼓励进行C反应蛋白、细胞因子、铁蛋白等相关检测,便于为将来的研究提供依据[8]。
5.趋化因子及其配体:趋化因子是能使细胞发生趋化运动的小分子细胞因子,其配体很多是免疫功能检测中区分淋巴细胞亚群的重要标志物,例如半胱氨酸-半胱氨酸基序趋化因子受体(cysteine-cysteine motif chemokine receptor,CCR)系列,半胱氨酸-氨基酸-半胱氨酸基序趋化因子受体(cysteine-X-cysteine motif chemokine receptor,CXCR)系列[9]。
6.抗原表达率:精确设门后,特定细胞上抗原表达的百分比。临床工作中由于受到抗体和荧光素选择、抗原抗体结合过程、温度光照和放置时间导致荧光信号改变、仪器设置、设门精确度、个体差异、细胞异质性、对照细胞群、检测目的等多种因素影响,以诊断为目标的临床实验室,一般由流式操作人员排除各种影响因素后,按照表达、部分表达、不表达进行定性描述[10],以方便临床和实验室对目的细胞群进行简单直观的性质判断。
7.抗原表达强度:与某种抗原分子在细胞上表达量的多少有关,FCM的直观体现为荧光强度。根据抗原表达强度将阳性细胞表达分为强表达(bright,bri)、中等强度表达、弱表达(dim)和异质性表达[10],可能会随着治疗和疾病或者活化状态发生改变。
8.单链可变区片段(single-chain variable fragment,scFv):构建CAR-T细胞需要将CAR基因通过病毒载体或非病毒系统转染并整合到T细胞基因组上。CAR基因正常表达时,形成跨膜的CAR结构,细胞外域的重链可变区和轻链可变区通过15~20个氨基酸短肽连接而成的部分即为scFv。编码的scFv元件既是CAR-T细胞识别肿瘤抗原的重要成分,也可作为FCM评价CAR表达情况的检测靶点之一。
9.同型阴性对照:用于检测抗体与细胞表面可结晶段受体非特异性结合导致背景信号的阴性对照。应该用与检测抗体相同标记、同种属来源、相同亚型、相同浓度的免疫球蛋白进行染色,如果是间接标记抗体,还需要做二抗的荧光素背景对照,其作用是设置仪器条件,消除背景染色。对于正常标本中不存在的未知标志或者与阴性细胞界限不清的标志,或者标本中比例极低需要精确检测的标志,同型阴性对照是普遍采用的对照。
CAR-T细胞免疫治疗相关检验中的FCM项目
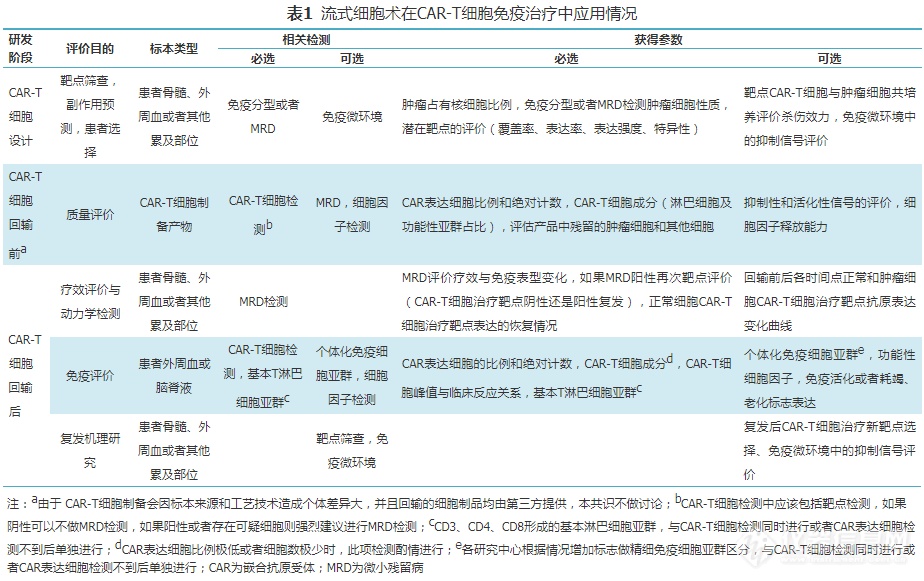
CAR-T细胞的生产研发、临床治疗每个环节都与FCM检测密不可分,包括靶点筛查、患者选择、CAR-T细胞成分鉴定、毒性预估、MRD检测、回输物和患者标本免疫功能评价、免疫微环境和复发机制研究等。鉴于CAR-T细胞治疗这一全新领域集合了肿瘤细胞和正常细胞免疫表型、肿瘤干细胞免疫表型、免疫细胞亚群、细胞因子检测、CAR-T细胞检测、因部分病例靶点丢失甚至系别转变导致需要调整方案的FCM MRD检测、肿瘤异质性和免疫微环境检测等(表1),以及CAR-T细胞治疗设计的多样性和复杂性、临床工作中使用不同靶点或者联合靶点CAR-T细胞治疗、使用其他细胞因子或者信号分子靶向药物控制副作用等,这些都对FCM检测提出更高的要求。因此深入了解每个环节需要使用的标本类型、检测方案以及最低检测要求,将有助于进一步规范检测流程,提高检测水平,保证检测质量。
FCM在CAR-T细胞免疫治疗靶点筛查中的应用
随着CAR-T细胞治疗技术的不断完善,CAR-T细胞的功能和治疗的安全性都有了很大提升,并有CAR-自然杀伤(natural killer,NK)细胞、双特异性靶点CAR-T细胞等类似靶向细胞免疫治疗产品出现。但是作为特异性免疫治疗,胞外抗原识别区的设计,尤其是有效靶点的选择始终是每一种CAR-T细胞治疗相关产品的关键环节。理想的靶点应该满足下述要求:高覆盖率(某种疾病的群体中,肿瘤细胞表达该抗原的患者比例高)、高表达率(阳性个体中几乎所有肿瘤细胞都表达)、高表达强度(在肿瘤细胞表面抗原分子数量多,表现为同一种荧光标记时,荧光强度高)、高特异性(在正常细胞中不表达或者少表达,对患者不会造成严重影响)[11]。FCM作为一项快速、简便、直观、定性定量的技术,是目前实现这一目的的重要检测手段,而CAR-T细胞治疗靶点的选择虽然都是在免疫分型或者MRD的基础上进行,但是比常规临床诊断有更严格的特殊注意事项[12, 13]。
一、正确设门评价肿瘤克隆
在2021年中国的《急性白血病系别判断的流式细胞免疫分型专家共识》[10]中已经对检测方案和设门方法作出明确推荐,对于肿瘤负荷(肿瘤占有核细胞比例)、肿瘤细胞免疫表型分析、精确设门识别小克隆肿瘤细胞,建议参考此共识。需要指出的是:(1)在CAR-T细胞治疗时代之前,免疫分型的主要目的是诊断,故出于性价比考虑和仪器条件所限,只要肿瘤为单一克隆,抗原表达的判断多为阴性阳性的定性检测,大多数标志无需给出明确的百分比数值;(2)临床工作中,由于流式细胞仪检测通道数量的限制,每个抗体组合可使用的抗体数量有限,为了尽可能在相同数量抗体的情况下获得更多临床信息,一些实验室的免疫分型方案除了CD45以外,不重复使用其他设门抗体;(3)这种普遍使用CD45/侧向角光散射(side scatter,SSC)设置肿瘤细胞门的方法,因为CD45弱表达(dim)、SSC小的区域本身就包括NK细胞、嗜碱性粒细胞、正常髓系原始细胞、正常增生B祖细胞、树突状细胞、幼稚单核细胞、浆细胞、部分有核红细胞等,导致设门精确度有限,尤其是参数较少的机型。在做不到使用标志精确设门的情况下,抗原表达的描述必然是定性的。
因为目的不同,最低要求也不同。以临床诊断为目的的普通免疫分型,采用设门精确度不影响诊断即可接受的方法;而CAR-T细胞治疗时代的到来,对于设门的精确度提出了更高的要求:(1)虽然现在还缺乏靶点表达率和表达强度对于缓解率和长期存活率影响的数据[13],但是在临床治疗的初期,希望通过选择最理想的靶点准确评价CAR-T细胞治疗效果,建议临床治疗团队与FCM团队沟通,明确告知靶点筛查目的并调整方案;(2)在全面诊断结果出来之前,肿瘤性质、存在的恶性克隆数量及精确抗原表达情况、最能够准确定义全部肿瘤细胞群的标志或标志组合(精确设门)都是未知的,只能根据覆盖大多数疾病的理念设计方案,这种方案对于CD19、CD7等在B-ALL和T-ALL中覆盖高的系别标志尚可,但是对于急性髓系白血病、淋巴瘤、实体瘤等,由于特殊靶点在每个患者肿瘤细胞群上表达存在异质性[12,14],可能达不到精确设门要求,需要在免疫分型基础上后续进行靶点评价;(3)CAR-T细胞治疗后复发的病例,存在更大的异质性[15],因此靶点筛查工作会根据实验室情况和诊疗过程分层次进行。
共识1:CAR-T细胞免疫治疗靶点筛查与常规诊断检测目的不同,临床需要与实验室沟通告知检测目的,在临床常规免疫分型或者MRD检测的基础上,通过精确设门来准确评价潜在靶点抗原在肿瘤细胞群的表达。推荐强度:强烈建议。
二、正确评价肿瘤细胞中抗原表达的百分比和表达强度
目前的研究和临床应用,因为需要准确评价CAR-T细胞治疗靶点针对的肿瘤细胞,建议应在精确设门定义肿瘤细胞群之后,对潜在靶点进行定量分析。而这个定量,既包括了抗原表达的百分比,也包括表达强度。虽然目前还没有关于CAR-T细胞治疗靶点的表达百分比和表达强度的适合区间要求,而且鉴于FCM检测的多种影响因素,可能在今后一段时间内也无法作出统一要求,但是为了使研究工作规范化,从FCM角度尽可能提供客观评价,建议:(1)医疗机构(最好扩大到多中心合作研究),尽可能采用相同的方案,至少关键抗体和组合采用相似方案,包括抗体的克隆号和荧光素以及主要设门和配伍标志。(2)鉴于行 CAR-T细胞免疫治疗的患者,往往是MRD阳性的难治复发病例,免疫表型可能会随着治疗发生改变[14],建议在CAR-T细胞回输前对免疫表型再次进行严格评价确认。(3)关于潜在靶点的表达率评价,在精确设门的基础上,强表达和中等强度表达的抗原,因为阳性细胞和阴性细胞之间有明确的界限,相对好评价;弱表达或者异质性表达抗原可能不适合采用表达百分比的方式,暂时可以采用目的细胞中位荧光强度(median fluorescence intensity,MdFI)和对照MdFI比值(MdFI ratio,MdFIR)的方法[16, 17]。(4)CAR-T细胞治疗靶点筛查报告应尽可能包含丰富的实验数据,为临床靶点筛查分级和毒副作用预判提供实验数据支撑,建议提供:①肿瘤细胞的靶点抗原表达率、表达强度;②阴性对照或者阳性对照(如果有)、肿瘤细胞的MdFI,以及MdFIR等。
为了更加精确地比较抗原表达强度,对目的细胞上抗原表达进行量化会更有助于CAR-T细胞免疫治疗靶点的研究。但是目前由于技术所限,极少有实验室采用荧光定量微球进行绝对定量检测,大多数采用仪器自动生成的MdFI或者平均荧光强度。使用的时候应注意,MdFI值依赖每个实验室的仪器和试验条件设置,因此需要检测过程的标准化和对仪器的校准。有的研究中心采用与同型对照或者阴性内对照细胞MdFIR的方法,可在一定程度上缩小差异,但是不能替代FCM检测的规范化、标准化,并且需要确定阴性细胞的一致性[17]。
共识2:为了尽可能给CAR-T细胞免疫治疗提供客观评价,建议一项研究或治疗过程中尽量采用相同的方案,至少是关键抗体和组合相似的方案。同一患者的随访监测尽量在同一台仪器上进行,且尽量仪器条件(包括补偿)相同,或者进行仪器间条件比对。推荐强度:建议执行。
共识3:在CAR-T细胞回输前对靶点在肿瘤细胞的表达情况进行严格评价:强表达和中等强度表达的抗原,在精确设门基础上采用百分比的报告方式;弱表达或者异质性表达抗原不建议采用表达百分比的方式,可以采用目的细胞和对照细胞MdFIR方法。采用MdFI和MdFIR时注意仪器校准。推荐强度:建议执行。
三、背景细胞的表达评价涉及CAR-T细胞治疗的毒副作用
靶点筛查还包括抗原特异性的评价,即该标志物在正常细胞表达情况。理想靶点是只特异性表达于肿瘤细胞,或者在正常细胞的表达率低,或者这些细胞的功能可以被其他细胞或者药物替代。虽然目前除了B细胞相关抗原CD19、CD20、CD22,几乎没有抗原是绝对特异和表达率低的,但是现代基因修饰改良技术在逐渐克服这个问题,如基因敲除CD7-CAR-T细胞的出现[18],而此过程中FCM功不可没,因为通过FCM精确分析各种潜在靶点在不同细胞上的表达情况,才能预测毒副作用。选择直接的理想靶点,或者让一些特异性差的靶点通过基因修饰技术改良而降低副作用从而满足临床需要,建议将这些信息在靶点筛查报告中也予以体现,至少以彩色图片方式。
共识4:在评价肿瘤细胞的同时,应该评价CAR-T细胞免疫治疗靶点标志在正常细胞表达情况,未知新靶点筛查尤其需要抗原特异性信息,建议在靶点筛查报告中予以体现,至少以彩色图片方式。推荐强度:建议执行。
MRD相关检测
由于肿瘤适应性和脱靶效应的存在,CAR-T细胞治疗后的MRD检测难度增加,最重要的就是设门标志的选择和认识靶点阴性的正常细胞。
一、设门标志的选择及检测方案的修订
CAR-T细胞治疗之后,经过长度不等的消减期,靶点表达细胞会逐渐恢复,但是也存在正常或者肿瘤细胞靶点阴性的情况。因此CAR-T细胞治疗后的MRD检测时需要注意,如果是靶点为CD19、CD7等设门相关系别标志,需要增加设门抗体。以CD19-CAR-T细胞治疗后MRD检测为例:(1)需要增加B细胞设门标志,因为13%~60%的B-ALL病例在CD19-CAR-T细胞治疗后会出现肿瘤细胞CD19全部或者部分表达丢失或者减弱,导致CD19设门方法可能会漏诊[3,19];(2)关于增加设门标志的选择,有的实验室选择CD22+和/或CD24+/CD66b-,但是B-ALL有10%~20%的病例不表达CD24[20]。而现在随着CD22-CAR-T细胞单独或者联合CD19-CAR-T细胞的应用越来越广泛[21],加上CD22在幼稚细胞弱表达而后随着细胞的成熟表达逐渐增强,都决定了CD22可能更加适合于靶点筛查,不适合作为设门标志;(3)从覆盖最完整的B细胞群角度考虑,胞浆CD79a是CD19以外作为B细胞设门的相对理想选择[3];(4)关于B-ALL MRD的其他标志选择,经过多年发展已有比较成熟的经验,一般选择CD38/CD10/CD34/CD19/CD20/CD45(和CD81和/或TdT等)[3,20],方案详见表2。
二、免疫表型与观察方法的改变
选择cCD79a设门时需要注意:(1)破膜处理会导致SSC和部分抗原表达强度发生改变,如SSC和CD45的细胞间差距缩小,导致CD45/SSC组合CD45/CD19以及其他涉及CD45dim和SSC增大的组合效率降低,提高MRD检测难度;(2)认识CD19-的正常B祖细胞免疫表型,与常见的CD19+B祖细胞不同,这群细胞多为CD34+的最早期阶段,CD10表达减弱,SSC偏大,在不熟悉的情况下极易误诊为MRD[3,20,22];(3)CD19-B祖细胞正常情况下也存在,但是因为大多数比例极低,加上使用CD19设门,所以容易被忽视。使用CD19-CAR-T细胞治疗之后,CD19+B祖细胞比例显著降低,导致CD19-B祖细胞比例相对升高,加上设门方式的改变,以及对CD19-B祖细胞的关注,使得这群细胞变得明显。
鉴于肿瘤细胞的异质性在CAR-T细胞治疗之后进一步加剧,即便使用替代设门标志,仍会因标志表达减弱或者脑脊液标本不适合使用胞浆标志等原因给检测带来困难。因此应该充分利用每一个标志进行多重标志设门,如B-ALL MRD检测中使用SSC/CD10、SSC/CD34、SSC/TdT等,T-ALL中使用CD99bri/SSC、cCD3/CD45dim、CD5/CD45dim、CD34和/或CD1a/SSC、TdT/SSC等,多发性骨髓瘤(multiple myeloma,MM)使用CD229/CD45dim、CD138/CD45dim等;CSF标本正常不存在CD45dim/SSC小/CD10+和/或CD34+/CD38+细胞,因此采用CD34和/或CD10和/或CD38组合CD45设门的方法,结合CD22表达进行鉴定。
此外,还应注意ALL患者CAR-T细胞治疗后可能发生髓系转换[15]。CD7-CAR-T细胞免疫治疗后,因回输物与疾病属于同一系别,可能因回输细胞或者反应性细胞与正常细胞表型不同而影响MRD检测。
三、检测时间点
研究发现,CAR-T细胞治疗后靶点表达细胞在1~3个月开始恢复[1, 2, 3,18,20, 21, 22],如果除了CAR-T细胞治疗之外没有其他治疗措施,骨髓标本的检测时间最好为前6个月内每月1次,至少前6~12个月内每3个月1次;外周血至少为前6个月内每月1次[2];因为CAR-T细胞会进入CSF,因此建议使用FCM进行CSF的MRD和CAR-T细胞检测,时间点酌情选择[2]。
共识5:鉴于CAR-T细胞免疫治疗后靶抗原丢失率高,建议增加相似覆盖率的替代设门标志物,联合使用2个及以上重要系别标志分别设门分析,并结合使用原始标志设门分析。注意CAR-T细胞免疫治疗后靶点阴性正常细胞的表型变化。推荐强度:强烈建议。
共识6:CAR-T细胞免疫治疗后复发不只限于骨髓,建议CSF或者其他可取材的受累组织都应该进行MRD检测。骨髓标本的检测时间点至少为前6~12个月内每3个月1次;外周血至少为前6个月内每个月1次;CSF标本酌情检测。推荐强度:强烈建议。
免疫功能相关检测
广义的免疫功能检测包括所有免疫相关细胞亚群的组成比例、数量、表型及功能检测:(1)CAR表达细胞比例、绝对数以及组成成分;(2)淋巴细胞和其他免疫细胞亚群检测;(3)非常规检测或者可以由其他技术完成的检测,如免疫抑制信号和细胞因子检测等。其中既有组合同时进行检测,也有分开进行检测,这主要由检测时间点和CAR表达细胞的比例与计数决定。一般临床试验初期摸索条件时,检测参数相对较多,时间点也相对较为密集;摸索到相应规律后,根据变化规律及临床表现,选择重要的时间点进行检测,而不同时间点的检测指标也会有差别;针对CAR-T细胞回输物质量鉴定,或者在CAR-T细胞治疗早期CAR表达细胞比例相对较高、绝对数较高时,检测的指标会相对全面,后期比例降低、细胞数减少,检测的指标会相对简单;患者CAR-T细胞输注周期中,早期变化较大较快,检测点也相对密集,后期变化延缓,检测间隔拉长。
一、CAR表达细胞的检测
FCM检测目的多样,因此从方案设计到检测结果,都需要根据相应目标进行沟通调整,才能在现有条件下获得尽可能精确的结果,从靶点筛查到CAR表达细胞比例和绝对数及组成成分检测皆如此[11,23, 24]。
(一)CAR表达细胞检测抗体
目前,绝大多数CAR-T细胞治疗处于实验室开发和临床研究阶段,出于设计和工艺的多样性和创新性,以及FCM仪器、荧光素以及成本所限等原因,还不能作出适用于所有类型CAR表达细胞的统一性实验方案,尤其是针对CAR表达细胞的比例和绝对计数检测,还没有通用的商品化抗体。但是抗体使用的基本原则相同,即在同一研究(尤其是多中心研究,尽可能包括更多的类似研究)的全过程中应该尽量保持一致,以便更好地对比在生产和使用的不同阶段产生的结果。例如:从生产到临床治疗过程中,最好使用相同的试剂、荧光素、对照,以及相似的方案;对于结果判读也应事先沟通和培训,统一数据分析标准,如设门原则等,尽可能采取一致性原则;对于少数有疑问的病例,应共同讨论研究[23, 24]。
在CAR-T细胞检测中,最关键的就是检测CAR表达细胞的抗体,可选择的试剂类型包括抗scFv独特型的单克隆抗体、靶点融合蛋白抗体、重组蛋白L和抗标签单克隆抗体[24]。各类试剂各有优缺点,基本上都由CAR-T细胞研发公司特制提供给检测单位。由CAR-T细胞研发公司和定制抗体生产商负责对抗体的特异性、交叉反应性、稳定性、纯度和荧光素进行评价,并做染色方法的线性范围、准确度、专属性、重复性、精密度和耐用性等质量控制,从而保证可靠标记和每一批次的CAR表达细胞检测抗体具有良好的稳定性。如有商业化的抗体或蛋白,尽量采用商业化试剂。
对于临床实验室的建议:(1)鉴于CAR属于未知抗原,缺乏正常细胞作为内对照,因此建议使用同型阴性对照(必要时增加未经改造的细胞作为阴性对照)[23, 24];(2)在建立试验方案初期,要求CAR-T细胞制造方提供阳性对照和阴性对照,尤其是CAR阳性细胞的表达强度不能达到中等和/或强表达的时候,或者与对照相比染色背景显著提高时;(3)尽可能选择PE、APC这种亮度较高、受温度光照影响较小的单纯荧光素,并且同一研究尽量避免更换荧光素;(4)尽量采用荧光素减一(fluorescence minus one,FMO)的方案排除补偿影响;(5)进行抗体的批间检测:更换抗体批号时,应该对新旧批号抗体进行MdFI或者平均荧光强度对比,建议新旧批号抗体配对比较不少于5组,变异系数控制在25%以内[24, 25]。
共识7:从生产到临床治疗过程中,最好使用相同的试剂、荧光素、对照以及相似的方案,对于结果判读也应事先沟通和培训,尽可能采取一致性原则,对于少数有疑问的病例,应共同讨论研究。推荐强度:强烈建议。
共识8:CAR表达细胞属于未知抗原检测,建议使用合适的阴性对照,并在建立试验方案初期,使用阳性对照;尽可能选择PE、APC荧光素,并且同一研究尽量避免更换荧光素;尽量采用FMO的方案排除补偿影响;建议进行抗体批间检测。推荐强度:建议执行。
(二)检测时间点
多项临床试验数据显示,体内CAR-T细胞增殖与疗效显著相关[1,13,18, 19],因此,检测体内CAR-T细胞增殖情况是评估疗效的重要指标之一;并且还能辅助诊断治疗后早期多种急性毒副作用[8,26, 27]。因此规律性检测CAR-T细胞很重要。
检测时间点与CAR-T细胞治疗方案有关,每个研究大同小异,主要包括:CAR-T细胞制备后回输前的质量检测,CAR-T细胞回输后体内追踪(不同研究时间点有差异,例如4、7、14、28 d,2、3、6个月)。鉴于FCM检测CAR-T细胞的灵敏度为10-3(目的细胞数/单个核细胞数),在连续2次检测不到CAR表达细胞后可以停止检测。有的患者可能随访两年分子遗传学方法依旧能够检测到[23, 24,28]。
(三)方案设计与获取细胞数
FCM(尤其是3激光8色及以上的MFC)检测CAR表达细胞,虽然灵敏度可能低于分子遗传学技术[28],但是优势很大:(1)快速简便低成本;(2)多色和设门技术可以清楚标记出CAR表达细胞亚群,如CD4、CD8以及记忆T细胞的表型,并能进行绝对计数;(3)可以发现混杂的MRD细胞;(4)能够检测到表达CAR的B细胞以及通过对回输物中其他细胞的评价进行质量检测[9,15]。缺点是缺乏标准化,尤其是对于CAR表达细胞的检测,因此需要专家共识加强标准化进程。
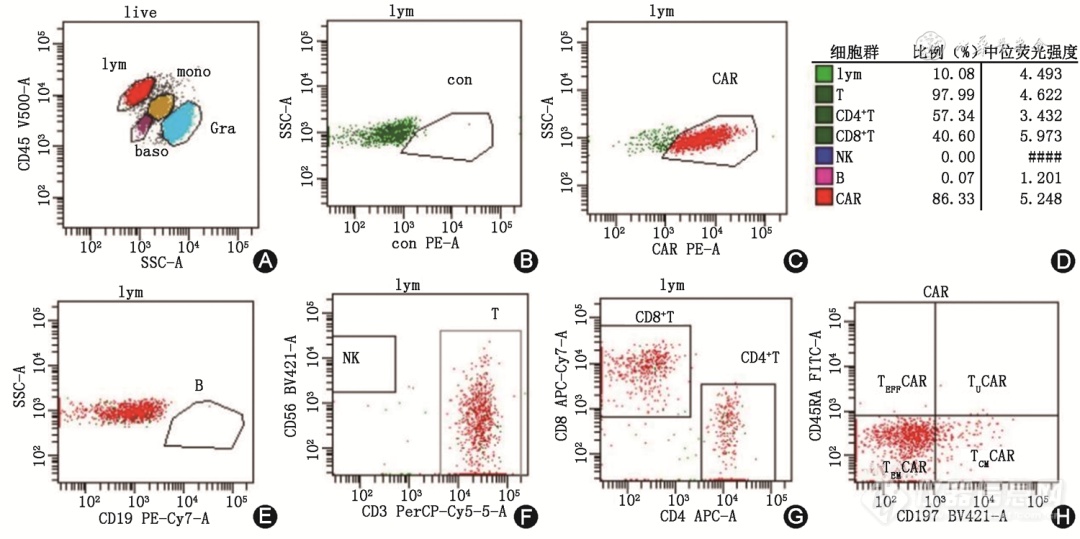
方案设计包括抗体与荧光素的配对(最基本的原则是识别抗原表达强度低、比例低或者未知细胞表达的抗体,尽量选择PE、APC等亮度较高的荧光素),而CAR表达细胞比例和绝对数决定了方案的复杂程度。设计目标需要明确区分表达CAR的T细胞基本组成与可能表达CAR的其他细胞,低比例或者低细胞数的时候尤其需要排除非特异性染色[2,4,6,9,23, 24]。实际工作中,虽然可能受到条件限制,但是最简单方案应包括CAR检测抗体、CD3、CD8(或者CD4)、靶点(例如CD19-CAR-T细胞选择CD19,CD7-CAR-T细胞选择CD7)。相对优化的方案建议包括:CAR检测抗体、CD3、CD4、CD8、CD14、CD19(CD7-CAR-T细胞增加CD7)、CD56、CD45(表2),用以区分T、B、NK和单核细胞。回输物检测和回输后CAR-T细胞增殖高峰时,因为细胞量相对较大,以及CAR表达细胞比例相对较高,可以做比较全面的检测,即同时加CD45RA和CD197(图1),可选择CD95、CD45RO、CD62L、CD27 等用以区分CAR-T细胞的功能性亚群。最新研究表明,CAR-T细胞治疗疗效与T细胞成分(CD4、CD8)、功能(初始、记忆、效应)、活化(表达活化标志)和其他状态有关,利用FCM测定亚群有助于鉴定细胞产品的潜能[29, 30, 31, 32]。
图1流式细胞术检测经CD19-嵌合抗原受体(CAR)-T细胞免疫治疗7 d后B细胞急性淋巴细胞白血病患者外周血CAR-T细胞[A为活细胞门(live)内所有细胞群;B为淋巴细胞(lym)同型对照(con)表达图;C为淋巴细胞(lym)CAR表达图;D为检测管各群细胞占比及中位表达强度;E为淋巴细胞门内B细胞(B)占比;F为淋巴细胞门内NK和T细胞占比;G为淋巴细胞门内CD4+T细胞和CD8+T细胞占比;H为CAR阳性细胞中TN、TEM、TCM、TEFF细胞占比;TN为初始 T 细胞,TCM为中心记忆性T细胞,TEM为效应记忆性T细胞,TEFF效应性T细胞;CAR表达细胞占淋巴细胞比例为86.33%,主要为CD3+T细胞,57.34%为CD4+T细胞,40.60%为CD8+T细胞。未见明显B细胞和自然杀伤细胞成分(<0.1%);图片上方显示逻辑设门]
此外,来自自体成分的CAR-T细胞,虽然大多数肿瘤细胞会在体外培养过程中死亡,但是极少数病例的肿瘤细胞依旧存活,甚至脱靶存活。因此在体外培养后回输之前,如果发现可疑细胞(例如CD19-CAR-T细胞出现CD19+细胞,或者CD19-/CD45dim的原始细胞),应进行严格的MRD检测[2,9],方案同CAR-T细胞免疫治疗后MRD检测(表2)。
CAR-T细胞回输前质量鉴定时,可以采用单平台或者双平台方法进行CAR-T细胞的绝对计数,质量控制参考CD34+造血干细胞计数[25],获取细胞数最好20万以上。而回输后检测患者标本时,尤其是在大多数时间点可能因为CAR表达细胞频度极低,建议参考MRD检测要求,最好获取100万细胞,即便处于细胞减少阶段,也建议最低获取10万细胞[9,24]。
共识9:方案设计的目标为:明确区分表达CAR的细胞组成,以及其他细胞残留情况,尤其是MRD细胞。最低检测方案应包括CAR检测抗体、CD3、CD8(或者CD4)、靶点(例如CD19-CAR-T细胞选择CD19,CD7-CAR-T细胞选择CD7),相对优化的方案建议包括:CAR检测抗体、CD3、CD4、CD8、CD14、CD19(CD7-CAR-T细胞增加CD7)、CD56、CD45。如果细胞比例和计数允许,最好进行CAR-T细胞功能性亚群的组成检测。推荐强度:建议执行。
共识10:来自自体成分的CAR-T细胞,在体外培养后回输之前,如果发现可疑细胞(例如CD19-CAR-T细胞出现CD19+细胞,或者CD19-原始细胞),应进行严格的MRD检测,方案同CAR-T细胞免疫治疗后MRD检测(表2)。推荐强度:强烈建议。
共识11:CAR-T细胞回输前质量鉴定时,可以采用单平台或者双平台方法进行CAR-T细胞的绝对计数,获取细胞数最好20万以上;回输后检测患者标本时,最好获取100万细胞,至少获取10万细胞。推荐强度:强烈建议。
二、常规免疫功能检测
CAR-T细胞治疗后期随访中,随着CAR表达细胞比例降低到FCM检测阈值以下,或者桥接移植后,绝大多数时间点随访的是常规临床免疫功能检测,如淋巴细胞、粒细胞、单核细胞占有核细胞比例,T细胞、B细胞、NK细胞占淋巴细胞比例和绝对数,T细胞亚群中CD4和CD8占比,以及调节性T细胞(regulatory T cell,Treg)的检测。部分实验室会在此基础上增加CD28、CD45RA(和/或CD45RO)、CD197(和/或CD62L)、CD95、CD122等进一步区分功能性亚群,如初始T细胞(naive T cell,TN)、中心记忆性T细胞(central memory T cells,TCM)、效应记忆性T细胞(effector memory T cells,TEM)、效应性T细胞(effector T cells,TEFF)[29, 30, 31, 32],甚至有的研究包括干细胞记忆样T细胞(stem cell memory-like T cells,TSCM),因为发现TN、TSCM和TCM表型与更长的体内持久性和更高的抗肿瘤疗效相关[33]。有的研究增加CD38、HLA-DR(可选择CD25、CD69等)检测活化信号,CD183(CXCR3)、CD196(CCR6)检测辅助性T细胞(T helper,Th)亚群等。不同实验室可能采用不同的指标来定义各功能性亚群,注意参加同一个多中心研究的各实验室需采用相同的定义;此外,注意冻存细胞的CD197和CD62L表达可能会减弱或者丢失[29, 30, 31, 32]。
临床基本的淋巴细胞亚群是基于CD3、CD4、CD8、CD16+CD56、CD45、CD19的T、B、NK比例和绝对计数检测[34],CAR-T细胞治疗涉及的常规免疫功能检测目前尚无规范化要求,建议包括Treg、TN、TCM、TEM和TEFF的检测,最好包括TSCM。推荐方案见表2。CAR-T细胞治疗后免疫功能改变因为不同研究差异很大,CD19-CAR-T细胞治疗弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)的研究[34]发现2年后依旧有29%的缓解患者CD4+淋巴细胞计数低于200/μl,因此建议部分患者需要长期随访。
共识12:CAR-T细胞免疫治疗后期随访中,绝大多数时间点随访的是常规临床免疫功能检测。至少包括如淋巴细胞、粒细胞、单核细胞占有核细胞比例,T细胞、B细胞、NK细胞占淋巴细胞比例和绝对数,T细胞亚群中CD4和CD8占比,建议包括Treg、TN、TCM、TEM和TEFF的检测。推荐方案见表2。推荐强度:建议执行。
三、可选择性的免疫相关检测
(一)免疫检查点和免疫抑制微环境检测
CAR-T细胞治疗最大的问题就是耐药和复发[1, 2, 3, 4, 5, 6, 7],涉及多种复杂机制,其中免疫抑制信号和免疫微环境的研究是近年来关注重点[11, 12, 13,15]:(1)T细胞耗竭,效应细胞降低,抑制性受体表达增加。外周血中靶点表达细胞恢复是CAR-T细胞功能减弱的一个信号,CAR-T细胞耗竭是其中因素之一,有研究中将CD279[程序性细胞死亡蛋白1(programmed cell death protein 1,PD1)]、CD223(淋巴细胞活化基因3)、CD152(细胞毒性T淋巴细胞抗原4)、CD366(T细胞免疫球蛋白和黏蛋白域蛋白-3)等耗竭相关信号纳入CAR-T细胞检测方案,希望找到相关性,从而通过PD1单抗等靶向药物解除抑制信号,获得长期缓解。(2)免疫老化,年龄相关T细胞质量。随着免疫年龄和免疫老化学说的提出,以及研究发现年龄相关CAR-T细胞表型,研究中也开始将免疫老化相关信息标志纳入。(3)其他拮抗CAR-T细胞功能的信号研究。CD19阴性复发时肿瘤细胞可能会高表达CD123,使用CD123-CAR-T细胞治疗可能有效;可能与抗凋亡信号B细胞淋巴瘤2(B cell lymphoma-2,bcl-2)表达增强有关,监测肿瘤细胞bcl-2,高表达患者使用bcl-2拮抗剂治疗也许有效。(4)抑制性骨髓微环境,髓系来源抑制性细胞(myeloid-derived suppressor cells,MDSC)、肿瘤相关巨噬细胞、Treg抑制了CAR-T细胞增殖与功能,通过FCM检测这些抑制性骨髓微环境,可以有助于CAR-T细胞治疗机制研究。
共识13:CAR-T细胞免疫治疗后复发机制复杂,通过FCM方法进行T细胞耗竭、免疫老化、拮抗信号、抑制性免疫微环境的检测,可能有助于机制研究和探索进一步治疗。方案见表2。推荐强度:仅供参考。
(二)细胞因子相关检测
由于CAR-T细胞工艺和细胞来源不同,可能会产生不同的细胞因子,如外周血总CD3+T细胞来源的CAR-T细胞可能会导致多种细胞因子生成,CD4+T细胞相关因子有:IL-2、IL-4、IL-5、IL-10、IL-13、IL-17,而分选CD8+T细胞来源的CAR-T细胞主要生成IFN-γ、TNF-α、穿孔素和颗粒酶B。
CAR-T细胞治疗的有效性和毒性相辅相成,最常见的毒副作用是CRS和免疫效应细胞相关神经毒性综合征。CRS由活化免疫细胞释放大量炎症因子引发,因此细胞因子检测与CAR-T细胞治疗疗效和副作用评估均有关,等级≥3的CRS与多功能性T细胞相关[26, 27]。每项CAR-T细胞治疗研究都会使用细胞因子来评价T细胞活化特性,基本包括IL-6、IFN-γ、TNF-α、IL-2。对于其他因子的选择不同研究存在差异,包括:IL-1RA、IL-1β、IL-4、IL-5、IL-8、IL-10、IL-12、IL-13、IL-15、IL-17、IL-18、IL-21、IL-23、IL-31、IL-36、单核细胞趋化蛋白-1、穿孔素和颗粒酶B、促红细胞生成素、粒细胞巨噬细胞集落刺激因子、可溶性CD25、铁蛋白等。
虽然最初大多数研究使用酶联免疫吸附法(enzyme linked immune sorbent assay,ELISA)方法检测细胞因子,但近年来随着研究的深入,对更多细胞因子检测提出高通量要求。FCM的微球阵列技术(cytometric bead array,CBA)可同时测定多种细胞因子含量,相比于 ELISA,CBA标本需求量少(可实现CSF等微量标本检测)、快速、简便、多指标检测、灵敏度高、重复性好、灵活性大[35]。CSF标本的采集、运输与标本制备参见2021年相关共识[36]。
共识14:CAR-T细胞免疫治疗后进行细胞因子检测,对于评价CRS等副作用有重要的辅助诊断价值,对于预测CAR-T细胞免疫治疗疗效有辅助参考价值。最低应该检测IL-6、IFN-γ、TNF-α、IL-2,其他因子酌情选择。推荐强度:建议执行。
CAR-T细胞免疫治疗是近年来肿瘤治疗领域最大的突破,目前虽然遇到一些难题,但是随着技术的进步,可以预见在将来相当长的时间里这种技术会不断完善,成为经典的化疗和造血干细胞移植以外的重要补充治疗。FCM对于进一步发挥CAR-T细胞在肿瘤治疗中的作用,制定和改善方案,鉴定CAR-T细胞成分确保安全性,监测MRD评价疗效,监测免疫指标评价副作用,都起到举足轻重的作用。为了规范化FCM方案设计与操作分析,更好地促进其应用,本学会组织专家讨论达成此共识,希望能为同行和相关检验人员及临床医生提供参考。
执笔人:
王卉(河北燕达陆道培医院检验科),刘贵建(中国中医科学院广安门医院检验科)
专家组成员(按姓名字母顺序排列):
艾利莎(华中科技大学同济医学院附属协和医院血液科),蔡英(美国BD公司),曹永彤(中日友好医院检验科),常英军(北京大学人民医院、北京大学血液病研究所),陈曼(河北燕达陆道培医院检验科),池沛冬(中山大学附属肿瘤医院检验科),丁丽(解放军空军特色医学中心血液科),段彦龙(国家儿童医学中心,首都医科大学附属北京儿童医院,儿童肿瘤中心,肿瘤内科),樊华(中国医科大学附属第四医院血液科),冯晨(解放军总医院儿科),高广勋(空军军医大学第一附属医院血液内科),韩露(南京北恒生物科技有限公司),韩为东(解放军总医院生物治疗科),洪国粦(厦门大学附属第一医院检验科),李力(南部战区总医院血液科),李壹(四川大学华西医院实验医学科),李永伟(河南省中医院,河南中医药大学第二附属医院检验科),李智伟(新疆维吾尔自治区人民医院临床检验中心),林欣(清华大学医学院基础医学系),刘贵建(中国中医科学院广安门医院检验科),刘敏(山东第一医科大学附属肿瘤医院检验科),刘耀(重庆大学附属肿瘤医院血液肿瘤中心),陆佩华(河北燕达陆道培医院院长),马莉(贵州医科大学附属医院临床检验中心),毛霞(华中科技大学同济医学院附属同济医院血液科),欧阳涓(中山大学附属第一医院检验科),钱文斌(浙江医科大学附属第二医院血液内科),全丽娜(哈尔滨医科大学附属肿瘤医院血液科),芮魏[华夏英泰(北京)生物技术有限公司],桑威(徐州医科大学附属医院血液科),孙慧(山东第一医科大学附属省立医院临床医学检验部),孙士鹏(中国中医科学院广安门医院检验科),唐古生(海军军医大学第一附属医院血液病科),唐湘凤(解放军总医院儿科医学部儿童血液肿瘤科),唐晓文(苏州大学附属第一医院江苏省血液研究所),王爱先(河北燕达陆道培医院检验科),王卉(河北燕达陆道培医院检验科),王慧君(中国医学科学院血液病医院血液病理诊断中心),王亮(首都医科大学附属北京同仁医院血液科),王茫桔(北京大学第一医院血液科),王平(陆军军医大学新桥医院血液科)、王巍(哈尔滨医科大学附属第二医院血液科),王瑶(解放军总医院生物治疗科),吴青青(贵州医科大学附属医院临床检验中心),吴雨洁(南京医科大学第一附属医院血液科),肖剑文(重庆医科大学附属儿童医院血液科),谢小兵(湖南省中医院附属第一医院检验科),徐翀(上海市临检中心)、杨曦明(中国中医药大学东直门医院检验科),杨再林(重庆大学附属肿瘤医院血液肿瘤中心),岳保红(郑州大学第一附属医院检验科),詹茜(重庆医科大学附属第一医院临床分子医学检测中心),张爱梅(中国科学技术大学附属第一医院安徽省立医院检验科),张国军(首都医科大学附属北京天坛医院检验科),张继红(中国医科大学附属盛京医院血液研究室),张曦(陆军军医大学新桥医院血液科),张弦(河北燕达陆道培医院血液科),钟晓松(北京世纪坛医院临床基因与细胞工程中心),周剑峰(华中科技大学同济医学院附属同济医院血液科),周茂华(广东省人民医院检验科,广东省医学科学院),朱杰(大连医科大学附属第二医院检验科),朱莉(华中科技大学同济医学院附属同济医院血液科),朱明清(苏州大学附属第一医院江苏省血液研究所)
参考文献(略)
来源于:中华检验医学杂志
热门评论
最新资讯
新闻专题
更多推荐