基于数字微流控技术的上呼吸道易感病毒多靶标快速检测方法
进入 #微流控技术进展阅读更多话题内容
导读:近期,拱北海关技术中心等科研机构于《热带医学杂志》发表研究性论文,将RT-qPCR技术和数字微流控技术相结合,建立一种基于数字微流控RT-qPCR芯片技术的上呼吸道易感病毒多靶标快速检测方法。
呼吸道病毒感染由于其高致病率及致死率,成为世界各国人民发病和死亡的主要原因之一。引起上呼吸道感染的病毒种类较多,尤其是甲型流感病毒新型H5N1(FluA-H5N1)、甲型流感病毒新型H1N1(FluA-H1N1)、乙型流感病毒(FluB)、冠状病毒(SARS-CoV)、中东呼吸综合征冠状病毒(MERS-CoV)、新型冠状病毒(2019-nCOV)等病毒在近一个世纪以来的多次大规模流行,给人类的生命健康和社会经济带来巨大伤害。这些上呼吸道感染的病毒引起的感染症状和季节性流行病毒特点相似,为避免造成群聚传染,快速鉴别呼吸道病原体的检测显得尤为重要。
据麦姆斯咨询报道,近期,拱北海关技术中心等科研机构于《热带医学杂志》发表研究性论文,将RT-qPCR技术和数字微流控技术相结合,建立一种基于数字微流控RT-qPCR芯片技术的上呼吸道易感病毒多靶标快速检测方法。实现一种以少量样品同时快速检测多个呼吸道病原体的检测技术。该方法满足了目前市场对呼吸道病原体的高诊断率的需求,同时还为精准医疗提供了新的检验手段。
为实现一个芯片多个项目的检测功能,研究人员将6个引物(2019-nCOV-N引物、2019-nCOV-Orf1引物、FluA-M1引物、FluB-HA引物、SARS-65引物、MERS-62引物)和相应探针分别预存到芯片的各个反应点中,并向反应点添加引物预存液,而后将芯片置于风干干燥箱中干燥,接着将干燥好的芯片取出进行封装处理。
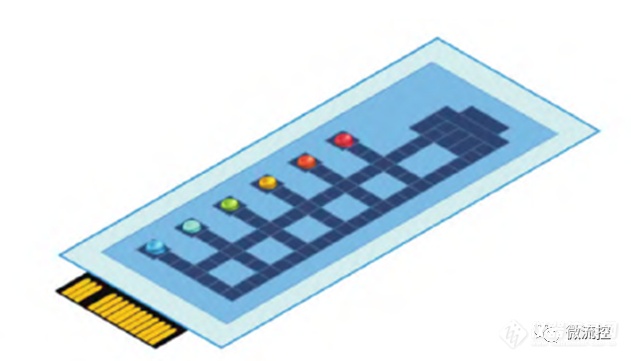
图1 数字微流控芯片结构示意图:芯片设置6个反应点,从左往右依次是预存的2019-nCOV-N引物、2019-nCOV-Orf1引物、FluA-M1引物、FluB-HA引物、SARS-65引物和MERS-62引物
为了验证该数字微流控RT-qPCR芯片的检测性能,研究人员使用TE缓冲液将阳性质粒10倍稀释为10 pg/μL至0.01 fg/μL的浓度梯度,并根据RT-qPCR反应体系和反应程序,完成各单项目的引物、探针在AGS4800实时荧光定量PCR仪上的检测下限检测。同样,对相应浓度的质粒使用数字微流控芯片完成实时荧光RT-qPCR反应。如图2所示,6种引物在AGS4800实时荧光定量PCR仪上均可检出对应的阳性质粒,对于10 pg/μL的质粒均可在20个循环之前检出,且45个循环内无非特异性扩增。
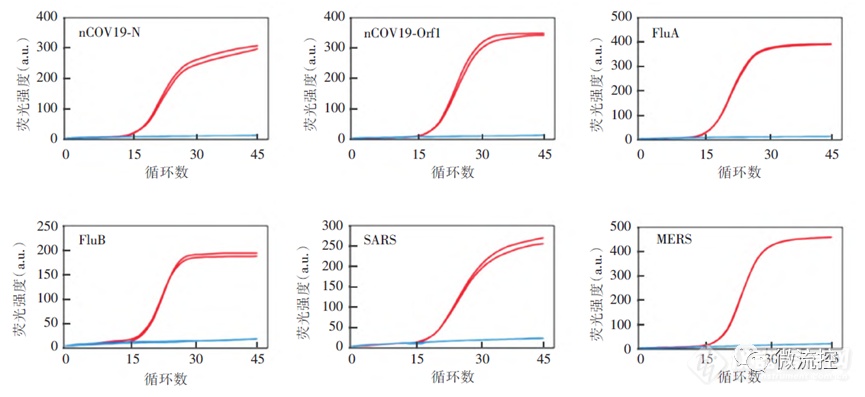
图2 检测试剂测试结果
此外,FluA、FluB、SARS-CoV、MERS-CoV、2019-nCOV这5个检测项目使用PCR仪的25 μL体系最低可检出0.01 fg/μL的质粒,而数字微流控RT-qPCR芯片法每个反应最低可检出0.1 fg/μL的质粒,与PCR仪2 μL体系灵敏度相同。根据公式,质粒拷贝数浓度 =(质粒浓度×摩尔系数)/(质粒长度×碱基对平均分子量),分别计算2种方法中的每个反应的质粒拷贝数可得知,上述2种方法在2~25μL的体系下检出限均为12~15拷贝/反应,检测下限基本一致(图3)。
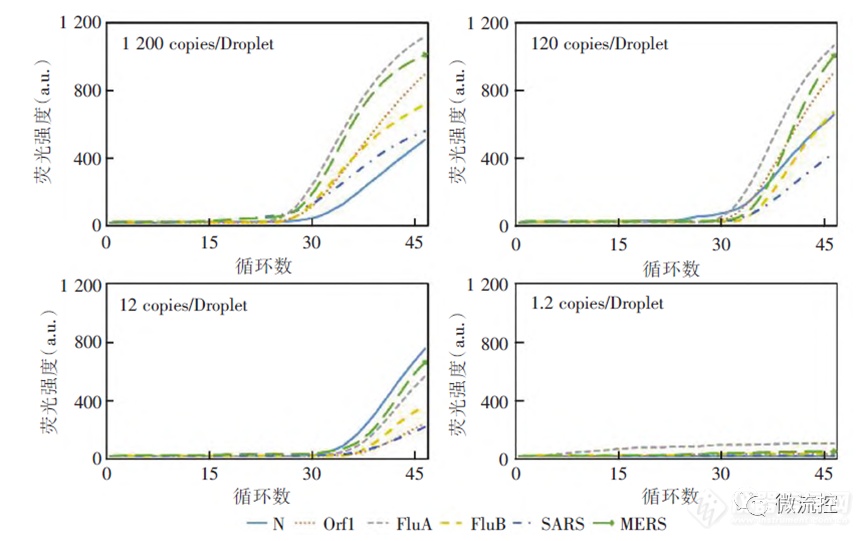
图3 数字微流控RT-qPCR芯片的检测下限测试结果
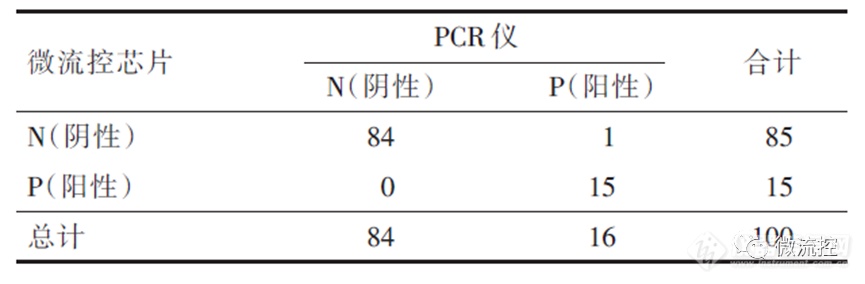
最后,为明确该数字微流控RT-qPCR芯片的检测灵敏度和特异性,研究人员同时使用数字微流控RT-qPCR芯片和RT-qPCR仪检测20个临床标本(包含新冠病毒2例,甲型流感8例,乙型流感6例)的5项呼吸道病毒项目,共计100个测试反应,见表1。结果显示微流控芯片除样品7出现一次对甲型流感病毒漏检外,其余阳性样品均检出对应病毒,对于20个样品的5种病毒的总灵敏度为94%,总特异性为100%。Kappa值 = 0.962,两个检测方法具有高度一致,并且差异有统计学意义(P < 0.05)。
表1 PCR仪和微流控芯片检测临床样本结果汇总
综上所述,该研究将多个RT-qPCR检测项目与数字微流控检测芯片结合,建立了在一次反应中同时检测多个项目的数字微流控RT-qPCR芯片。该数字微流控芯片RT-qPCR法可以以最少的样本量快速检测多个项目,自动化程度更高,可以提高上呼吸道病毒检测的效率,提高应对大规模疫情的快速反应能力。
论文链接:
http://www.rdyz.cbpt.cnki.net/WKD/WebPublication/paperDigest.aspx?paperID=2d5c44d8-8305-4cbb-9dca-0c8aba6fc75d
来源于:微流控 麦姆斯咨询
热门评论
最新资讯
新闻专题
更多推荐















