Nature Microbiology | 体液细胞外囊泡阻断病毒感染
进入 #胞外囊泡/外泌体EVs研究阅读更多话题内容
致病性病毒往往借助血液、唾液致和精液等体液实现其传播。在有效传播途径中,病毒首先需要入侵人体体液环境、逃避机体的免疫防御,进而识别靶细胞上的受体、进入细胞、完成复制。在凋亡模拟病毒模型中,病毒通过将磷脂酰丝氨酸(phosphatidylserine, PS)暴露在病毒粒子上,劫持细胞表面的PS受体并触发内吞作用,从而进入细胞。马尔堡-菲利普大学的研究人员在之前的研究中发现精液和唾液中的细胞外囊泡(EVs)可竞争性地阻断寨卡病毒(Zika Virus, ZIKV)与靶细胞的结合,从而抑制其在体内和体外的感染。
近期,该团队在Nature Microbiology上发表了题为“Phosphatidylserine-exposing extracellular vesicles in body fluids are an innate defence against apoptotic mimicry viral pathogens”的研究论文,发现唾液和精液等体液中大量暴露PS的EVs可防止凋亡模拟病毒的附着从而阻断病毒感染。总的来说,该研究揭示了一种机体直接的先天防御机制,它可以抑制病毒凋亡模仿,并可能阻断病毒的传播途径。

01 ZIKV荚膜中暴露的PS对感染至关重要
作者首先对PS暴露是否对ZIKV感染至关重要这一问题进行了探究。在脱羧基酶的处理之下,PS末端的羧基被脱去,而转变为PE分子(图1a)。结果显示,PS脱羧后导致ZIKV传染性急剧降低甚至丧失(图1b),但没有显示细胞毒性。作者进一步合成了以PC为基底而含有不同PS浓度(0–100 mol%)的脂质体,并发现仅含有PC的脂质体对寨卡病毒感染没有影响,但所有PS暴露的脂质体都表现出剂量依赖性的抑制作用。这些发现支持了ZIKV依赖于细胞凋亡模拟进行有效感染的观点,并揭示了低比例的囊泡PS足以干扰病毒感染。
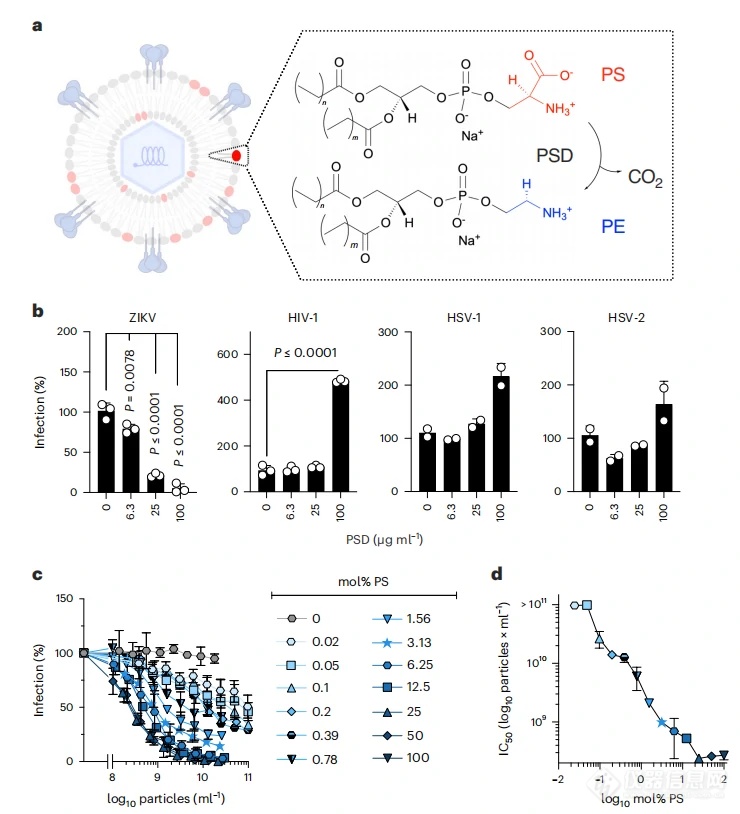
图1.ZIKA病毒的PS对感染的重要性
02 含有PS的EVs干扰病毒粒子的细胞识别
如图2所示,在进一步的感染机制探究中,作者发现在ZIKV侵染之前或者侵染过程中,含有PS的脂质体可以有效抑制病毒的感染,但随着病毒量的增加,这一抑制效果逐渐降低,这表明含有PS脂质体与病毒粒子竞争细胞结合位点。而PS的各组成成分对于病毒的感染并无影响,表明囊泡形式的PS才会表现出抗病毒活性;且其他脂质分子的抑制能力明显降低。共聚焦显微镜成像也确认了荧光PS脂质体以剂量依赖的方式附着在Vero E6细胞表面而减少结合的寨卡病毒粒子的数量,但PC脂质体没有观察到该现象。因此,暴露PS的囊泡通过竞争性地干扰病毒粒子与细胞结合来抑制病毒凋亡模拟感染。
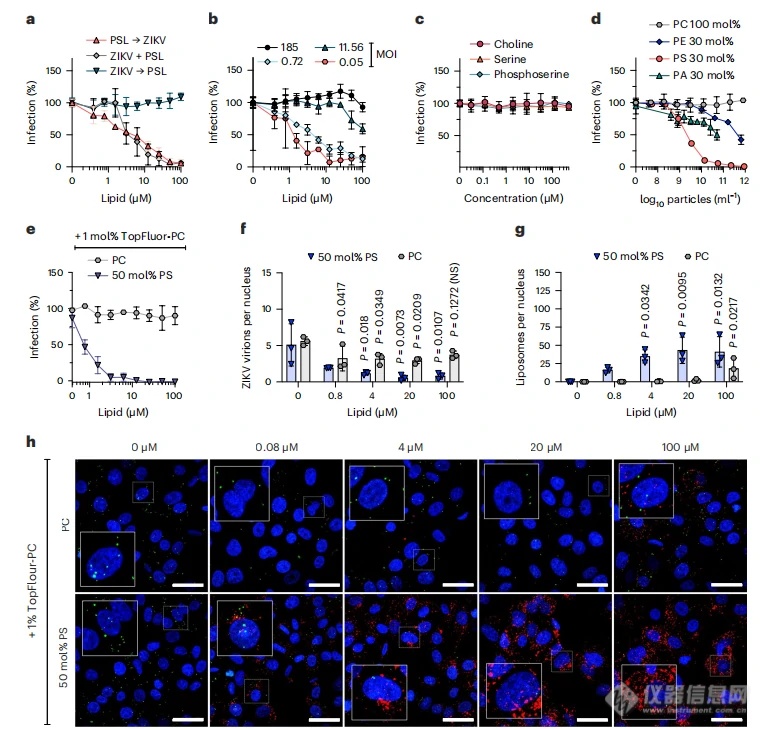
图2.囊泡颗粒表面PS对病毒附着的干扰
03 体液来源EVs的PS暴露程度不一
为了进一步确认内源性EVs是否也是通过PS暴露从而对病毒的凋亡模拟感染造成干扰,作者分别从五种不同的人体体液(精液、唾沫、尿液、母乳和血液)中分离得到EVs,并基于脂质组学和液相芯片的方法鉴定发现这些来源的EVs均有不同程度的PS暴露,且在精液、唾液和尿液中比例较高(图3)。
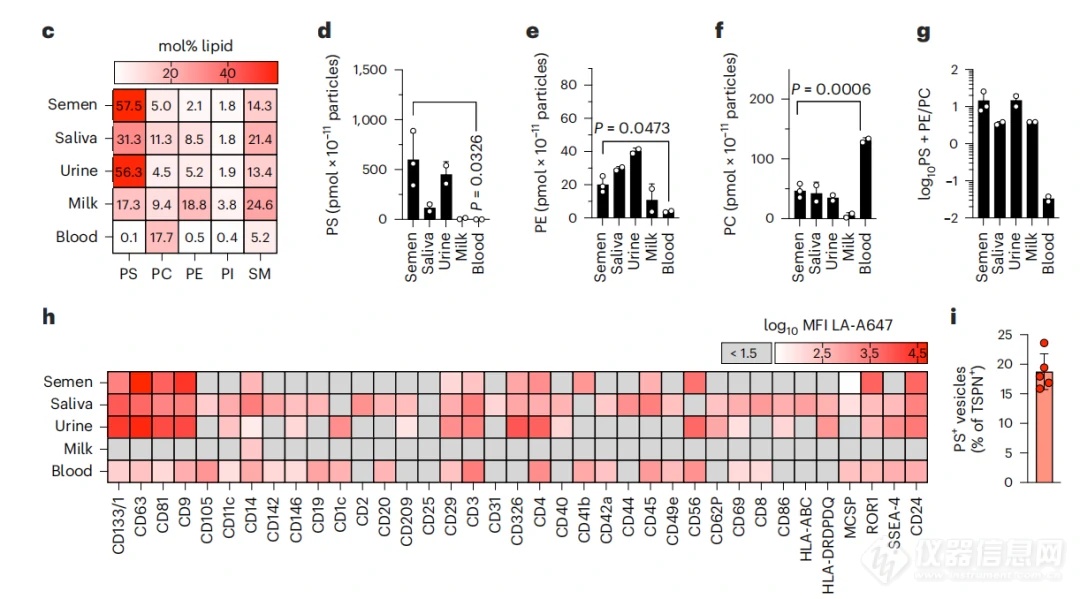
图3. 不同体液来源的EV蛋白表达水平分析
作者进一步采用纳米流式检测技术(NanoFCM)在单颗粒水平对精液来源EVs的PS和经典标志蛋白(TSPN: CD9/CD63/CD81)的表达情况进行分析。图4所示,对5份不同供体来源精液EVs的PS和四次跨膜蛋白(TSPN,含CD9/CD63/CD81)进行共定位分析,TSPN阳性群体占比约为35%-45%,单PS阳性的群体占比约为8%-11%左右,而TSPN和PS双阳比例占比约为6%-10%不等,而与PS共定位的TSPN(CD9/CD63/CD81)EVs的比例仅为18.5%左右(图3i),即膜表面暴露PS的EVs并非均有TSPN标志蛋白的共表达。总之,本研究发现从所有测试体液中分离得到的EVs均含有暴露PS的EV亚群,在精液、唾液和尿液中含量高,在母乳和血液中含量低。
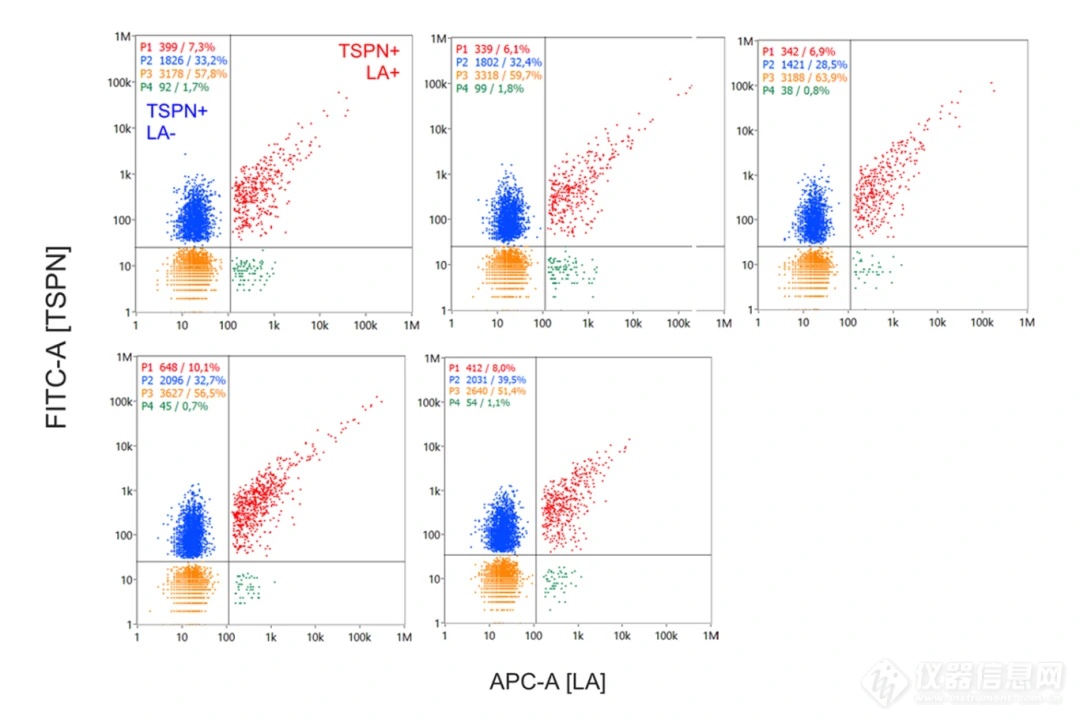
图4. NanoFCM对五份精液来源的EVs的TSPAN(CD9/CD63/CD81)和PS(LA)共定位分析
在明确了EVs中PS的表达情况后,作者也评估和分析了体液来源EVs与病毒入侵中PS受体的相互作用和EVs表面PS存在对抑制病毒感染的能力,发现EVs可通过其自身暴露的PS与利用凋亡模拟的病毒形成竞争,干扰病毒感染。在拓展了病毒类型后,作者发现不仅仅是ZIKV,像登革热病毒(DENV)、西尼罗河病毒(MNV)、基孔肯雅病毒(CHIKV)、埃博拉病毒(EBOV)和疱疹性口腔炎病毒(VSV)等的感染均会受到体液中暴露PS的EVs的抑制(图5a)。而艾滋病病毒(HIV)、丙肝病毒(HCV)、新冠病毒(SARS-CoV-2)和疱疹病毒(HSV)由于利用别的入侵受体,其感染并未受到抑制(图5b)。总的来说,体液中EVs的具有广谱的抗病毒活性,且对凋亡模拟病毒具有特异性。
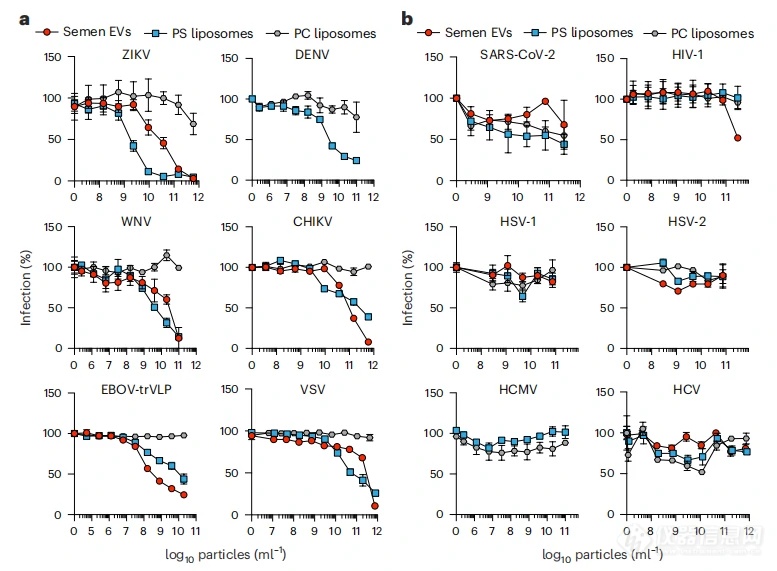
图5. EVs对不同类型病毒的感染抑制效果
在本论文中,研究者们发现了一个有趣的抗病毒防御概念——通过模仿常见的病毒入侵机制,生物物理性质上相似的EVs可以抑制病毒的附着。具体而言,体液中的EVs通过其暴露的PS分子与病毒粒子竞争性结合细胞表面受体,从而来预防和抑制病毒感染。这类EVs在唾液和精液中的含量尤其丰富,可有效抑制口腔和性传播病毒的感染,也为凋亡模拟病毒在人与人之间直接传播的低发生率提供了有效的解释和支持,同时为新型抗病毒药物的开发提供了新的思路和理论基础。
NanoFCM展望
NanoFCM作为一款检测范围在7-1000nm的多参数定量流式分析设备,未来在基于凋亡模拟病毒定向药物开发过程,不管是基于病毒PS的药物抑制效果检测,还是基于EVs的PS增强效应研究,都具备巨大的应用潜力。基于在单颗粒水平对病毒和EVs强大的分析能力,NanoFCM已被众多科研工作者广泛使用。且在病毒和EVs的分析检测方面,我们形成了完善的解决方案,在行业中处于遥遥领先的地位!欢迎联系我们申请试用。

来源于:厦门福流生物科技有限公司
热门评论
最新资讯
厂商动态
新闻专题