Hanson-脱气与非脱气介质在片剂溶出性能验证标准中的比较研究
01 溶解度测试
溶解度测试是一种用于评估在严格控制的条件下化合物溶解形成溶液的速率和量的测试方法。在美国药典(USP)药物产品专论中,这种测试有助于评估药物产品的性能,并指示何时产品性能低于标准。然而,通过测试并不能明确证明样品的生物可用性或其他产品的生物等效性;未通过测试是一个值得关注的原因。通常,对于口服药物产品,美国药典专论要求使用第 711 章《溶解度》中描述的仪器进行溶解度测试1。
美国药典仪器 1(baskets)和 2(paddles)被广泛用于对口服固体药物产品进行溶解度测试。第 711 章中的“仪器适用性”部分描述了溶解度仪器的资格认证程序和要求2。分析仪器的资格认证/校准也是食品和药物管理局(FDA)现行良好生产规范(cGMPs)以及国际标准 ISO/IEC 17025 所要求的,后者规定了测试和校准实验室能力的通用要求3,4。

图1. Vision® G2 Elite 8溶出测试仪
02 目的
本研究的目的是评估在使用脱气和非脱气溶出介质(即纯净水)时,泼尼松溶解量之间的百分比差异,采用的仪器为 II 型仪器(paddles)和美国药典 I 型仪器(baskets)美国药典 40 目。
测试程序和结果如下:
在进行溶解度测试之前,根据电磁兼容性(EMC)和美国药典(USP)溶解性能验证测试(PVT)标准-泼尼松片剂的要求,对仪器进行了资格认证。按照美国药典的指示,使用当前的片剂溶解性能验证标准,批号 F161Y0,有效期至 2024 年 11 月 14 日,进行溶解度测试。每片含有 10 毫克泼尼松。
在本研究中,按照美国药典总章<711>溶解度中描述的程序,对溶解介质进行脱气处理:“在轻轻搅拌的同时加热介质至约 41°C,立即在真空下使用孔隙率小于或等于 0.45μm 的过滤器过滤,并保持充分搅拌,继续在真空下搅拌约 5 分钟。” 使用相同的设置重复此步骤,但使用未脱气的溶解介质。在测试期间,使用了两种类型的 Apparatus II(paddles)搅拌设备:不锈钢或聚四氟乙烯(PTFE)。此外,还使用了 40 目不锈钢 Apparatus I paddles 来测试使用脱气或未脱气溶解介质的溶解情况。
使用当前批号为 R083A0 的泼尼松参考标准制备了标准溶液。使用 10 毫米石英池在岛津分光光度计 UV 1800 型号上,于 242nm 波长处同时测量样品和标准的紫外吸收。根据内部程序记录原始数据。使用美国药典提供的工具计算结果,并在表 1 中报告。
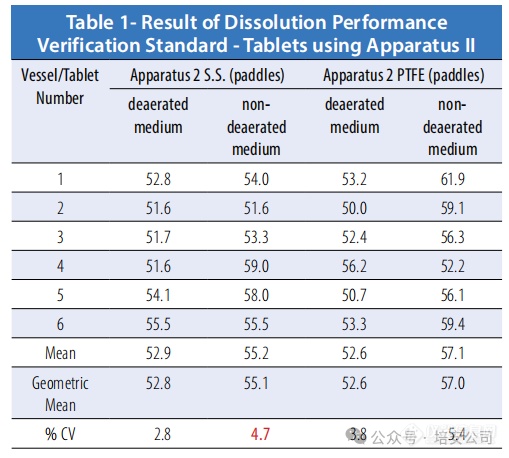
表格1. 使用 Apparatus II 的片剂溶解性能验证标准结果
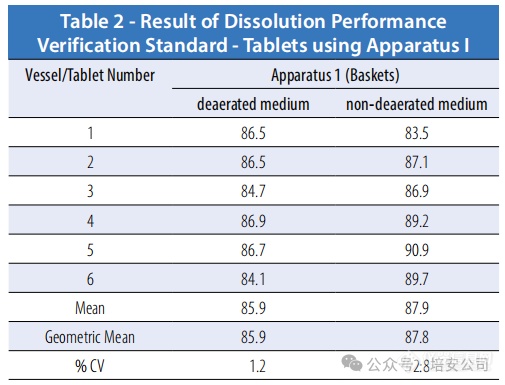
表格2. 使用 Apparatus I 的片剂溶解性能验证标准结果
* Stainless Steel Paddles
03 结论
根据上述结果,所有测试均符合接受标准,但当使用不锈钢 Paddles 在非脱气介质中进行时,CV 百分比未达标,仅略低于 0.1%,若在相同条件下重复测试,这一差异可能会朝任一方向发展。此外,在非脱气介质中的泼尼松溶解百分比也略高于脱气介质的结果。非脱气介质中的 CV 百分比似乎也更高。由于预期在采用 Apparatus 1(baskets)的测试中会有更高的释放率,因此与 Apparatus 2(paddles)的测试结果相比,这种变异似乎较小。
该研究旨在评估脱气过程对结果的影响,因此未进行额外的测试。根据上文所示的研究数据,显而易见,无论使用PTFE还是Paddle,溶解药物产品的释放量只有微小的差异。如果使用溶出性能验证标准片剂来验证溶出测试仪的性能,建议按照美国药典的建议进行脱气处理。
04 引用
1. United States Pharmacopeia, (USP)
2. United Sates Pharmacopeia, (USP) General Chapter<711>Dissolution, USP NF 2023
3. The Use of Mechanical Calibration of Dissolution Apparatus1 and 2 – Current Good Manufacturing Practice (CGMP) U.S.Department of Health and Human Service Food and DrugAdministration Center for Drug Evaluation and Research(CDER) January 2010 Current Good Manufacturing Practices(CGMP)
4. ASTM E2503-13(2020) Standard Practice for Qualification ofBasket and Paddle Dissolution Apparatus
5. Dissolution Performance Verification Standard – PrednisoneRS DEPTDOC-00276-01A
来源于:培安有限公司
热门评论
最新资讯
厂商动态
新闻专题