动物活体成像 - 荧光成像实验技巧
随着过去一个世纪以来开发出的广泛荧光工具,设计实验时获得高质量的图像可能会让人感觉无所适从。本文将从活体荧光成像的基本原理、应用领域,以及常见技术难题的解决方案,帮助研究人员更好地设计实验、获取高质量数据。
荧光成像的实验步骤
● 用荧光报告基团/荧光染料进行标记(注射入小鼠体内)。
● 小鼠经过麻醉后放入成像暗箱平台,照明灯拍摄第一次背景。
● 照明灯自动关闭,动物成像。
常用荧光染料:DIR、DID、CY5、CY5.5
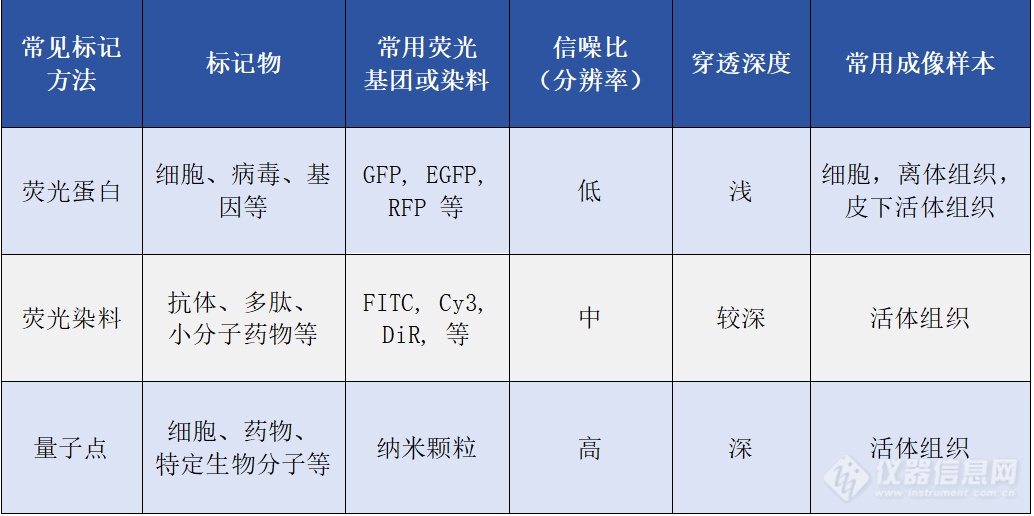
活体动物荧光成像标记的分类
荧光成像基础

1. 荧光基团(fluorophores)
荧光基团是一类能吸收特定波长的光并发出荧光的分子或分子部分。它们是荧光染料、荧光蛋白和荧光探针等荧光物质的核心组成部分。
2. 荧光染料(fluorescent dyes)
荧光染料是一类具有荧光性质的有机化合物。荧光染料通常由以下部分组成:
荧光基团:吸收光能并发出荧光的分子部分,通常具有共轭体系。
连接基团:连接荧光基团和靶分子的分子部分。
3. 荧光配体(fluorescent ligands)
荧光配体是一类与金属离子或其他分子特异性结合的分子,在结合后会产生荧光信号。荧光配体通常由以下几个部分组成:
配位基团:与金属离子或其他分子结合的官能团。
荧光基团:吸收光能并发出荧光的分子部分。
连接基团:连接配位基团和荧光基团的分子部分。
荧光成像中的挑战和解决方案
小动物活体成像仪器在生物医学研究中的应用日益广泛,对荧光样品进行成像时,有一些问题需要考虑,包括生物自发荧光、仪器性能、结果可靠性等。
1.穿透深度不足——选择合适的荧光模块/荧光标记
在生物组织内,光的传播受到散射和吸收的限制,使得深层组织结构和过程的成像变得困难。妨碍了对体内病理变化的深入研究。
荧光产生包含激发和发射两个过程,在小动物活体成像系统中具体体现为荧光光源和发射光滤光片两个关键部件。
● 荧光光源
勤翔小动物活体成像系统支持LED和激光光源,覆盖几乎所有市面上的荧光基团。
近红外 LED 光源能够更深地穿透生物组织,从而提升成像深度。它的非侵入性特点减少了对样本的影响,产生的背景干扰较少,有助于提高图像的清晰度,提供更为准确的成像结果。

激光光源的高亮度和方向性允许光穿透更深的组织,实现深层成像,获得小动物体内更深层的生物过程。激光可以针对特定的荧光团进行选择性激发,从而实现特定生物过程的成像,例如上转化成像。激光激发能够产生高对比度图像,非常适合于活体荧光激发。

● 发射光滤光片
发射滤光片允许荧光基团发射的特定波段的光通过。在荧光成像中用于精确选择和增强特定波段的信号,通过适当的透过率和截止特性,可以有效提高成像质量,减少背景干扰。

● 荧光染料
染料的亮度因其各自荧光色素的不同而变化,受激发系数和荧光量子产率的双重影响。不同染料与同一蛋白质使用时可导致背景信号的变化(Hayashi-Takanaka et al.,2014)。
FITC和DiR都是常见染料,用于标记蛋白质时,DiR的激发波长更长,能够更深地穿透组织,成像结果更好。
2. 背景荧光过高-样品准备和先进的算法校正
组织的自发荧光以及非特异性染料结合所产生的信号,会产生背景干扰。这些非特异信号会掩盖实际的荧光信号,导致结果变得模糊不清,影响实验的可靠性和准确性。
为了更好地控制背景荧光,研究人员开发了多种策略。包括选择与自发荧光波长差异较大的荧光标记物,使用数学算法进行图像处理等方法以减少影响。(Nicholas Billinton et al.,2001)
● 自发荧光
自发荧光来自于结构成分,从小分子到更大的结构。生物的自发荧光峰值位于500nm左右,主要由毛发、皮肤、肌肉、血红蛋白等引起。使用近红外光源激发小动物活体成像,可以避开这些自发荧光干扰,获得更高的信噪比的图像。
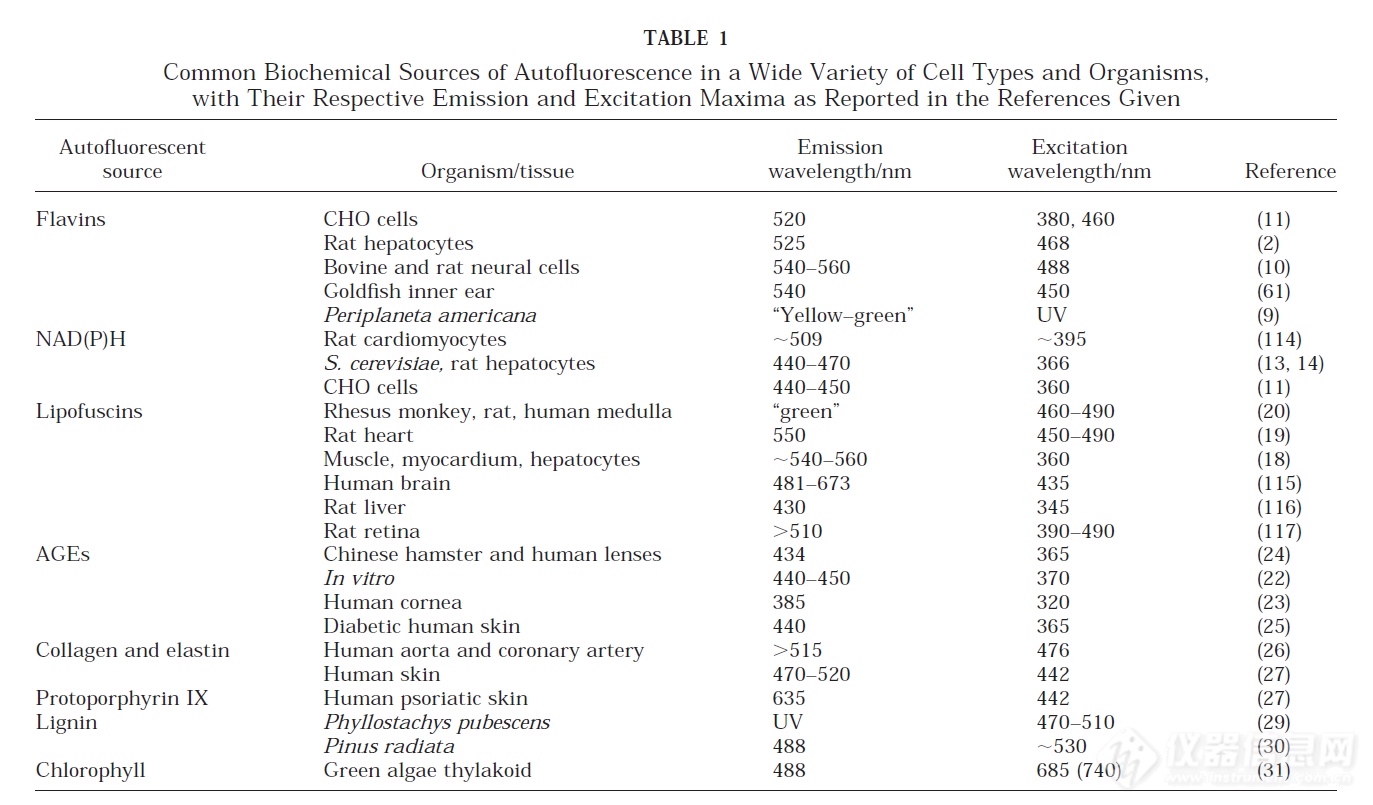
● 剔除毛发
未剃毛的C57BL/6小鼠皮下肿瘤的生物发光信号强度比植入到Albino B6或NMRI Nude小鼠上的相似肿瘤信号低。(Liesa-Marie Schreiber et al.,2019)
至少提前一天进行脱毛或剃毛,使用锋利的刀片,冲洗脱毛或剃毛区域,并用无菌纱布轻轻擦拭,去除任何残留物。
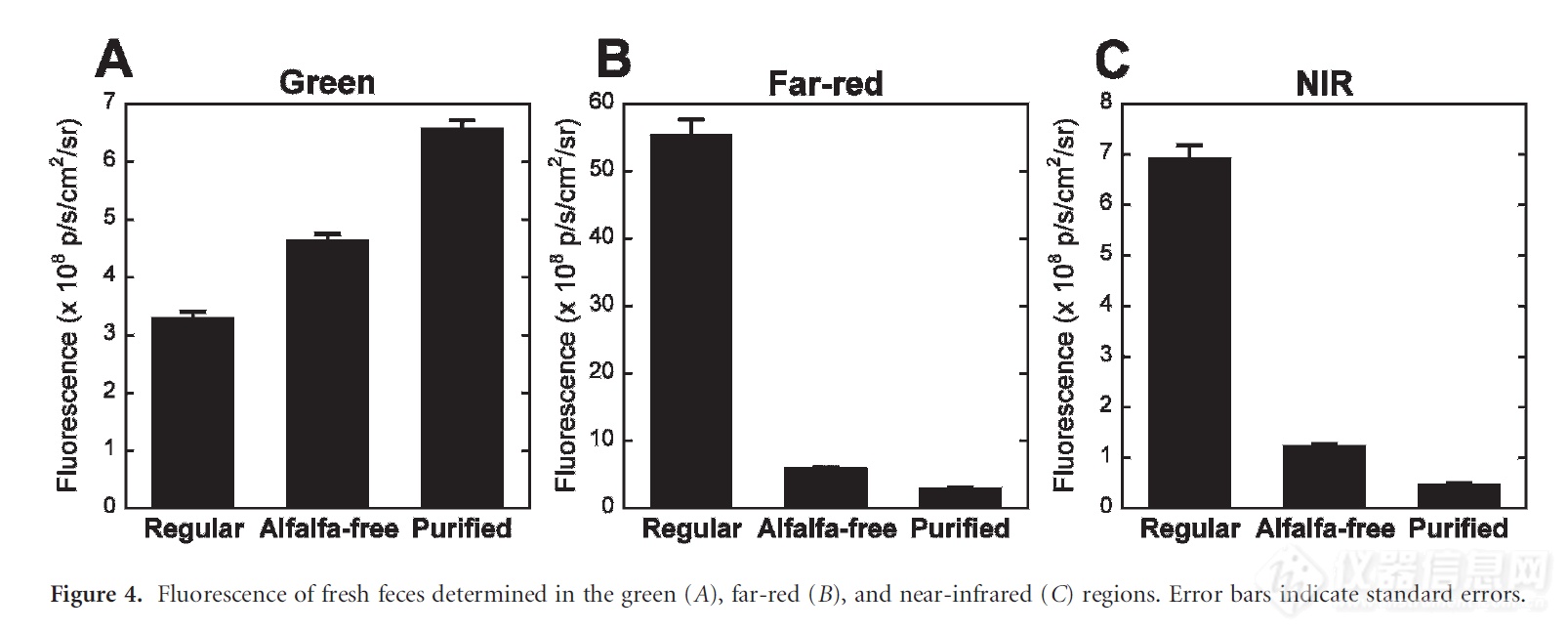
● 饲料荧光
如果需要进行消化道成像,至少提前一周使用无荧光饲料喂养动物,以避免苜蓿素的荧光干扰。(Yusuke et al., 2008)
3. 灵敏度不足——更高端的硬件
对于涉及低丰度分子或信号较弱的探针,活体成像的灵敏度常常显得不足。这使得检测目标分子信号变得极为困难,未能及时捕捉到关键的信号可能会导致研究结果的偏差。
提高成像系统灵敏度依赖于两个关键组件:镜头和感光芯片。通过优化这两个组件,勤翔小动物成像系统成功提升灵敏度,提供更可靠、更精确的活体成像工具。
● 镜头
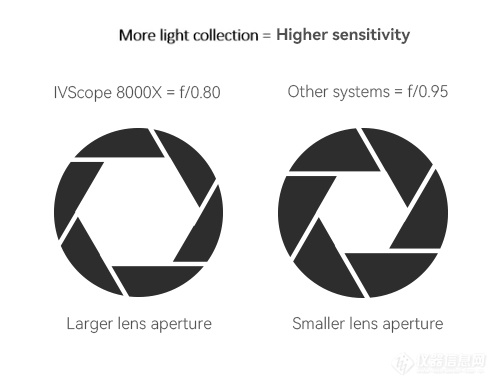
镜头光圈决定透光能力,勤翔小动物活体成像系统采用f/0.8大光圈镜头,相比常见的f/0.95镜头,透光能力提升30%,成像时间更短,获得更清晰图像。
● 感光芯片
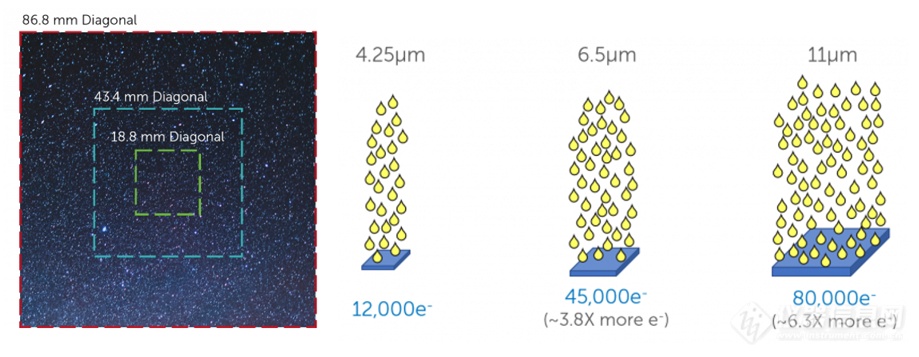
感光芯片的性能也影响灵敏度,其理想特性包括更大感光面积、像素尺寸、量子效率,以及更低的暗电流和背景噪声。这些特性协同提升信噪比,实现高质量成像。
4. 数据准确性问题——专业的采集分析软件
图像质量和数据准确性可能受到多种因素的干扰。这些问题不仅影响了图像的清晰度,也可能导致误判和数据分析上的错误,妨碍结论的可靠性。
勤翔小动物活体成像软件集成了强大的专用成像和分析模块。成像模块支持实时预览、全自动控制,确保图像数据的完整性和一致性。分析模块采用先进算法,支持背景扣除、图像增强和定量分析单位p/s/cm²/sr,进一步提高了图像数据的准确性。软件通过直观的界面将这些功能集成在一起,消除人为错误的可能性,确保了成像结果的高度可重复性。

5. 信息单一,信号不易定位——多维成像
传统的荧光成像技术通常只能提供单一模态的信息,缺乏多维度的综合表征。在精确定位信号源方面的明显不足,限制了对生物系统复杂交互作用的全面理解。
荧光成像提供了功能成像,揭示了生物过程的动态变化,例如基因表达、细胞活动和代谢。X射线成像则能提供结构信息,展示解剖结构。
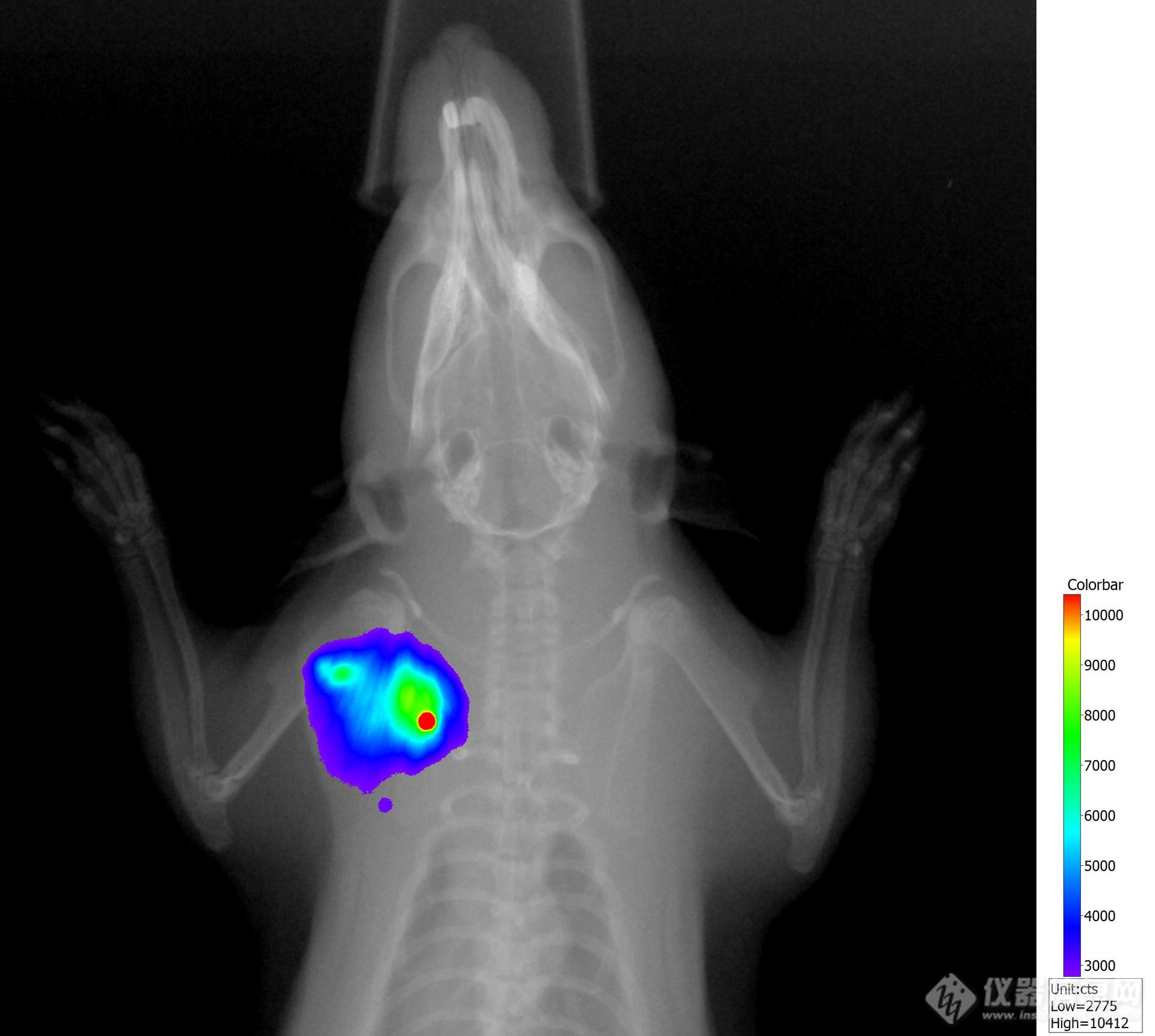
勤翔小动物活体系统整合了荧光成像和X射线成像,成像面积一致。研究人员可以结合解剖结构与信号的位置,精确定位信号的位置。仪器经第三方检测,符合中华人民共和国国家标准《电离辐射防护与辐射源安全基本标准》(GB18871-2002和FDA 21CFR1020.40标准)。
相关产品
 | ○ 多模态成像 生物发光 / 荧光 / X射线成像 ○ 高灵敏度制冷CCD相机 最低可达-90℃(选配水冷循环泵),可以检测到极微弱的生物发光信号并保持较低噪音 ○ F/0.8大光圈自动聚焦镜头 保证弱光条件下也有足够的进光量 ○ 高通量 可同时对最多5只小鼠进行成像 ○ 功能强大的专业图像采集分析软件 用于采集、可视化和精确量化成像数据 |
结论
通过利用荧光标记和成像系统,研究人员能够可视化和量化小动物体内特定分子、细胞和组织的分布及其动态行为。为了确保数据的高质量,本文提供了一些解决方案,以提升实验的信噪比、分辨率和特异性。
参考文献
1. Grimm, J. B., & Lavis, L. D. (2022). Caveat fluorophore: an insiders’ guide to small-molecule fluorescent labels. In Nature Methods (Vol. 19, Issue 2, pp. 149–158). Nature Research.
https://doi.org/10.1038/s41592-021-01338-6
2. Hayashi-Takanaka, Y., Stasevich, T. J., Kurumizaka, H., Nozaki, N., & Kimura, H. (2014). Evaluation of chemical fluorescent dyes as a protein conjugation partner for live cell imaging. PLoS ONE, 9(9).
https://doi.org/10.1371/journal.pone.0106271
3. Sridharan, R., Zuber, J., Connelly, S. M., Mathew, E., & Dumont, M. E. (2014). Fluorescent approaches for understanding interactions of ligands with G protein coupled receptors. In Biochimica et Biophysica Acta - Biomembranes (Vol. 1838, Issue 1 PARTA, pp. 15–33).
https://doi.org/10.1016/j.bbamem.2013.09.005
4. Salari, M., Bitounis, D., Bhattacharya, K., Pyrgiotakis, G., Zhang, Z., Purington, E., Gramlich, W., Grondin, Y., Rogers, R., Bousfield, D., & Demokritou, P. (2019). Development & characterization of fluorescently tagged nanocellulose for nanotoxicological studies. Environmental Science: Nano, 6(5), 1516–1526.
https://doi.org/10.1039/c8en01381k
5. Mahmoudian, J., Hadavi, R., Jeddi-Tehrani, M., Mahmoudi, A. R., Bayat, A. A., Shaban, E., Vafakhah, M., Darzi, M., Tarahomi, M., & Ghods, R. (2011). Comparison of the Photobleaching and Photostability Traits of Alexa Fluor 568-and Fluorescein Isothiocyanate-conjugated Antibody.
https://www.celljournal.org/article_250086.html
6. Yusuke Inoue, Kiyoko Izawa, Shigeru Kiryu, Arinobu Tojo, Kuni Ohtomo (2008) Diet and Abdominal Autofluorescence Detected by In Vivo Fluorescence Imaging of Living Mice
https://doi.org/10.2310/7290.2008.0003
7. Liesa-Marie Schreiber, Carles Urbiola, Patrik Erlmann, Guido Wollmann (2019) In Vivo Bioimaging for Monitoring Intratumoral Virus Activity
https://doi.org/10.1007/978-1-4939-9794-7_15
来源于:上海勤翔科学仪器有限公司
热门评论
最新资讯
厂商动态
新闻专题













