脂质纳米药物靶向分析
脂质纳米药物历经几十年的积累和沉淀,终于迎来了爆炸式的增长,目前已被广泛应用于抗肿瘤研究和治疗中。随着研究的进一步开展,使用脂质纳米药物进行靶向给药的概念也越来越深入人心。通过在脂质纳米药物表面修饰与靶细胞受体特异性结合的配体以改变药物在体内的分布和药物动力学特性,是实现其精准靶向递送的重要手段,该方法也被称为主动靶向,被认为是进一步提高纳米药物治疗效果的最佳策略之一。目前,该策略已被用于包括脂质体(liposomes)、脂质纳米颗粒(lipid nanoparticles, LNPs)、细胞外囊泡(extracellular vesicles, EVs)在内的多种药物递送载体表面功能化修饰。
然而,精确和可控地调节表面配体的呈递(如配体密度、分布、取向和构象等)仍然是靶向脂质纳米颗粒面临的主要挑战。如果靶向配体密度太高,当靶向受体在其它组织中低表达时,纳米颗粒将产生“脱靶效应”;更糟糕的是,由于空间位阻的存在,配体与受体结合会有障碍。如果配体密度太低,细胞摄取和内化效率就会受到影响。一般来说,靶向配体的最佳密度应与受体在靶细胞表面的分布相匹配。受体识别和靶点递送的关键是靶向脂质纳米颗粒外表面靶向配体的密度和分布,以及靶向生物大分子(如蛋白质、抗体和适配体等)的构象。活性靶向配体的批间一致性对于大规模生产至关重要,这一点也与表面靶向配体的表征高度相关。
01 靶向配体表征方法
批量测定方法
高效液相色谱(high performance liquid chromatography, HPLC)常用于分析靶向配体的组成,但是它无法区分配体是朝向脂质纳米颗粒的内腔还是外表面。通过直接定量分析和间接表征分析的方法可以判断配体的活性情况。直接定量分析基于靶向配体可以与特定的指示剂反应,这些生化分析可用于定量检测脂质纳米颗粒中有活性的靶向配体的密度。如抗体或者蛋白可以借助免疫荧光或免疫化学探针滴定,通过蛋白质分析BCA试剂盒和凝胶电泳等方法来定量;此外,利用扩增DNA序列和凝胶电泳可以检测核酸适配体;而肽则可以通过与伯胺反应获得的荧光胺进行分析。间接的表征分析则是在插入(靶向配体)后,从总加料反应物中减去游离的未偶联的配体或功能性基团的量等于偶联成功的数量。当然,也可以使用荧光探针预标记靶向配体,但预标记的靶向配体与未处理的配体相比可能具有不同的性质或反应活性,导致偶联效率的差异,这种结果往往无法反应靶向脂质纳米颗粒的真实情况。以上方法从群体水平对于配体组成进行分析,而脂质纳米药物制剂异质性强且具有多分散特性,因此在单颗粒水平上量化配体密度至关重要。
单颗粒表征方法
I)中国学者基于纳米流式检测技术及定量流式分析方法建立了一种单脂质体颗粒配体靶向修饰和密度定量表征策略,并据此揭示脂质体制备方法、配体投入量及表面聚合物修饰等多种参数对配体密度分布及其异质性的影响。该方法广泛适用于检测各种配体类型的靶向脂质纳米颗粒的活性配体密度,只要荧光标记的重组受体可以被工程化。(详见往期文章:一文读懂|脂质纳米药物靶向修饰研究新进展)
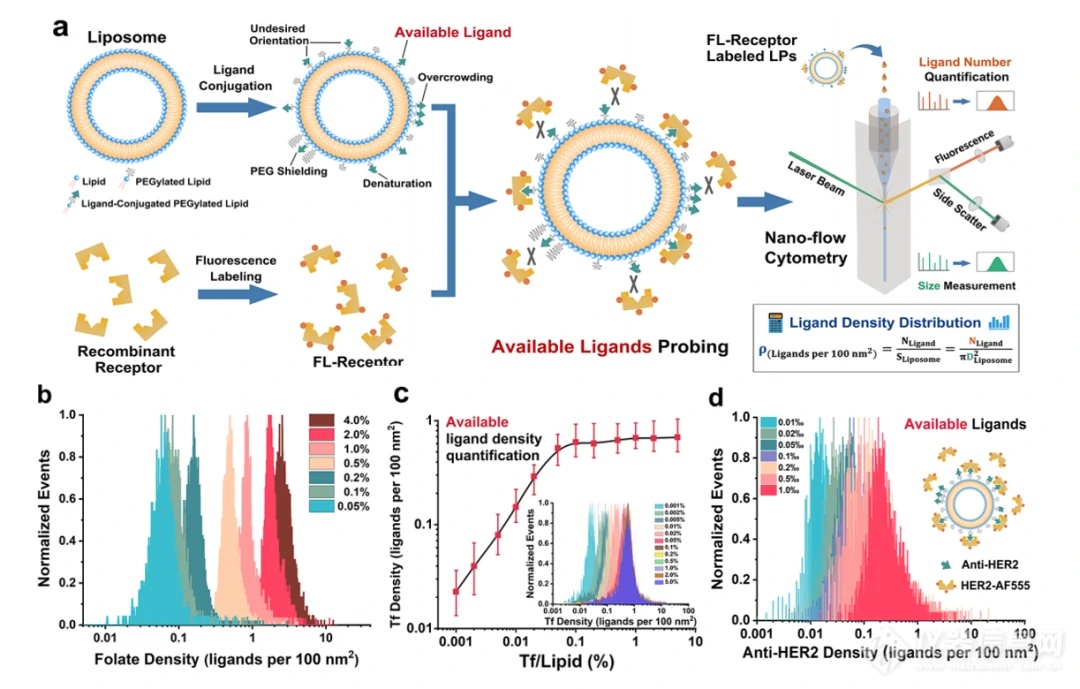
图1. 脂质体表面配体密度定量
II)丹麦科技大学的科研团队在荧光显微镜平台上开发了一种单颗粒水平直接分析表面抗体密度的方法。简单来说,将DiD荧光标记的脂质体通过生物素/链霉亲和素蛋白接头固定在玻片上,与血浆一起孵育,血浆中的调理素会与脂质体发生相互作用,随后用荧光标记(AF488)的一抗测量特定调理素(如IgM)的结合情况。他们的研究结果表明,抗体和抗原的调理作用高度取决于纳米药物的表面化学性质,包括PEG修饰。
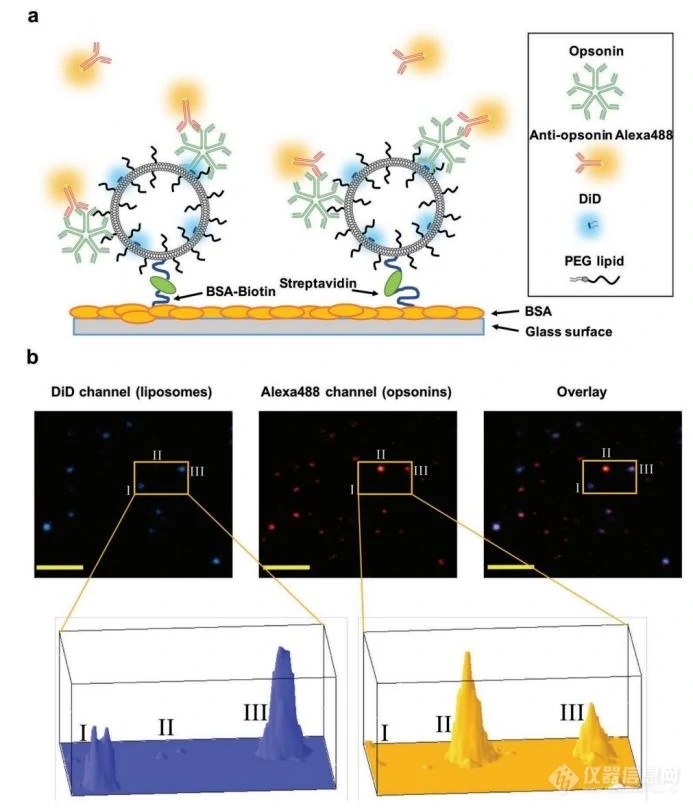
图2. 成像法分析脂质体表面配体示意图
对此,有学者这样评价:这些单颗粒测定提供了现有批量测定方法无法获得的细节信息,并为高质量靶向脂质纳米颗粒的开发提供指导。当然,在评估靶向修饰的维度时,除了修饰效率(阳性率)和单个颗粒上的拷贝数(密度)等指标,还应关注修饰前后纳米药物的物理性质(如粒径分布,单分散性,zeta电位等)是否发生显著变化;其次,修饰后的样品稳定性是否发生改变,比如是否容易导致团聚、批间一致性等问题均需要重点跟踪。
基于当前表征配体修饰的必要性和挑战性,NanoFCM隆重推出了完整的靶向配体修饰检测方案,一次检测满足以上多重需求。
02 NanoFCM配体检测方案
NanoFCM基于瑞利散射和鞘流单分子荧光检测技术,可快速获得粒径、浓度和荧光标记的生化指标信息,基于强大的软件数据分析功能,在此基础上获得颗粒表面积和颗粒配体数量,从而确定每100nm²LNP的配体密度。
靶向配体修饰分析
配体修饰后的LNP样品以合适比例与AF488荧光抗体充分混匀并孵育,去游离抗体后采用NanoFCM分析,获得散射强度与荧光强度二维散点图(图3),获得成功修饰配体的群体(P1)和未修饰配体群体(P2)。
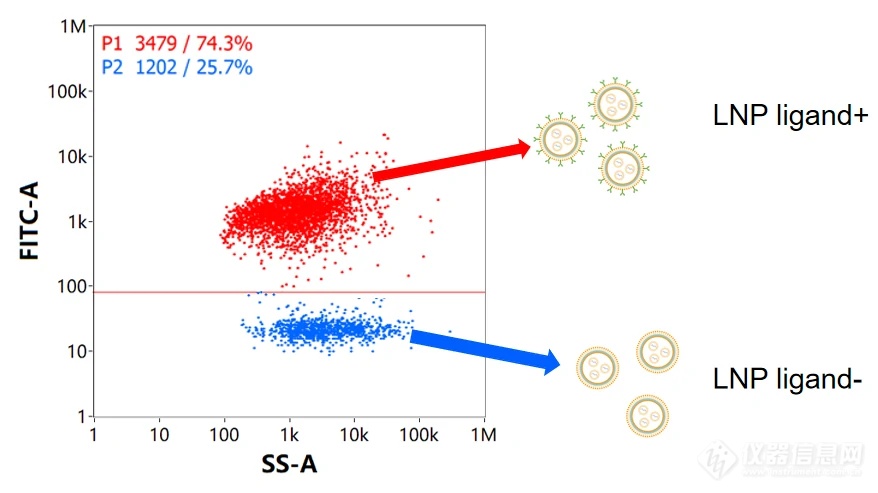
图3. 靶向配体修饰效率
荧光定量标准曲线
配置一系列浓度梯度的荧光定量微球,采用 NanoFCM分析,获得荧光强度与ERF工作曲线(图4)。
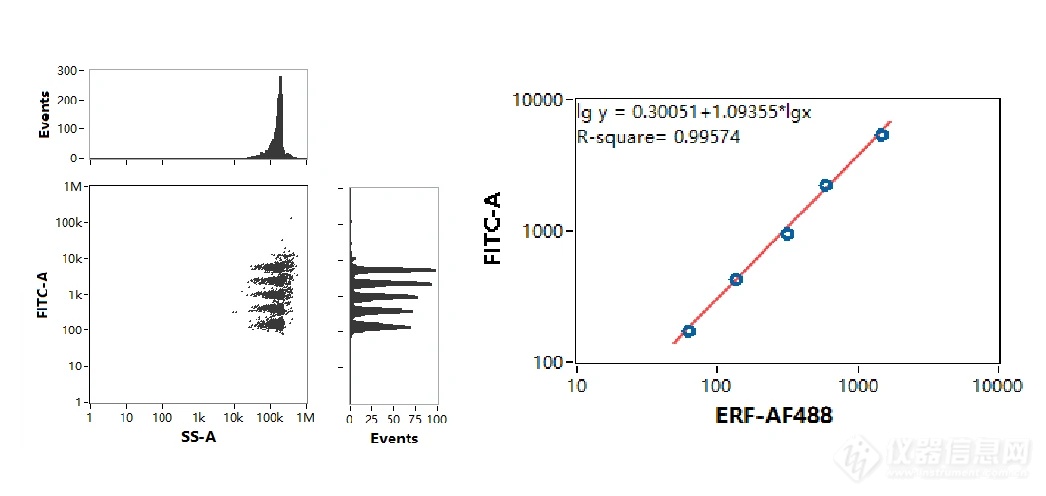
图4. 荧光定量标准曲线
待测LNP样品粒径和荧光强度分析
配体修饰后的LNP样品以合适比例与AF488荧光抗体充分混匀并孵育,去游离抗体后采用NanoFCM分析,获得Size(粒径)与Concentration(浓度)以及Size与荧光强度二维散点图。结果显示,有74.3%的颗粒成功修饰了配体,该群体粒径为98.7±19.2nm,浓度为2.37E+9 particles/mL。
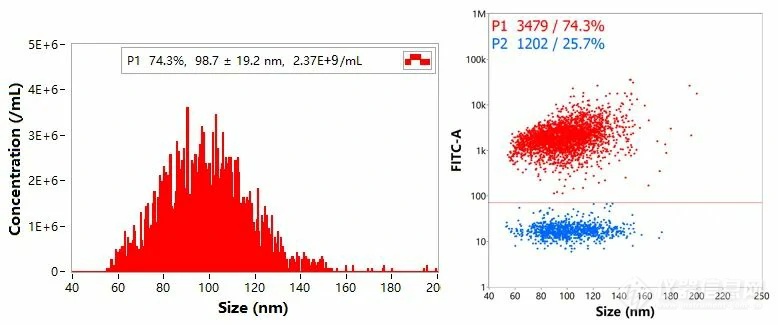
图5. LNP样品多参数表征
LNP配体密度分析
根据荧光定量标准曲线,即可快速获知待测单个LNP颗粒荧光强度对应的ERF数值,基于AF488与抗体特定的结合比例,获得单颗粒配体数量信息。同时,软件可结合颗粒粒径结果,直接获得颗粒表面积(nm²),从而获得每100nm²配体拷贝数信息,该结果可进一步指导配体修饰条件优化。
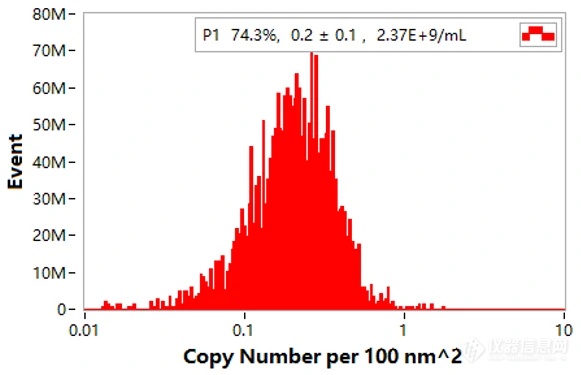
图6. NanoFCM配体密度结果
展望
福流生物紧跟行业发展步伐和客户表征需求,结合新上市的荧光定量微球产品和强大的Flare软件分析功能,相比于传统配体密度检测的方法,NanoFCM提供了单颗粒水平的分析视角,快速获得LNP样品的粒径及分布、浓度、空壳率、包封率及每100nm²配体拷贝数等信息。此外,NanoFCM还可用于特异性抗体筛选,制备条件优化等环节。不论是脂质体、LNP还是EVs,NanoFCM对多种主动靶向的纳米载体均具有普适性。欢迎联系我们获取方案。

来源于:厦门福流生物科技有限公司
热门评论
最新资讯
厂商动态
新闻专题
















