中国首例基于英国kirkstall类器官技术用于精准医疗:肿瘤尺寸减小,随访未发现复发
(一)摘 要
基于肿瘤类器官的药物敏感性预测是一种新的精准医学方法,在癌症治疗中有着广泛的应用,并受到越来越多的关注。在癌症领域,传统的类器官培养方法通常需要超过2周~3周的培养期。培养时间极大地限制了肿瘤类器官应用和患者的临床诊疗黄金期。
全国建院较早的六所肿瘤医院之一,山西省肿瘤医院/中国医学科学院肿瘤医院山西医院/山西医科大学附属肿瘤医院和自贡第四人民医院等,应用了英国Kirkstall动态类器官培养微生理系统,以缩短乳腺癌类器官的培养时间,同时保持其组织学特性和药物敏感性特征。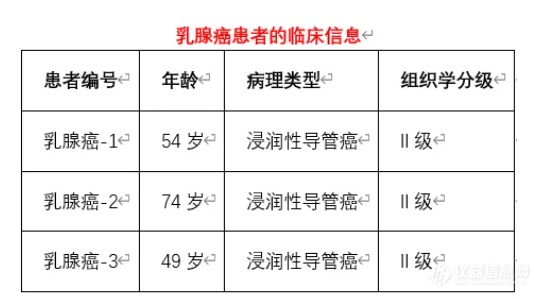
(二)研 究 发 现
利用奥拉帕尼、卡培他滨、顺铂、吉西他滨、戈沙妥珠单抗(SN-38替代品)和法玛新药物霉素对Dome组类器官进行药物刺激研究。三种类器官模型显示对药物霉素敏感,并显示了人类使用的良好治疗结果。其中,BC1和BC2患者在乳房切除术后给予药物阿霉素化疗,随访10个月时未发现肿瘤复发。BC3患者采用药物霉素进行新辅助治疗,治疗6个周期后,肿瘤大小从2.41*1.91 cm到1.46*1.24 cm。
(三)乳腺癌类器官的培养关键实验步骤
1. 组织收集:
- 从三名患有浸润性导管乳腺癌的患者身上获取肿瘤组织样本。
- 样本采集经山西省级癌症医院伦理委员会审查和批准(记录号KY2023039)。
- 所有研究方法均使用获批的方法进行。
- 所有样本的收集均获得了患者的书面知情同意,并符合所有相关的伦理规定,包括赫尔辛基宣言。
- 组织样本在处理和分析前进行了去标识化处理。
2. 建立和培养乳腺癌类器官:
- 从组织中去除明显的结缔组织,从视觉上异常的区域切取一块组织用于石蜡包埋。
- 将剩余组织切成大约1mm³的小块,并使用含有10µM Y-27632和2mg/mL I型胶原酶的先进DMEM/F12在37°C恒温摇床中分散。
- 摇动30分钟到1小时,期间每5到10分钟用Pasteur吸管吹打几次。
- 向收集的滤液中加入等体积的含有2% FCS的先进DMEM/F12。
- 离心后,用Matrigel重悬细胞沉淀,并在24孔细胞培养板中每滴40µL进行接种。
- 在37°C下孵育20分钟,待滴液完全固化后,加入500µL的乳腺癌类器官培养基(KCJ-7, KINGBIO)并继续在37°C 5%CO2条件下培养。
- 每3天更换一次培养基。
- 每7-15天消化并传代一次,使用Dispase II(17105041, Gibco)回收类器官,并使用Accutase(A1110501, Gibco)将类器官解离成单细胞。
3. 实验前准备:
- 实验所用的乳腺癌类器官应高于两代且低于五代。
- 使用英国Kirkstall Quasi Vivo® 动态系统进行流体培养。
- 实验前将类器官解离成单细胞,并在每100µL Matrigel中接种20000个细胞。
4. 免疫组化染色:
- 使用常规方法进行组织和类器官的固定、石蜡包埋、切片、HE染色和IHC染色。
- 用于免疫组化染色的抗体包括PR(Abcam, ab32085)、ER(Abcam, ab108398)、HER2(Abcam, ab134182)、CK7(Abcam, ab181598)、GATA3(Abcam, ab199428)、E-cadherin(Abcam, ab40772)、Ki-67(Abcam, ab15580)。
- 使用Nikon ECLIPSE E100显微镜MshOt MS60获取图像,并使用Adobe Photoshop进行图像处理。
5. 基因表达分析:
- 通过RT-qPCR测量基因表达水平。
- 使用Trizol(beyotime, R0016)提取总RNA,使用PrimeScript RT Master Mix(TaKaRa, RR036A)进行逆转录,并使用TB Green Advantage qPCR premixes(TaKaRa, 639676)进行qPCR反应。
6. 类器官增殖实验:
- 使用Alamar Blue(YEASEN, 40202ES80)进行类器官增殖实验。
- 将染料溶液按比例加入类器官培养基中,反应时间为3小时。
- 在检测期间,将染料溶液移入96孔板中,使用无内容物的凝胶滴在24孔板中作为阴性对照进行染色,并使用100%降低的Alamar Blue溶液作为阳性对照。
- 读取595nm和630nm处的吸光度值,并根据制造商的说明计算降低率。
7. 类器官直径测量:
- 随机选择100倍视野下的3个视野,测量并计数视野内所有清晰可见的类器官。
- 每5天测量一次。
8. 药物筛选:
- 使用CellTiter-Glo(Promega, G9241)对类器官进行药物敏感性分析。
- 这些药物包括奥拉帕尼(HY-10162, MCE)、卡培他滨(5'-氟尿嘧啶替代品)(100187, National Institutes for Food and Drug Contro)、顺铂(S1166, selleck)、吉西他滨(100622, National Institutes for Food and Drug Contro)、(HY-13704, MCE)和(130560, National Institutes for Food and Drug Contro)。
- 使用Dispase II收集类器官。使用Accutase将类器官消化成单细胞。
- 在含有5% Matrigel的类器官培养基的384孔板中每孔接种1,000个细胞。
- 培养过夜后,加入药物库存溶液。
- 药物孵育3天后,使用CellTiter-Glo检测法根据制造商的说明定量细胞活性。
9. 统计分析:
- 数据以均值±标准差表示。使用Shapiro-Wilk检验进行正态性检验。
- 使用双尾学生t检验、Wilcoxon检验和Kruskal-Wallis检验进行比较分析。
- p < 0.05表示显著,除非另有说明。
- 星号数量表示不同程度的统计显著性(*p < 0.05; **p < 0.01; ***p < 0.001)。
- 所有数据分析和图形均使用GraphPad Prism 8进行。
这些步骤概述了从样本收集到类器官培养、药物筛选和数据分析的全过程。参考文献:Jun Yang et al.Posted Date: March 15th, 2024 .DOI: https://doi.org/10.21203/rs.3.rs-3923138/v1
(四)讨论与展望

在这篇文章中,作者阐述了microfluidic systems在癌症类器官培养中的应用,这些应用展示了动态仿生类器官培养系统在癌症研究和治疗开发中的潜力,特别是在模拟复杂的肿瘤微环境和进行个性化医疗方面。
1. 模拟肿瘤微环境:动态仿生类器官培养系统能够创建一个模拟体内肿瘤微环境的平台,用于研究肿瘤细胞与微环境之间的相互作用。
2. 药物筛选:动态仿生类器官培养系统可以用来进行高通量的药物筛选,通过集成的微流体通道和芯片模拟肿瘤与血管网络的相互作用,评估药物的输送和肿瘤生长。
3. 癌症进展研究:通过在动态仿生类器官培养系统技术平台上创建血管化肿瘤类器官模型,研究者可以观察和分析肿瘤细胞的侵润、血管生成以及肿瘤细胞的转移。
4. 个性化医疗:动态仿生类器官培养系统可以用于个性化医疗研究,通过模拟特定患者的肿瘤微环境,测试患者特异性的癌症治疗方法。
5. 提高实验的标准化和可重复性:动态仿生类器官培养系统有助于实现癌症类器官培养的标准化,通过精确控制培养条件和环境参数,减少实验之间的变异性。
6. 三维培养和细胞间相互作用:动态仿生类器官培养系统可以支持三维细胞培养,允许研究者研究肿瘤细胞与非肿瘤细胞(如成纤维细胞、免疫细胞)之间的相互作用。
7. 长期培养和扩增:微流控类器官芯片微生理系统提供了一种方法,用于长期培养和扩增癌症类器官,同时保持其遗传和表型特征。如小编正在科普的英国Kirkstall Quasi Vivo培养系统
8. 模拟肿瘤的动态变化:通过该动态仿生类器官培养技术,可以模拟肿瘤在治疗过程中的动态变化,包括对药物的反应和产生耐药性。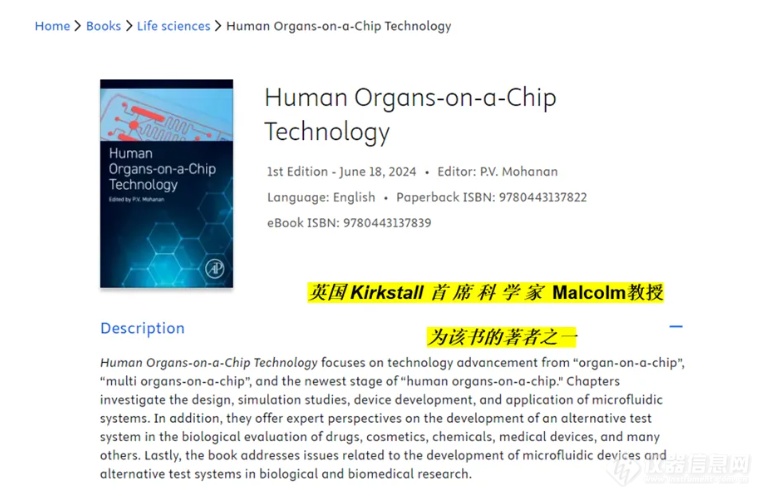
9. 集成多个器官芯片:可以用于连接多个器官芯片(例如英国Kirkstall 智能自动化类器官芯片培养微生理系统),模拟多个器官之间的相互作用和药物的全身效应。
(五)附《2025年度国家自然科学基金项目指南》征订通知
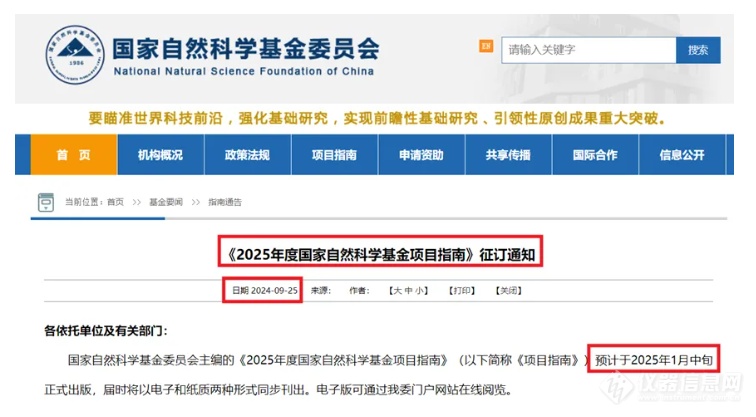
来源于:北京基尔比生物科技有限公司
热门评论
最新资讯
厂商动态
新闻专题





