- 1
Biacore T200 分子相互作用仪
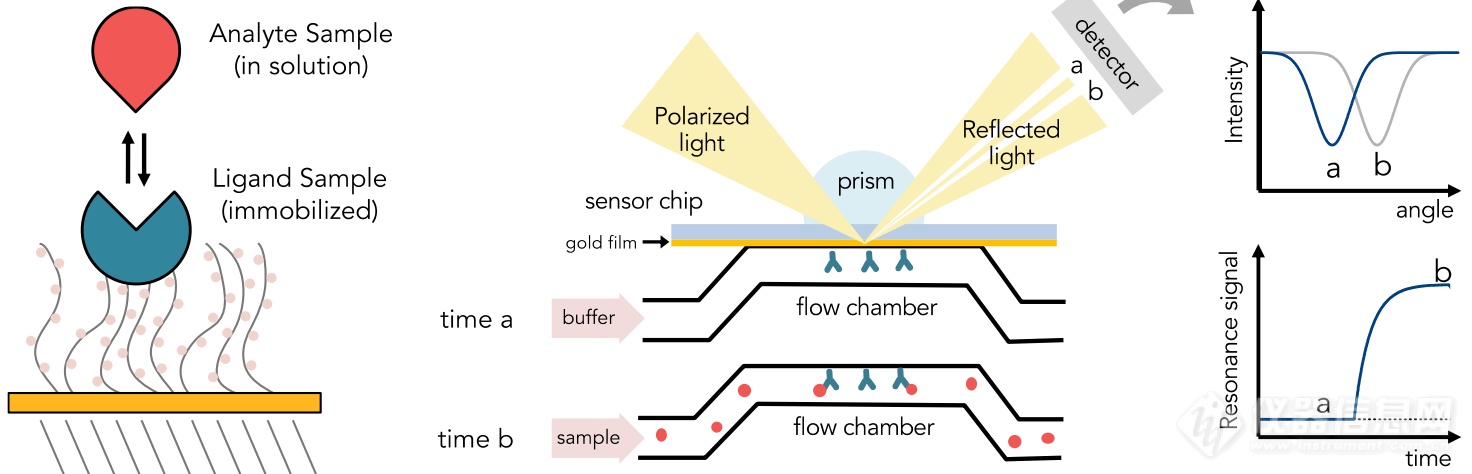
Biacore系统是基于表面等离子共振原理(SPR))的生物分子相互作用分析系统,通过实时、无标记的分析手段对分子结合过程加以研究,可揭示蛋白质,核酸等多种生物分子之间的相互作用,有助于科学家更深刻地理解生物分子之间的相互作用和这些作用所承载的生物学功能。在SPR实验中,一个分子(配体)固定在传感器芯片上,第二个分子(分析物)流过芯片表面,在流动条件下测定相互作用。响应以共振单位(RU)表示并与表面质量成正比。SPR实验可用于测量动力学结合常数(ka,kd)和亲和力(KD)。
|
|
|
| |
应用和特点
主要应用
● 动力学: ka, kd
● 亲和力: KD
● 大分子和小分子结合
Biacore T200 主要特征
● 多种偶联方式
● 可设置单循环动力学
● 温度可控(4-45℃)
● 可用于小分子的高灵敏检测
耗材
● S 系列芯片
注意:只有S系列芯片适用于 Biacore T200
更多芯片类型及货号可查看 Cytiva 网站
● 96 or 384-well reagent plates (optional)
使用 Biacore Microplate Foil (96 or 384-well)
● 缓冲液和EP管 (自备)
● Pipettes,双面架,记号笔 (自备)
| Popular Biacore T200 Sensor Chips and Kits | Part Number |
|---|---|
| CM5 Sensor Chip, Series S (amine, thiol coupling) | BR100530 (3-pack) |
| Amine Coupling Kit | BR100050 |
| SA (streptavidin) Sensor Chip, Series S | BR100531 (3-pack) |
| Biotin CAPture Kit, Series S | 28920234 |
| NTA Sensor Chip, Series S | BR100532 (3-pack) |
| GST Capture Kit | BR100223 |
| Mouse Antibody Capture Kit | BR100838 |
| Human Antibody Capture Kit | BR100839 |
样品准备
缓冲液
● 准备>250 ml的运行缓冲液
● 所选缓冲液需要保证蛋白质的活性
● 为了避免非特异性结合,可添加 0.05% Tween 20 或其它种类的表面活性剂
尝试的表面活性剂浓度范围 0.02-0.1%
Cytiva 有商业化缓冲液 HBS-P+ (HBS, 0.05% Tween20) 可购买,登陆Cytiva网站查找详细信息
● DMSO 浓度最高可达10%
● 请用运行缓冲液配制分析物样品
样品
● SPR实验
配体:固定的分子
分析物:流动的分子
● 分析物溶解在运行缓冲液中
缓冲液不一致将产生溶剂效应
由于DMSO具有高折光率,所以分析物与运行缓冲液中的DMSO浓度应该尽可能一致
● 精确定量样品浓度
配体浓度影响信号强度
分析物浓度直接影响KD
● 蛋白聚集体会干扰SPR实验,损坏芯片或者堵塞流通池
实验开始前过滤或离心样品
使用动态光评价样品的均一性
使用SEC去除可溶性的蛋白多聚体
● 初次尝试的浓度范围:
配体:2 – 50 µg/ml
分析物:0.01 – 100 X KD (推荐 0.1 – 10 X KD)
● 所需样品体积:
随流速和时间的变化而不同
单次最大进样体积 408
新手入门
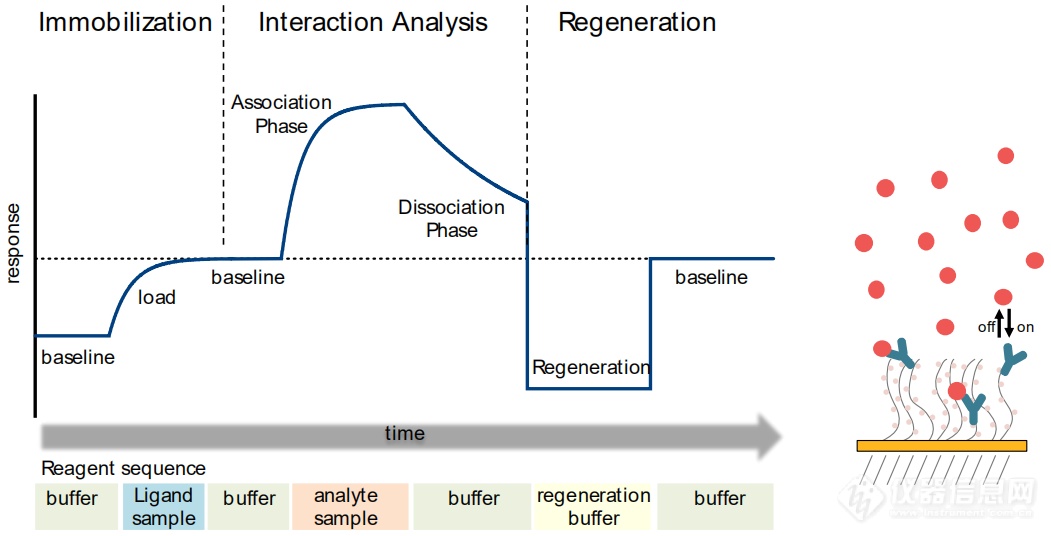
SPR 实验有三个主要步骤需要优化:
Immobilization: 将配体固定到芯片表面
Interaction analysis: 分析物的结合和解离过程
Regeneration: 移除芯片表面的分析物或分析物和配体
实验设计注意事项
Immobilization
Biacore T200 一共有4个通道
● 每次实验使用两个通道 (1和2通道或者3和4通道)
第一个通道为参比通道 (不固定配体分子)
第二个通道为样品通道 (固定了配体分子)
● 推荐配体偶联时的流速:10 µl/min
● 估算目标偶联量
目标 Rmax ~ 25 (受最大偶联密度限制)
实验结果 Rmax 可能在 2-10 RU(非绝对,仅供参考)
预实验时,可以设定较高的偶联量,以避免低表面活性
Rmax = RL x MW analyte /MWligand x Sm
Rmax = 分析物最大的理论响应值
Sm = 化学计量比(分析物/配体)
RL = 配体偶联量
目标偶联量的计算方法:
对于蛋白分析物,将RL设置为Rmax低于150
对于小分子分析物:
● 建议低密度偶联
低偶联密度相当于较少的分析物消耗
在层流中,例如 50 µl/min时,由于表面附近的流速很低,低偶联密度可以使得表面附近的分析物浓度很快恢复
最小的空间位阻和聚集体
减少传质效应
● 固定配体可以通过不可逆捕获或可逆捕获来实现
不可逆捕获:配体不能从芯片表面除去
● CM5 (Carboxy Methyl Dextran) 用于氨基偶联
建议配体浓度:10-50 µg/ml (~25 µg/ml)
最大偶联密度:8000-10000 RL
配体的等电点建议大于4,太低不利于氨基偶联
最常用芯片类型
可用于制备捕获芯片 (固定抗体或链霉亲和素)
氨基偶联
● SA (Streptavidin) 用于捕获生物素标记的配体
氨基偶联链霉亲和素到 CM5芯片,可降低非特异性结合或可达到高偶联密度
可选择Biotin CAPture kit 进行可逆的捕获
推荐配体浓度 ~2-5 µg/ml
最大捕获量:2000 RL
其它类型的SA芯片:
可逆捕获:每个循环可以从芯片表面除去配体
● NTA 可用于捕获 His标签蛋白
建议配体浓度 ~10 µg/ml
最大捕获量:1,000-3,000 RL
8 His 或者 10 His的标签蛋白可提供更大的偶联量 (多达 5,000 RL)
与氨基偶联同时进行可实现稳定偶联,但芯片将不可逆
● Biotin CAPture Kit 用于捕获生物素化的配体
建议配体浓度 ~2-5 µg/ml.
芯片已经预固定了特定的单链DNA
Biotin CAPture kit提供生物素化的互补DNA
● 抗体捕获试剂盒
Anti-human, Anti-mouse, Anti-GST, Anti-His capture kits 可提供相应的抗体和试剂,通过氨基偶联的方式固定到 CM5 芯片以实现可逆的抗体捕获
最大的固定量依抗体浓度而定
Interaction analysis: 设置动力学实验
● 动力学实验需要至少5个浓度梯度
浓度范围覆盖 0.1 - 10X KD,曲线分布要有曲有直
● 可设置多个零浓度用来测定基线,如样品进样前两个,样品进样后一个
● 至少设置一个浓度重复,可评价再生效果
● 动力学检测时,推荐流速 50 µl/min (最小 30 µl/min)
高流速最好 (100 µl/min > 50 µl/min > 30 µl/min)
高流速有利于参比扣除和拟合
● Startup cycles 对于仪器的平衡是必要的
蛋白样品:3 startup cycles
小分子样品:5-10 startup cycles
● 设置重复试验计算实验误差,包括重新制备分析物和固定配体
● 如果实验中使用了 DMSO,那么需要进行溶剂校正实验
Regeneration
● 配体的固定方式分为可逆法和不可逆法
● 可逆固定
每个实验循环都需要将芯片表面的配体移除
每个循环必须重新捕获配体
可逆固定方式的再生有成熟的试剂盒可选择,但是也需要进行必要的优化
● 不可逆固定
通过移除分析物来再生配体表面,但不能损害配体活性
通过不可逆方式固定配体,那么每次实验都要重新优化
● 优化再生条件
高浓度快解离的 competitor
0.1% SDS (进样15 sec)
高盐
低 pH
高 pH
添加去垢剂到缓冲液中
优化的目的是在不损害配体表面活性的前提下,选择更温和的再生条件
可使用手动操作或者使用 Regeneration Scouting Wizard
测试一系列溶液,从温和到剧烈:
为了确定再生条件,需要进行 5-6 结合再生循环
如果解离比较快,那么可以不用再生
小分子化合物可能难以再生,因此请尝试更广泛的再生条件
数据收集
数据收集前的准备
● 提前一天在大型仪器共享平台上预约
● 手机开电,然后手动开电脑主机和仪器电源
● 设定实验温度为25℃
● 缓冲液和芯片提前在室温平衡
实验数据收集
三种数据收集方式:
● Manual Run
● Wizard Template (most common)
● Method
1. Manual Run
● 在手动运行中,可以实时发出仪器命令以进行快速测试或控制注射的结束时间
i)不能于动力学分析,因为评估软件不会读取这些数据
ii)最常用于预实验或手动固定
2. Wizard Template
● 常用的实验方法可以从向导模板中运行
● 选择文件→打开/新建向导模板
● 选择实验类别(例如固定化,动力学/亲和力)
● 选择新建(或选择一个保存的模板)
● 设计实验
● 将样品添加到试剂架
(1)选择要使用的架子(最常见的是样品架和试剂架1)
(2)选择菜单→Automatic Positioning
(3)对于技术重复(使用同一样品管),将Pooling 改为 Yes
i)要更改rack type,请在“Rack Positions”页面上
ii)选择弹出rack
iii)根据rack map,向试剂架中放置相应的试剂
● 要保存Wizard Template,请在“Prepare Run Protocol”页面上:
i)选择菜单→将Wizard Template另存为...
● 选择开始以开始运行
3. Method
● 可以使用“Method Builder”设计更复杂的实验
● 通过修改现有方法或使用“Method Builder”来创建方法模板
● 选择文件→打开/新方法
● 选择一个现有的方法或Wizard Template
i)要将Wizard Template转换为方法,请选中显示可导入Wizard Template的复选框
ii)Biacore方法文件夹中有一些预先设计的方法,可用于更复杂的方法实验(例如GST动力学,单循环动力学等)
● 选择打开
● 根据需要修改方法
● 选择设置运行
● 输入运行参数
● 选择开始运行
数据分析
● 打开Biacore T200 Evaluation Software
● 选择文件→打开,以打开数据文件
● 检查所有原始和减去的感应图
● 单击工具栏上的动力学/亲和力按钮,然后选择“Surface bound”
● 选择曲线对话框:
查看/编辑要包含的数据
Blanks 显示为灰色
● 选择数据对话框:
显示减去空白的数据
右键单击并拖动以删除选定的数据区域(例如,删除尖峰)
选择分析类型“动力学”(首先尝试拟合动力学,然后返回并拟合“亲和力”作为替代或验证动力学)
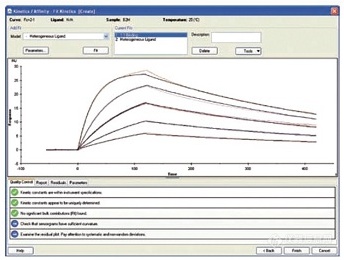
● 动力学对话框:
单击拟合以执行拟合
从默认的 1:1 binding model开始
查看 “Quality Control” 选项卡并检查拟合情况
单击完成以完成分析
● 稳态拟合对话框:
稳态拟合仅在结束时均已达到平衡的数据上使用
调整分析区域(可选)
单击拟合以执行拟合
检查拟合和拟合参数
单击完成以完成分析
关机
1. 从仪器中取出 芯片
2. 倒掉废液
3. 清洁台面卫生
4. 手机关电,退出大仪共享系统
6个月
否
有
以需求定制服务
以需求定制服务
非人为损坏免费维修,零件另算
72小时上门安装维修
相关产品



 仪器对比
仪器对比



 关注
关注