疏水作用是指水介质中球状蛋白质的折叠总是倾向于把疏水残基埋藏在分子内部的现象。疏水作用及疏水和亲水的平衡在蛋白质结构与功能的方方面面都起着重要的作用。1959年,Kauzmann在《蛋白质化学进展》上发表了一篇题为“影响蛋白质变性的一些因素”的文章,首次明确提出“疏水作用”这一概念。在当时,生物化学家已经知晓蛋白质中含有α螺旋和β折叠;一些蛋白质和多肽的序列已经测定;但是蛋白质的立体结构还正在测定中。与此同时,Tanford等为疏水作用的存在提供了实验数据。从此以后,疏水作用的概念被蛋白质化学家所接受。目前,不同实验室对20种氨基酸的疏水特性分别提出了不同的参数。对一个蛋白质肽链中的每个氨基酸残基也通常使用亲/疏水作图法(hydropathy)描述。通过亲/疏水作图法可以了解整条肽链中不同肽段的亲/疏水性,进而可以对一些处于蛋白质分子表面的抗原决定簇及一些膜蛋白中穿越膜的肽段进行预测。
疏水作用的本质来源于熵力,一个孤立系统出现平衡态是熵和能量两方面达到最jia折衷的产物。考兹曼(W.Kauzmann)1959年指出为了减少暴露在水中的非极性表面积,任何两个在水中的非极性表面积将倾向于结合在一起。疏水溶剂化的代价大部分源于熵,疏水效应显著的熵特性,这暗示着随温度增高疏水效应的增强(前提是温度不得破坏水中氢键的情况下,氢键破坏越多疏水表面对氢键形成干扰越小,疏水效应减弱)。与排空效应是类似的疏水效应能够利用熵呈现出分子的自组装。
疏水相互作用层析(hydrophobic interaction chromatography,HIC)依赖于生物大分子表面疏水性不同来分离生物大分子的一种方法。蛋白质和多肽等生物大分子的表面常常暴露着一些疏水基团,高盐情况下,蛋白表面的疏水基团被暴露,通过与配基的疏水相互作用结合而被吸附;当盐浓度下降,蛋白表面的水化层增加,使得疏水相互作用减弱,从而实现蛋白解吸。多数情况下抗体的疏水性要强于大部分杂质组分,因此 HIC 可作为精制步骤用于抗体纯化,HIC介质的疏水性对抗体产品的收率和杂质去除效果有较大影响。
·影响疏水层析的因素· *蛋白质的疏水性强弱取决于其表面疏水基团的分布。 *盐的种类及浓度,组成缓冲液中盐的某些离子对蛋白质的构象有稳定作用,如SO42-可提高蛋白结构的稳定性,使蛋白的溶解度下降,对蛋白有盐析效应,使蛋白同配基间疏水作用增强。还有些离子对于蛋白质构象具有不稳定作用,如Cl-、Ca2+可增加蛋白质的溶解度,这类离子洗脱能力较强。盐析和盐溶的特性可作为选择疏水介质平衡和洗脱条件的依据,常用的疏水配基的疏水性强弱和疏水作用离子排列如下:
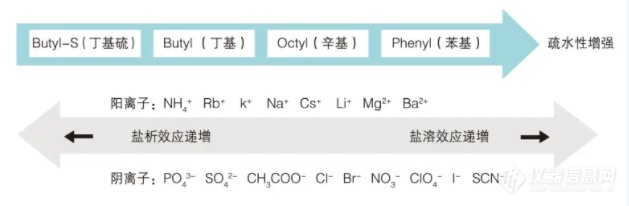
*疏水层析过程中,温度升高,疏水作用增强,有利于提高层析柱的分离度,但对于生物活性物质来说,高温条件会使其变性失活,因此疏水层析通常在常温或者低温中进行,建议维持室温。
*疏水层析流动相的pH通常为中性的磷酸盐缓冲液。蛋白质同疏水基团的作用力随pH升高而降低,因为蛋白质的酸性基团随pH升高所带电荷逐渐增多,亲水性增强。但在疏水层析中通常不采用改变溶液的pH来改变蛋白质的疏水性。
月旭现推出了快流速琼脂糖基架疏水层析介质,Phenyl/Butyl/Octyl/Butyl-S Tanrose FF 快流速琼脂糖基架疏水层析介质。
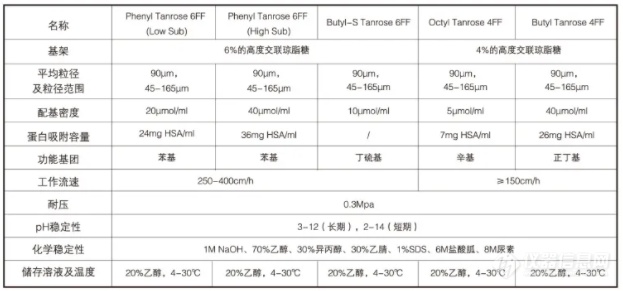
Phenyl Tanrose 6FF属于芳香族疏水介质,疏水性最强。根据配基取代程度不同分为:高取代(High Sub简称HS)和低取代(Low Sub简称LS)两种介质。苯基通过不带电,化学性质稳定的醚键连接到琼脂糖上。
Butyl Tanrose 4FF和Octyl Tanrose 4FF这两种介质属于脂肪族疏水介质,Butyl Tanrose 4FF配基为丁基,Octyl Tanrose 4FF配基为辛基:这两种配基通过不带电且化学稳定性的醚键同高度交联的琼脂糖偶联而成。
Butyl-S Tanrose 6FF是疏水性最弱的疏水介质,适合在较低盐浓度条件下纯化强疏水性分子,可去除脂肪类、脂蛋白、色素等,在酵母重组表达乙肝疫苗纯化过程中发挥重要作用。
·技术指标·
南昌站-月旭科技邀您共聚制药行业质控技术大会
寻找色谱分析达人 月旭科技第一季“有奖征集”即刻开启
喜讯!月旭产品已远销94个国家和地区
【直播有礼】高效液相色谱工艺放大:从分析到制备纯化

相关产品

关注

拨打电话

留言咨询