在生物化学和分子生物学中,结合位点是大分子(例如蛋白质)上的一个区域,它可以特异性地与另一个分子结合。与大分子结合的物质通常称为配体, 配体可能包括其他蛋白质(导致蛋白质-蛋白质相互作用)、酶底物、第二信使、激素或变构调节剂。结合通常但不总是伴随着改变蛋白质功能的构象变化。与蛋白质结合位点的结合通常是可逆的(瞬时和非共价),但也可以是共价可逆的或不可逆的。
功能
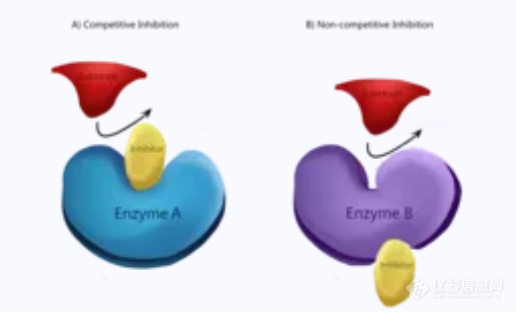
配体与蛋白质结合位点的结合通常会引发蛋白质构象的变化,并导致细胞功能的改变。因此,蛋白质上的结合位点是信号转导途径的关键部分。配体类型包括神经递质、毒素、神经肽和类固醇激素。结合位点在许多情况下会引起功能变化,包括酶催化、分子途径信号、稳态调节和生理功能。该位点的电荷、空间形状和几何形状选择性地与高度特异性的配体结合,激活该蛋白质负责的细胞相互作用的特定级联。 催化作用 酶通过比底物和产物更强烈地与过渡态结合而产生催化作用。在催化结合位点,几种不同的相互作用可能作用于底物。这些范围包括电催化、酸碱催化、共价催化和金属离子催化。这些相互作用能通过稳定高能分子来降低化学反应的活化能。酶结合会排除与反应无关的物质,这种特异性结合也阻止了副反应。 可以产生催化作用的酶类型包括氧化还原酶、转移酶、水解酶、裂解酶、异构酶和连接酶。转移酶己糖激酶催化葡萄糖的磷酸化以制造葡萄糖-6-磷酸;己糖激酶的活性位点残基可以稳定活性位点中的葡萄糖分子,并刺激相互作用的旁路途径开始,降低活化能。 抑制 抑制剂结合蛋白质可能导致通路调节、稳态调节和生理功能障碍。 竞争性抑制剂与底物竞争在活性位点与游离酶结合,从而在结合时阻碍酶-底物复合物的产生。例如,一氧化碳中毒是由一氧化碳与血红蛋白中的氧之间的竞争结合引起的。 或者,非竞争性抑制剂在活性位点与底物同时结合。在与酶底物 (ES) 复合物结合后,形成酶底物抑制剂 (ESI) 复合物。与竞争性抑制剂类似,产物形成的速率也降低。 最hou,混合抑制剂能够与游离酶和酶-底物复合物结合。然而,与竞争性和非竞争性抑制剂相反,混合抑制剂与变构位点结合。变构结合诱导可能增加蛋白质对底物的亲和力的构象变化。这种现象称为正调节,相反,降低蛋白质对底物亲和力的变构结合是负调节。 类型 活性位点 底物与酶在活性位点结合以诱导化学反应。底物、过渡态和产物可以与活性位点结合,任何竞争性抑制剂也同样。例如,在蛋白质功能的背景下,肌肉细胞中钙与肌钙蛋白的结合可以诱导肌钙蛋白的构象变化。原肌球蛋白暴露肌动蛋白-肌球蛋白结合位点,肌球蛋白与之结合以形成横桥并诱导肌肉收缩。在血液的背景下,一个竞争性结合的例子是一氧化碳,它与氧竞争血红素上的活性位点。在低氧浓度的情况下,一氧化碳的亲和力可能会胜过氧,此时,一氧化碳的结合会引起构象变化,阻止血红素与氧气结合,从而导致一氧化碳中毒。
变构位点
在调节位点,配体的结合可能会引起蛋白质功能的增强或抑制。配体与多聚酶变构位点的结合通常会诱导正协同作用,即一种底物的结合会诱导有利的构象变化,并增加酶与第二种底物结合的可能性。调节位点配体包括同向性和异向性配体,其中单个或多种类型的分子会分别影响酶活性。
高度调控的酶在代谢途径中通常是必不可少的。例如,在糖酵解中能磷酸化果糖的磷酸果糖激酶(PFK)主要受ATP调节。它在糖酵解中的调节作用是必不可少的,因为它是该途径中作为保证和限速的一个步骤。PFK还控制需要用在通过分解代谢途径形成 ATP 的葡萄糖量。因此,在足够的ATP水平下,PFK会被ATP变构抑制。这种调节有效地保存了其他途径可能需要的葡萄糖储备。柠檬酸盐是柠檬酸循环的中间体,也是PFK的变构调节剂。
单链和多链结合位点
结合位点也可以通过它们的结构特征来表征。单链位点由单个蛋白链形成,而多链位点由能结合多个蛋白质链的配体形成,是在蛋白质中很常见的复合物。最近的研究表明,结合位点结构对蛋白质复合物的生物学具有深远的影响(功能的进化、变构)。
隐性结合位点
隐性结合位点是以apo形式瞬时形成或由配体结合诱导的结合位点。能使潜在的“可成药”的人类蛋白质组的大小增加,从蛋白质大小的约40%增加到78%左右。该结合位点能通过以下方式研究:应用于“CryptoSite”数据集的支持向量机,“CryptoSite”数据集的扩展,使用马尔可夫状态模型和生物物理实验进行长时间尺度的分子动力学模拟,和基于相对可及表面积的隐性站点索引。
结合曲线 结合曲线能描述配体与蛋白质的结合行为。曲线可以通过它们的形状,S形或双曲线,来表征,从而观察蛋白质结合行为是相互合作的还是独立的。通常,x轴描述配体的浓度,y轴描述与所有可用结合位点结合的配体饱和度分数。Michaelis Menten方程通常用于确定曲线的形状。Michaelis Menten方程是基于稳态条件推导出来的,并解释了在溶液中发生的酶反应。然而,当反应发生而酶与底物结合时,动力学表现不同。
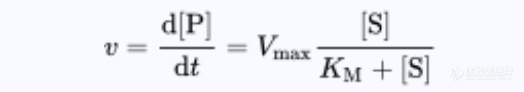
v=反应速度
Vmax =系统达到的最da速率
[S]=底物 S 的浓度
KM=米氏常数
在评估氧与血液中血红蛋白和肌红蛋白的结合亲和力时,结合曲线建模很有用。具有四个血红素基团的血红蛋白表现出协同结合,这意味着氧与血红蛋白上的血红素基团的结合会引起有利的构象变化,从而增加氧对下一个血红素基团的结合的有利性。在这些情况下,血红蛋白的结合曲线将是S形的,因为它对氧的结合有利性增加。由于肌红蛋白只有一个血红素基团,它表现出非合作结合,在结合曲线上呈双曲线。
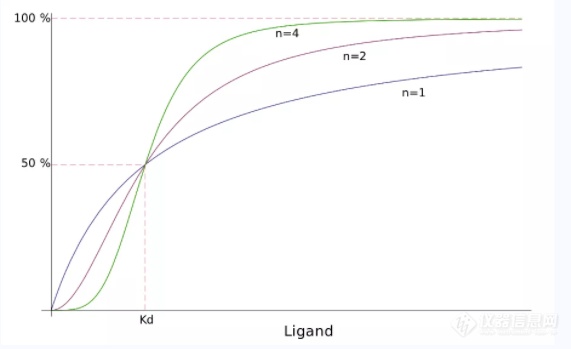
Hill's curves for cooperative ligand binding. Shown is the fraction of bound ligand as a function of the free ligand concentration. n=1 correspond to non-cooperative binding. n>1 corresponds to cooperative binding。
应用 不同生物体和人类之间的生化差异对于药物开发很有用。例如,青霉素通过抑制细菌酶DD-转肽酶来杀死细菌,破坏细菌细胞壁的发育并诱导细胞死亡。因此,结合位点的研究与许多研究领域相关,包括癌症机制、药物配方、和生理调节。抑制蛋白质功能的制剂是药物治疗的常见形式。
在癌症范围内,配体经过编辑以具有与天然配体相似外观,从而抑制肿瘤生长。例如,甲氨蝶呤,一种化疗药物,在二氢叶酸还原酶活性位点充当竞争性抑制剂。这种相互作用抑制四氢叶酸的合成,阻止DNA、RNA和蛋白质的形成。抑制此功能可抑制肿瘤生长并改善严重的银屑病和成人类风湿性关节炎。
在心血管疾病中,β受体阻滞剂等药物用于治疗高血压患者。β受体阻滞剂是一种抗高血压药物,可阻断肾上腺素和去甲肾上腺素激素与心脏和血管中的β1和β2受体的结合。这些受体通常介导交感神经的“作战或逃跑”反应,导致血管收缩。
竞争性抑制剂也应用在商业上。肉毒杆菌毒素,是一种神经毒素,由于与依赖乙酰胆碱的神经结合而导致肌肉弛缓性麻痹,这种相互作用抑制肌肉收缩,产生平滑肌。
展望 许多计算工具已经开发用以预测蛋白质上结合位点的位置。这些可以大致分为基于蛋白序列或基于蛋白结构。基于序列的方法依赖于一种假设,即蛋白质功能保守部分(例如结合位点)的序列是保守的。基于结构的方法需要蛋白质的3D结构。这些方法又可以细分为基于模板和基于口袋的方法。基于模板的方法是寻找目标蛋白质和具有已知结合位点的蛋白质之间的3D相似性。基于口袋的方法是在目标蛋白中寻找凹面或隐藏口袋,这些口袋具有疏水性和氢键结合能力等特征,使它们能够以高亲和力结合配体。尽管这里使用了“口袋”这个术语,但可以使用类似的方法来预测蛋白质-蛋白质相互作用中使用的结合位点,这些位点通常更平面,而不是在口袋中。
【9月特惠】月旭保护柱,秒杀价等你来!
南昌站-月旭科技邀您共聚制药行业质控技术大会
寻找色谱分析达人 月旭科技第一季“有奖征集”即刻开启
喜讯!月旭产品已远销94个国家和地区

相关产品

关注

拨打电话

留言咨询