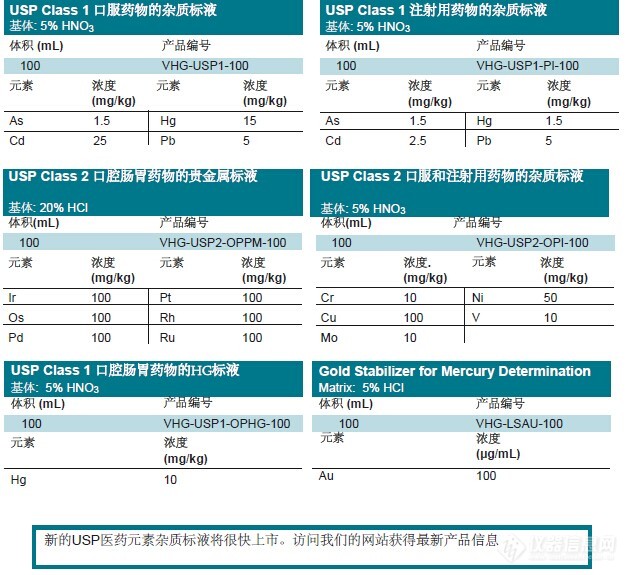
国内生产化药的企业,申请欧盟标准和美国标准的都应按照ICHQ3D检测要求进行,为辅助国内药企满足该ICHQ3D检测,LGC推出以下匹配元素标准溶液
1)什么是ICHQ3D检测?
ICH Q3D元素杂质检测指导原则,适用于化药的元素杂质要求,不适用于植物药、放射药、血浆衍生物、透析液等。 ICH Q3D列出了24种元素杂质的PDE标准(每日允许暴露量)。Q3D 给出了每个元素,如何进行的毒性分析,如何确定的PDE值。并且按照不同途径的毒性试验结果,计算得出不同途径(口服、肠外、吸入)的PDE标准。
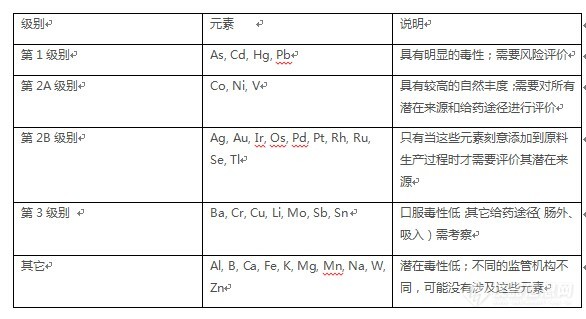
2)ICH Q3D检测 涉及的元素杂质简介
3)USP为了与ICH Q3D一致,USP<232>、<233>章节收入了Q3D中的15种,并在2015年12月1日成为正式稿。其中列出了规定元素的含量具体限度,生产商必须执行这些限度。
4)ICH Q3D化药元素杂质检测什么时间开始?
欧美药监机构对元素杂质要求的实施时间如下:
欧盟药监机构实施时间如下:
? 针对在欧盟的新药申请,实施时间为:2016年6月1日;
? 针对在欧盟已获许可的药品,实施时间为:2017年12月1日;
美国药监机构实施时间如下:
2016年6月30日,FDA发布了征求意见稿 — 药品中的元素杂质指导原则(Elemental Impurities in Drug Products),提出了元素杂质要求的实施时间,因为需要与USP协调,情况分类比较多。
? 针对USP药典品种,提交新的NDA、ANDA的,在2016年6月1日之后、2018年1月1日之前,针对USP药典品种,提交新的NDA、ANDA应该遵循ICH Q3D中所有元素杂质的建议;
在2018年1月1日之后,针对USP药典品种,提交新的NDA、ANDA应该符合USP<232>、<233>。USP<232>、<233>未包括、Q3D中包括的元素杂质,建议遵循Q3D。
? 针对非USP药典品种,申请人提交新的NDA、ANDA的,在2016年6月1日之后,针对非USP药典品种,申请人提交新的NDA、ANDA时,应该遵循Q3D。
? 针对USP药典品种,不是通过NDA、ANDA获批的,这种情况,例如:通过美国非处方药各论上市的产品,在2018年1月1日之后,应该符合USP<232>、<233>。在FDA进行现场检查的时候,应有能证明符合性的记录。USP<232>、<233>未包括、Q3D中包括的元素杂质,建议遵循Q3D,不得晚于2018年1月1日。
? 针对非药典品种,不是通过NDA、ANDA获批的,建议遵循Q3D,不得晚于2018年1月1日。在FDA进行现场检查的时候,应有能证明符合性的记录。
该征求意见稿还提出了已获批NDA、ANDA进行相关变更的途径,讲解了元素杂质控制的相关记录。
? 2018年1月1日(实施时间),USP<232>、<233>将适用于所有的USP各论品种。
LGC核酸合成仪MerMade养成记
LGC-ARMI MBH铝合金光谱标样
新能源锂电池矿产资源开采加工及其标准物质
LGC-ARMI MBH铝合金,性价比令人心动的品牌
相关产品
落地式光谱精磨磨样机HK350
落地式手动磨样机HK150EXS
手动压片机
电动压片机
LGC核酸合成仪MM192X/寡核苷酸合成仪/DNA合成仪/核酸合成仪
LGC核酸合成仪MM6/寡核苷酸合成仪/DNA合成仪/核酸合成仪
LGC核酸合成仪MM48X/寡核苷酸合成仪/DNA合成仪/核酸合成仪
LGC核酸合成仪MM12/寡核苷酸合成仪/DNA合成仪/核酸合成仪
发动机油CCS检测用标油
ASTM D 1200 流出杯式黏度计检测用黏度标液
LGC-Paragon 色度标准品
石化检测用的硫氮标样
LGC ARMI MBH工具钢光谱标样
LGC ARMI MBH轴承钢光谱标样
LGC ARMI MBH不锈钢光谱标样

关注

拨打电话

留言咨询