下游工艺先进性决定了药品的质量
抗体药物生产是个非常复杂的过程,大致分为上游的发酵及下游的分离纯化:上游工艺主要包括细胞复苏、传代、发酵生产。而下游工艺主要包括膜过滤及多步层析分离纯化。过去十多年来,基因工程获得突飞猛进的进步,细胞培养的表达量从原来的不到0.5 g/L 到现在普遍达到5g/L,有的甚至超过10g/L。这些进步是由细胞表达载体的开发,克隆筛选以及细胞培养基优化等技术创新所驱动的。由于发酵产率的大幅度提升,使得上游细胞培养成本大幅度降低,下表是抗体生产成本与表达量的关系。
表1.表达量与抗体生产成本关系
Titer(g/L) | Annual production(1000kg) | Disposable Material 物料成本($/g) Cell Culture Purification | Facilitiesc 厂房/设备/人工 | Formulation Cost ($/Vial) | Total Cost ($/Vial) 100 mg 1 g | |
0.5 | 1 | 20 | 4 | 100 | 4 | 22 |
134 | ||||||
2 | 4 | 4 | 4 | 25 | 4 | 13 |
43 | ||||||
5 | 10 | 2 | 4 | 10 | 4 | 12 |
26 | ||||||
与上游十多倍生产效率提升相比,下游分离纯化技术进步明显滞后,导致下游工序成为生产瓶颈,抗体主要生产成本也转移到下游。下游工艺在整个生物制药生产中占据60%以上生产成本,也被认为是最需要改进的技术领域。下游工艺先进性决定了药品的质量,及药品生产效率和成本,也成为生物制药企业的核心竞争力所在。由于生物分子由于结构复杂,对外部条件敏感,稳定性差,杂质多,浓度低等特点,且监管部门对生物药的纯度和质量要求越来越高。因此下游的分离纯化成为生物制药的瓶颈,也是生物制药成本最大的一块。层析技术由于具有分离纯化效率高,条件温和且容易保持目标分子的生物活性,因此层析是生物制药分离纯化最主要方法。
层析介质的“皇冠之珠”——令人爱恨交加的Protein A
生物大分子的层析方法主要分为亲和,离子交换,疏水作用及体积排阻。亲和层析是利用介质上的配基与目标蛋白分子有特异性结合,而对其它的蛋白质及杂质不吸附,因此杂质从层析柱中流出,被吸附的目标生物分子通过改变洗脱液的条件使被分离物质与配基解吸附,即可达到分离纯化的目的。亲和层析无疑是最理想的层析分离方法,其与其它分离方法如离子交换、疏水、体积排阻等最大的不同是由于亲和层析只与目标生物分子发生专一性吸附,其它杂质都不吸附,因此亲和层析分离纯化的工艺条件与杂质的组成及含量多少关系不大,从而大大简化亲和分离工艺开发方法,而其它分离方法如离子交换、疏水、体积排阻等都是基于目标分子跟杂质分子之间的大小,电荷及疏水强度的差异来分离的,因此即使分离纯化同样的目标分子,但不同样品的杂质组分不同,含量不同,纯化工艺方法就需要重新调整。
Protein A填料由于与大多数抗体有特异性吸附,因此被广泛地用于抗体药物生产过程中,极大地提高了抗体的分离纯化效率,毫无疑问Protein A 亲和介质是层析介质的皇冠上的明珠,其价格也是普通层析介质的十几倍。Protein A 亲和层析介质之所以会成为层析介质的贵族与它对抗体有特异性吸附有关。Protein A 亲和层析是利用Protein A 配基与目标抗体具有专一亲和吸附作用从而达到分离纯化抗体的目的。因为配基与目标抗体的作用的专一性,其分离纯化与目标样品抗体纯度无关,也与样品杂质含量和种类多少无关,使用Protein A 填料一步纯化目标抗体就可以达到95%纯度以上,回收率达到90%以上。Protein A 层析介质的出现,让抗体的分离纯化步骤及方法大大简化,使得抗体的分离纯化比其结构简单多的生物分子都要简单。抗体分离纯化基本都是标准化的三步曲,第一步用Protein A进行抗体捕获,第二步用阳离子去除多聚体,第三步用阴离子精纯去除剩余少量杂质。
Protein A亲和层析已经成为平台化技术,被广泛应用在抗体类分子捕获阶段。Protein A与抗体分子之间可特异性结合,特别对IgG1、IgG2、IgG4有较强亲和作用,使得抗体分子与发酵液中不具FC端结构的杂质如宿主蛋白与核酸等有效分离,进而达到纯化目的。亲和特异性赋予了Protein A填料捕获时可接受更宽泛的样品条件,如pH及电导率等。因此,发酵液通过离心、深层过滤后即可直接进行亲和捕获。另外与离子交换、疏水层析等方法相比,Protein A亲和层析纯化抗体料液可以获得更大的纯度,一步就可以获得抗体纯度大于98%,而且在回收率上也有明显优势,亲和捕获回收率可达95%。
抗体工作者对Protein A 是爱恨交加,爱的是Protein A 亲和层析的出现大大简化抗体的分离纯化工艺开发,并大幅度提高抗体纯化效率和纯度,而且几乎适用于所有抗体的分离纯化。恨的是Protein A 亲和介质价格贵,寿命短,占据下游分离纯化成主要本。虽然很多科学家曾经致力于研究新的价廉抗体亲和配基以取代昂贵的Protein A亲和配基,但都没有成功找到一个可以取代Protein A 配基的分子。Protein A亲和层析因其高度特异性及同时具有浓缩的效果成为过去近30年里抗体纯化捕获的金标准。
Protein A亲和层析介质贵的主要原因有两方面,一方面是Protein A 蛋白配基成本远比传统的小分子配基昂贵,另一方面,Protein A亲和填料寿命较短也是其成本过高的主要因素。一般离子交换填料使用寿命可高达1000次,而亲和填料寿命通常在100-200次。还有Protein A 介质贵与其一直处于高度垄断的局面也有关系,因此Protein A 亲和层析介质国产化以降低抗体的生产成本是必然的发展趋势。
ProteinA结构及作用机制
ProteinA蛋白是金黄色葡萄球菌细胞壁锚钉蛋白,其C端为细胞壁结合区域,抗体结合区域包括五个同源区域(E、D、A、B、C,N端顺序)。五个domain的序列同源率65-90%(图1)。
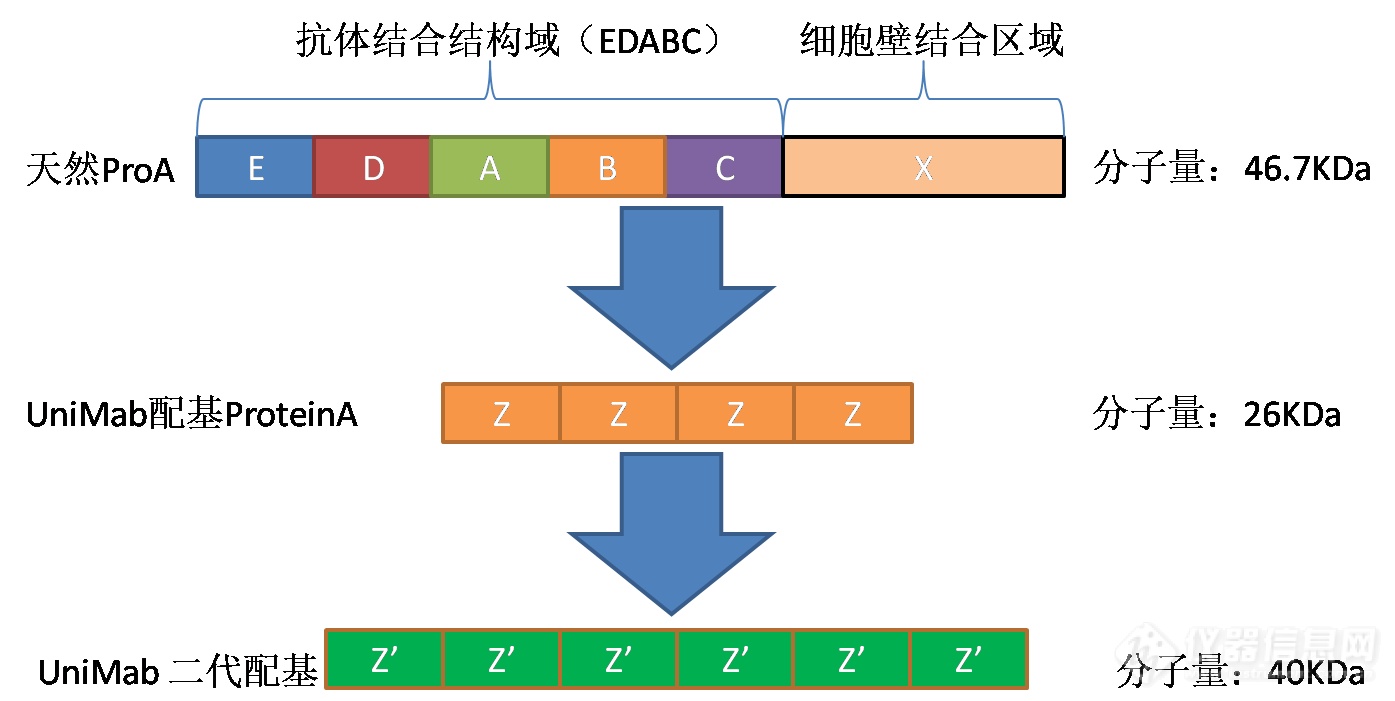
图1 重组与天然ProteinA基本性质
三维空间上,抗体FC端CH2-CH3区域与ProteinA蛋白B结构域上两条反相平行的α螺旋结构相互结合。抗体与ProteinA结合时,主要依靠的是疏水作用力,其次是氢键和双盐桥作用力。疏水作用主要来自于核心区域组氨酸残基。抗体上高度保守的组氨酸残基与ProteinA上的组氨酸残基发生相互作用。碱性或中性条件下,组氨酸残基不带电荷,其咪唑环的疏水效应的增强促进了FC端与ProteinA的结合。当pH降低至4.5以下时,组氨酸带上正电荷,于是两者产生静电排斥力,抗体从ProteinA上解离。除FC端恒定区域外,可变区VH3也参与了ProteinA结合及洗脱,影响洗脱pH(图2)。
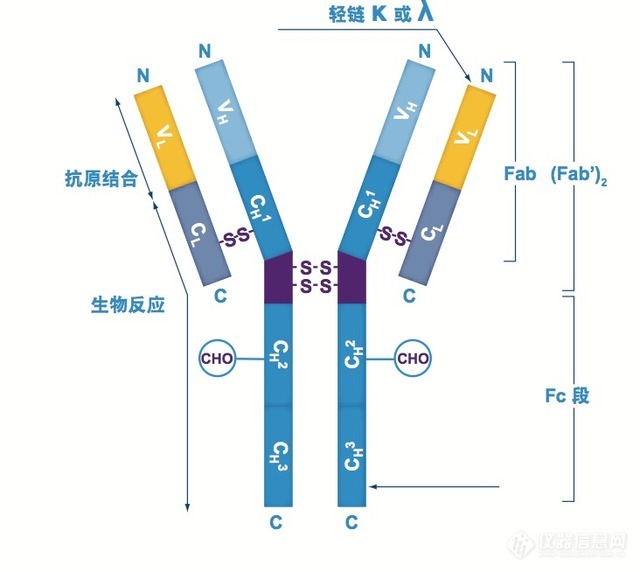

图2单抗分子结构 图3 抗体分子与ProteinA作用
Protein A来源于金黄色葡萄球菌的一个株系,它含有5个可以和抗体IgG分子Fc段特异性结合的结构域,当其作为亲和配基被偶联到填料基质上后,可特异性地与样品中的抗体分子结合,使其他杂蛋白流穿,借助高效亲和层析仅需一步就可使目标抗体纯度超过95%,此外Protein A也可结合另一些免疫球蛋白,如可用于某些种属IgA、IgM的纯化。由于Protein A亲和层析基于天然存在的生物大分子之间特异性结合为分离机理,这种得天独厚的势使得Protein A亲和层析成为重组蛋白\抗体等分离纯化中的绝佳选择(图3)。
下一期,江必旺博士将继续分享Protein A亲和填料的关键考核要素有哪些,敬请持续关注。
纳微科技Q3财报:营收2.1亿,同比增长34.61%
纳微科技接待25家机构调研,“填料+仪器”整合营销体系初见成效
新研发中心投资近2亿!纳微科技新大楼启用 加快色谱全产业链布局
《仪咖说》Vol.25直播预告:畅谈色谱“芯”——百亿微球市场突围之路

关注

拨打电话

留言咨询