在E1酶激活泛素(ubiquitin,Ub)和泛素样修饰因子(ubiquitin-like modifiers,Ubls)结合级联反应的一步时会激活UB和Ubls,因此它是针对癌症和其他致命疾病的治疗性干预手段的潜在靶标。
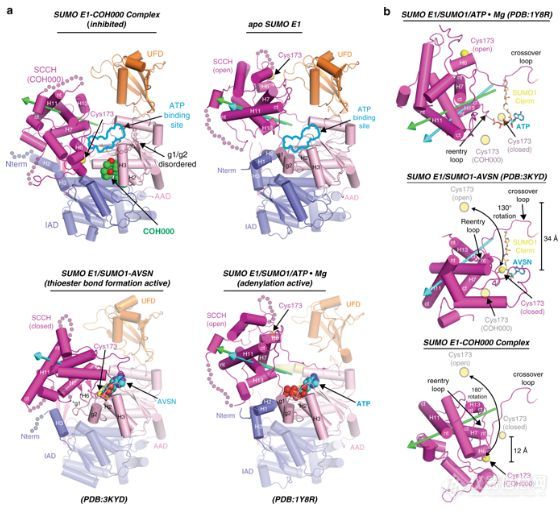
近日来自南卡罗莱纳医科大学(Medical University of South Carolina,MUSC)的研究人员报道了E1酶在Ubl与最近发现的高度特异性的共价变构抑制剂(COH000)形成复合物时的晶体结构,这个3D结构使得研究人员可以观察潜在的药物分子和靶标蛋白之间的相互作用。
研究人员发现COH000会靶向一个远离活性位点的神秘口袋,而过去的所有的关于SUMO E1结构的研究都忽略了这个位点,同时COH000结合SUMO E1的过程通过一系列结构变化来完成,最终将这个酶固定在过去没有发现的一种非活化构象状态下。这些结构变化包括一个活性位点的解组装和含有半胱氨酸的催化性SCCH结构域的180°旋转。
“我们正在学习自然的秘密——这些分子如何发挥功能,而我们通过一种我们可以看到的方法进行了研究。通过在分子水平对这些过程进行研究,我们可以更充分地利用它们。”该研究领导作者、MUSC生物学和分子生物学副教授Shaun Olsen说道。
总的而言,这项研究提供了一个关于COU000和它的SUMO E1特异性的抑制性机制的分子基础,同时还为开发靶向E1酶的神秘別构位点的分子提供了一个新的方向。研究人员接下来的计划是使用这些三维结构去设计特异性更强、抗癌活性更强的抑制剂。
细胞百科之--淋巴细胞
细胞死亡的术语
国庆放假通知
Hela细胞(海拉细胞系百科)
相关产品

关注

拨打电话

留言咨询