赤砂糖的还原糖滴定试验标定的时候终点是蓝变紫,复检滴定赤砂糖样液,滴定的时候一开始是黑绿色的,通过加量滴定才会有紫色沉淀,这时已经滴定过量了完全无法判断滴定终点,怎么办?求各位前辈指教。
梅特勒C30水分仪滴定池溶液发热,导致无法继续测定,是什么原因?
全自动电位滴定仪使用注意事项一、滴定喷嘴会和滴定液产生扩散吗?有什么影响呢?A) 如果喷嘴没有浸入滴定池的被测液内时,不会有扩散的现象。B) 如果喷嘴浸入滴定池的被测液内时,滴定液与被测液之间会产生扩散现象。C) 扩散的程度,滴定液与被测液的浓度差越大越容易产生扩散现象。但是,若喷嘴先端的毛细管部分因扩散所产生的液体存在时,该液体会抑制两者之间的扩散。D) 常规的酸碱滴定,或氧化还原滴定,其滴定液与被测液的浓度都很低,且滴定时间也短时,其所产生的扩散几乎不会影响滴定的结果数据。二、自动电位滴定仪的测量精度?自动注入器的精度与滴定液-被滴定的关系,将会影响测量的精度。A) 自动滴定注入器的精度;把吐出滴定液的喷嘴浸入被滴定液内的状态下滴定时,其精度为0.005~0.02mL左右。若把喷嘴不浸入被滴定液内时,其一滴约为0.01~0.05mL左右。所以说,滴定一滴(0.05mL)假设滴入与不滴入,其测量精度如如下;(1) 滴定量为10mL时,其精度为±0.5%,(2) 滴定量为1mL时,其精度为±5%。B) 滴定液-被滴定液的关系;有许多组合的关系,以下仅对酸碱滴定为例进行说明;(1) 若是使用如盐酸与苛性碱般的强酸与强碱水溶液的滴定时,因其反应速度极快,且其当量点也甚明确,故几乎无误差产生。(2) 另一方面,如石油的中和值测量法的酸价滴定时,因其为非水滴定的酸碱滴定,故其反应速度甚慢,且当量也不明确。所以其测值的重现性比水溶液滴定的测值来的差。三、应该采取多少的样品才够呢?采取的样品量,能使滴定后的总量达到5~10mL为目标值。四、何谓电位差?把导电性的固体浸在溶液内,则其固体与地线之间会产生电位。此电位因固体与溶液的各别形状的不同而异。若此固体为电极时,我们将可取得单极电极的电位。另外,氯化汞与氯化银之间的电位极为稳定,且其时常的重现性极佳。所以测量氯化汞,与氯化银或硫酸汞等为基准电极(称为比较电极)和其他电极(指示电极)的电位值称为电位差。
请教库仑法分析氯的原理及反应方程式?其滴定池构造如何?
用酸性铬兰K-萘酚绿B作指示剂,用5毫升1比1三乙醇胺,0.5mlKCN作屏蔽剂,氨水-氯化铵作缓冲剂,EDTA滴定,颜色变化由红色-紫色-蓝色,紫色变蓝色过渡时很缓慢,延迟。怎么解决?蓝色也不太好观察
[color=#656565][/color]锂电池水分检测及滴定技术对于保证电池最终的性能及保障电池的安全性至关重要,霍尼韦尔作为水分检测试剂的领导品牌,携手滴定仪器领导品牌瑞士万通,强强联合,为大家带来以下内容:[font='Calibri',sans-serif] 1. [/font]电解液水分测试技巧;[font='Calibri',sans-serif] 2. [/font]极片水分测试技巧;[font='Calibri',sans-serif] 3. [/font]霍尼韦尔锂电池测试整体解决方案;[font='Calibri',sans-serif] 4. [/font]电位滴定在锂电行业应用方法汇总;[font='Calibri',sans-serif] 5. [/font]电位滴定仪最新发展情况。[font=宋体]会议时间:[/font]8[font=宋体]月[/font]26[font=宋体]日[/font]14:00[font=宋体]主讲老师:[/font][font=宋体]张彦华 -- [/font][font=宋体]霍尼韦尔高级技术支持工程师[/font][font=宋体]龚雁 -- [/font][font=宋体]瑞士万通中国区产品经理[/font][font=宋体]报名地址:[url=https://www.instrument.com.cn/webinar/meeting_15363.html]点击打开链接[/url][/font][img=,531,293]https://ng1.17img.cn/bbsfiles/images/2020/08/202008211807292499_2670_2507958_3.jpg!w531x293.jpg[/img][font=宋体]欢迎报名参加![/font]
电位滴定仪主要用于高等院校、科研机构、石油化工、制药、药检、冶金等各行业的各种成分的化学分析。电位滴定的基本仪器装置包括滴定管、滴定池、指示电极、参比电极、搅拌器,测电动势的仪器。 电位滴定法是如何确定滴定终点的呢?用绘制电位确定曲线的方法。电位滴定曲线即是随着滴定的进行,电极电位值(电池电动势)E对标准溶液的加入体积V作图的图形。根据作图的方法不同,电位滴定曲线有三种类型,E-V曲线,普通电位滴定曲线,拐点e即为等当点。 如果使用自动电位滴定仪,在滴定过程中可以自动绘出滴定曲线,自动找出滴定终点,自动给出体积,滴定快捷方便。 电位滴定法是在滴定过程中通过测量电位变化以确定滴定终点的方法,和直接电位法相比,电位滴定法不需要准确的测量电极电位值,因此,温度、液体接界电位的影响并不重要,其准确度优于直接电拉法,普通滴定法是依靠指示剂颜色变化来指示滴定终点,如果待测溶液有颜色或浑浊时,终点的指示就比较困难,或者根本找不到合适的指示剂。电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定到达终点前后,滴液中的待测离子浓度往往连续变化n个数量级,引起电位的突跃,被测成分的含量仍然通过消耗滴定剂的量来计算。 使用不同的指示电极,电位滴定法可以进行酸碱滴定,氧化还原滴定,配合滴定和沉淀滴定。酸碱滴定时使用PH玻璃电极为指示电极,在氧化还原滴定中,可以从铂电极作指示电极。在配合滴定中,若用EDTA作滴定剂,可以用汞电极作指示电极,在沉淀滴定中,若用硝酸银滴定卤素离子,可以用银电极作指示电极。在滴定过程中,随着滴定剂的不断加入,电极电位E不断发生变化,电极电位发生突跃时,说明滴定到达终点。用微分曲线比普通滴定曲线更容易确定滴定终点。 电位滴定法比起用指示剂的容量分析法有许多优越的地方,首先可用于有色或混浊的溶液的滴定,使用指示剂是不行的;在没有或缺乏指示剂的情况下,用此法解决;还可用于浓度较稀的试液或滴定反应进行不够完全的情况;灵敏度和准确度高,并可实现自动化和连续测定。因此用途十分广泛。
滴定应用问题解答问:我的电极该保存在哪里?答:要保存一支复合电极,理想的情形是电极处于平衡状态。主要是指电极的参比部分,其经常发生电解质的流动。多数情况下,最佳的介质是电极参比系统所用的电解质,因为这样能保证液络部没有电解质流动。对于半电池电极,有三种主要类型:第一种自然是pH半电池,其最佳的保存介质是pH7缓冲液。第二种常用的半电池则是离子选择性电极(ISE)。短期保存时使用被测离子的稀释溶液(0.001M)能保证电极始终处于备用状态;长期保存时,大多数ISE则干藏。第三种半电池是双液络部(或单液络部)参比电极。如果短期的话,这种电极应保存在盐桥电解质中,如长期则须清空并干藏。问:我该用哪种电极进行非水滴定?答:总的来说,进行非水滴定时有三种主要电极问题。第一个是水性电解质和非水溶剂的问题。更换电极电解质马上就能解决问题。第二个问题与样品不导电有关,其会导致测量和参比半电池间或复合电极的某些部分的电路不畅,从而使信号噪声大,这种情况在使用带标准陶瓷液络部的参比电极时尤为突出。这个问题的部分解决方法是使用DG113之类带伸缩性液络部的电极。该电极的电解质为LiCl乙醇溶液,其伸缩性液络部增大了测量和参比部分的接触面,因此降低了噪声。第三个问题则非电极本身的问题,而更多涉及到电极保养。要使一支pH复合电极正常工作,需要氢化电极膜(电极泡)。将电极置于去离子水中调节。在非水滴定中该电极膜会逐渐脱去氢离子并降低电极的响应速度。所以,要避免这种现象发生,电极需要经常浸没在水中反复调节。问:为何我得到的结果是预期的一半或两倍?答:出现这种现象的原因有两个:一个是滴定管体积设得不对,如在用20ml滴定管时却错误地在仪器中输入10ml,这样,得到的结果会是预期的一半。第二个原因是当量数或化合价z的设定值出现计算问题。这时,您必须确保滴定至正确的等当点。例如,用HCl滴定碳酸钠,如果滴定在第一个等当点终止,那么在写化学反应方程式时碳酸根的当量数应该是1而非2。原因是该反应分两步进行,碳酸根先反应生成碳酸氢根且只有这样才随后生成二氧化碳、氯化钠和水。如果反应持续进行直至看见气泡(生成二氧化碳),则z应该为2。问:为何我得不到结果,或结果为0,而从曲线看,突跃很明显?答:发生这种情况有几个原因,多数是由于方法中的阈值设得太大。将测量数值表打印出来并查看一阶导数的最大值。方法中的阈值必须设得比该值低。通常情况下,我们建议在滴定曲线陡峭时将阈值设成一阶导数最大值的50%左右,滴定曲线平坦时最多设成80%。请记住:得不到结果还与趋势(滴定曲线的走向)定义错误及等当点范围选错有关。
寒冷的冬天,要是遇到要滴定的样品怎么办?滴定终点会延迟,对滴定结果有影响吗?要怎么解决!说说大家的经验或者建议!
在NaOH标准滴定溶液滴定盐酸中,若酚酞指示用量过多则会造成终点( )。(A)提前到达 (B)推迟到达 (C)正常到达 (D)无影响
电位滴定中的滴定模式有动态滴定、等量滴定、设定终点滴定都是什么滴定方法?还有就是一般的容量法卡氏水分滴定仪能用自动电位滴定仪来代替吗?
滴定管洗净后,通常用蒸馏水润洗三次,(此时蒸馏水可以从滴定管的尾部出水),那么到装滴定液的时候,滴定管也要润使滴定管三次(此时的滴定液可否从滴定子管的尾部出液?)这个问题很多同事都不能确定。有的认为“要从滴定管的尾部出,这样可以保证滴定管完全被滴定液润使干净。”但又有些同事认为:“装上滴定液后不能从尾部出,因放滴定液时管的尾部已被滴定液冲净了,如从尾部出的话,容易把最后几滴外流到滴定管外,再第二次装液体时,手就容易接触到液体了,万一是硝酸银滴定液的话,手容易变黑了。”在此请教各位大侠,我们应该如何做得正确,请大家参与讨论,谢谢!
第一节滴定分析法概述教学目的:1、了解滴定分析的特点及分类。2、掌握基准试剂、标准溶液、指示剂、滴定终点和滴定误差的概念。3、理解酸碱指示剂的特点、变色原理、变色范围、影响变色范围的因素。4、了解混合指示剂。教学重点:基准试剂和标准溶液;酸碱指示剂。教学内容: 一、滴定分析法的特点及分类1、基本概念滴定分析法(titrimetric analysis):将一种已知其准确浓度的试剂溶液(标准溶液-standard solution)通过滴定管滴加到待测组分的溶液中,直到所加标准溶液和待测组分恰好完全定量反应为止,(这时加入标准溶液物质的量与待组分的物质的量符合反应式的化学计量关系),然后根据标准溶液的浓度和所消耗的体积,算出待测组分的含量。标准溶液:已知准确浓度的试剂溶液。 滴定:滴加溶液的操作过程。滴定剂:滴加的溶液化学计量点(stoichiometric point):当滴加的标准溶液与待测组分恰好定量反应完全时的一点。指示剂(indicator):为判断理论终点的到达而加入的一种辅助试剂。滴定终点(end point of the titration)
目前一般实验室滴定分析采用的是人工滴定法,它是根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果。自动电位滴定法是通过电位的变化,由仪器自动判断终点。为了比较仪器和人工滴定方法的测定结果,我们选用了酸价和过氧化值两个指标,分别用自动电位滴定法和人工滴定法进行样品分析。 1 实验部分 1.1 自动电位滴定法的实验仪器 瑞士万通(METROHM)751GPD自动电位滴定仪 727磁力搅拌滴定台 10ml交换单元 6.0431.100Pt电极 6.0133.100pH玻璃电极 6.0729.100Ag/AgCl参比电极 6.0331.0Pt辅助电极 1.2 人工滴定法 按照GB/T5009.37—1996的方法测定样品中的酸价和过氧化值。 2 实验结果与讨论 2.1 两种滴定方法的测定结果对照 自动电位滴定法和人工滴定法测定植物油的酸价和过氧化值结果无显著性差异,表明自动电位滴定仪测定植物油酸价和过氧化值,与现行的国家卫生标准滴定方法结果相近。 2.2 两种滴定方法的精密度比较 选用酸价值较高的样品,分别用自动电位滴定法和人工滴定法平行测定5次,自动电位滴定法测定的相对标准偏差1.1%,人工滴定法为1.6% 平行测定酸价值较低的样品5次,自动电位滴定法测定的相对偏差为2.1%,而人工滴定法的相对标准偏差高达11.4%,表明自动电位滴定法的精密度优于人工滴定法。 综上所述,自动电位滴定法测定结果与国标法无异,精密度达到检验要求。由于自动电位滴定法是根据滴定曲线的一阶导数确定终点,等当点与终点的误差非常小,准确度高,避免了人工滴定法由于要加指示剂可能因加入量、指示终点与等当量间、操作者对颜色判断等的误差 电动定位滴定法无须使用指示剂,故对有色溶液、浑浊度以及没有适合指示剂的溶液均可测定 Metrohm自动电位滴定仪可判断多达9个等当点,可以连续滴定溶液中的多个成分,如连续滴定水样中Ca2+、Mg2+,滴定混合酸。自动电位滴定仪还能对滴定分析的各种测定参数,例如测定日期、仪器型号、滴定用标准溶液的消耗量、滴定曲线作自动记录,并自动计算打印出测定结果作为原始记录保存,减少了分析者原始记录数据处理的工作量和运算差错,提高了实验室间分析结果的可比性,有利于实验室管理,因此适于理化分析实验室用作代替人工操作的分析仪器。
硫代硫酸钠应放在碱式滴定管还是酸式滴定管中进行滴定?有没有官方文件规定?大家乍么做的?碱式滴定管理由:配制硫代硫酸钠时需加入少量的碳酸钠使溶液的pH值保持在9-10左右,以防细菌滋生和硫代硫酸钠变质而析出硫,因此其溶液呈弱碱性,建议用碱式滴定管。酸式滴定管理由:硫代硫酸钠溶液虽然呈碱性,但是水解后有S析出,S对乳胶管会起老化作用,相对与其碱性对酸式滴定管的危害远远低于析出S(硫)对碱式滴定管乳胶管的危害,所以要用酸式滴定管。两者皆可理由:硫代硫酸钠见光易分解,呈弱碱性,故最好用棕色碱式滴定管。当然见光分解也不是一下就完成了的,短时间也不会影响滴定结果,没棕色时也可用白碱式滴定管。既然是弱碱性,也不是短时间就能让活塞受损,所以用酸式也不会出问题。
温度滴定与电位滴定的比较1.每种不同类型的电位滴定,你需要不同的探头:对于酸碱滴定,需要一个pH探头;对于氧化还原滴定,需要一个氧化还原探头;对于氯化物的滴定,需要氯化物ISE或者银电极;对于EDTA滴定,需要根据不同的组分选择特殊的ISE。这样的离子举不胜举。我们不希望如此复杂,是不是?使用温度滴定,一个简单的温度探头就可以进行全部的测定。2.电位滴定是以通过滴定试样的电流的量来记录可测量的电位差。这就阻碍了在非电导液环境中的滴定,例如,很多的非水溶液。pH探头在这样的条件下测量的效果就非常差。相反,温度滴定仅需要知道温度的变化速率,与是否是水溶液还是非水溶液无关。温度滴定拓展了滴定的应用领域,给创造性的分析化学家们提供了一个解决问题的万能的工具。3.许多电位探头具有有限的使用寿命,因为它们的传感膜在连续的置于腐蚀溶液和污垢中后会失去传感能力。而且,它们需要参比电极,这些电极特别容易受到污垢的影响。相反,温度探头的寿命非常的长。即使生成凝胶沉淀,探头也可以用牙刷简单的清洗。4.温度探头不需要经常校准。事实上,它们根本不需要校准,因为仅仅重要的只有温度的变化率,而不是溶液的绝对温度。

拆修梅特勒DL18水份滴定仪,改装主板电池,让老仪器焕发活力一台1992年梅特勒(Mettler)公司DL18(卡尔·费休)水份滴定分析仪,那真是“皮实”,用了近20年。公司搬迁,封存了一段时间,最近拿出来使用,自检显示“Err3”数据记忆错误,不能开机。拆机检查,发现主板电池漏液,腐蚀了周边线路造成的故障。该电池采用的是1.2V×2镍镉充电电池,固定在主板上的,不能自主更换。21世纪了,这难不到我,从旧计算机主板上拆卸一个电池座,装在DL-18主板上,清洁电路板、补焊被腐蚀的线路,安上计算机纽扣电池,试机OK!一、卡尔·费休法检测微量水份原理: 卡尔·费休法是测定各种物质中微量水份的一种方法。这种方法自从1935年由卡尔·费休提出,它利用甲醇和吡啶存在的情况下,滴加入适当量的碘,水与碘和亚硫酸发生定量化学反应的原理,使用一支双铂电极,其两极加有电流源,把极化电极针两端测得的电压作为输入信号用于控制滴加碘,在滴定完最后一滴痕量水时,电压降到零。过量碘的存在,使电极去极化,小电流在一个电极上氧化碘离子、在另一个电极上还原等量的碘分子,根据碘的消耗量测出水份含量。该法检测精度很高,但试剂的成本也很昂贵,安装麻烦,电路复杂。国际标准化组织把这个方法定为国际标准测微量水份,我国也把这个方法定为国家标准测微量水份。二、仪器电路原理:首先由Z8单片机诊断仪器状况(自检),仪器正常时,反馈信号经机内A/D转换再经数字滤波,输出一个电压控制信号。此信号经过压控电流源变换后加到测量电极上,测量电极信号送至单片机。电极的电流经运算放大器转换成电压信号,输入到由LM331N 构成的精密电压频率转换器(V/F变换器)。由单片机对V/F变换后的频率进行累加积分。将此积分结果计算出水分含量。单片机还负责完成频率响应,控制滴定管步进电机、信息显示,与计算机、电子天平、打印机的通讯功能等。 三、拆机检修过程,并简要分析元件功能:仪器外貌:开机自检显示“Err3”数据记忆错误http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647819_1807987_3.jpg仪器后部:气泵(抽排液用)、电源插座、开关、电极信号线插头http://ng1.17img.cn/bbsfiles/images/2012/10/201210121901_396278_1807987_3.jpg滴定管(10ML)、滴定池(烧杯):http://ng1.17img.cn/bbsfiles/images/2012/10/201210121905_396279_1807987_3.jpg滴定管结构:由步进电机驱动活塞杆滴液(类似注射器)http://ng1.17img.cn/bbsfiles/images/2012/10/201210121906_396280_1807987_3.jpg滴定池配的是高品质德国Schott(肖特)150ML实验室DURAN硼硅玻璃烧杯,用了近20年,还是光亮如新,烧杯中的白色胶囊状物体是磁力搅拌子。(DURAN硼硅玻璃所能承受的最高操作温度为500°C, 耐热冲击性能是普通玻璃三倍以上,可冷却至最大极限的零下温度,约-192°C,即使最恶劣骤冷骤热也不会炸。)http://ng1.17img.cn/bbsfiles/images/2012/10/201210121907_396281_1807987_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/10/201210121907_396282_1807987_3.jpg卸下底板5颗螺丝(红线标示):http://ng1.17img.cn/bbsfiles/images/2012/10/201210121909_396284_1807987_3.jpg商标贴在底板上,Mettler-Toledo(梅特勒-托利多)公司,瑞士原产:http://ng1.17img.cn/bbsfiles/images/2012/10/201210121910_396285_1807987_3.jpg取出电路板:http://ng1.17img.cn/bbsfiles/images/2012/10/201210121911_396286_1807987_3.jpg主板PCB(印刷电路板)的背面:http://ng1.17img.cn/bbsfiles/images/2012/10/201210121911_396287_1807987_3.jpg取出电路板后,仪器内部的电源、旋转磁力及滴定管机电驱动、面板轻触按钮排线部分:http://ng1.17img.cn/bbsfiles/images/2012/10/201210121912_396288_1807987_3.jpg步进电机:http://ng1.17img.cn/bbsfiles/images/2012/10/201210122013_396354_1807987_3.jpg步进电机通过减速齿轮驱动活塞杆上下移动,活塞杆的极限位置由上下两个行程限位开关控制:http://ng1.17img.cn/bbsfile
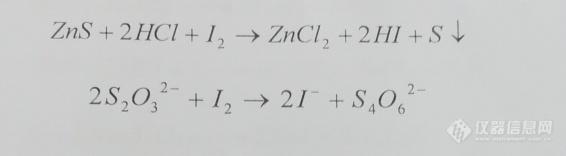
[img=,566,156]https://ng1.17img.cn/bbsfiles/images/2020/12/202012251619272861_3850_4122212_3.png!w566x156.jpg[/img]请问谁知道这两个反应的滴定终点(电位突越点)是多少。第一个是滴定硫氢根离子,第二个是滴定硫代硫酸钠。第二个我用氧化还原电位仪器测是大约在250MV左右。第一个没有测出具体数值。
想和大家讨论一下,手工滴定和电位滴定的等效性问题,药典中很多都是用手工滴定来做的,现在我们想用自动滴定仪完成手工滴定,方法也已经在仪器上编好,能否用自动滴定代替手工滴定呢?依据是什么?如果可以,该如何做方法验证?只是做两个方法的结果对比还是要像常规的方法验证那样需要做精密度,准确度等项目的考察?
上海精密科学仪器的ZDJ-4A型自动电位的滴定仪,用硫酸锌滴定亚铁氰化钾,如何判断滴定终点?该仪器有预设终点滴定模式,是否使用该模式可以直接得到滴定终点的电动势?
现在我在用电位滴定仪去滴定弱碱性化合物,不知道1mol高氯酸怎么和弱碱性的仲胺反应,基于什么原理
1. 每种不同类型的电位滴定,你需要不同的探头:对于酸碱滴定,需要一个pH探头;对于氧化还原滴定,需要一个氧化还原探头;对于氯化物的滴定,需要氯化物ISE或者银电极;对于EDTA滴定,需要根据不同的组分选择特殊的ISE。这样的离子举不胜举。我们不希望如此复杂,是不是?使用温度滴定,一个简单的温度探头就可以进行全部的测定。 2. 电位滴定是以通过滴定试样的电流的量来记录可测量的电位差。这就阻碍了在非电导液环境中的滴定,例如,很多的非水溶液。pH探头在这样的条件下测量的效果就非常差。 相反,温度滴定仅需要知道温度的变化速率,与是否是水溶液还是非水溶液无关。温度滴定拓展了滴定的应用领域,给创造性的分析化学家们提供了一个解决问题的万能的工具。 3. 许多电位探头具有有限的使用寿命,因为它们的传感膜在连续的置于腐蚀溶液和污垢中后会失去传感能力。而且,它们需要参比电极,这些电极特别容易受到污垢的影响。相反,温度探头的寿命非常的长。即使生成凝胶沉淀,探头也可以用牙刷简单的清洗。 4. 温度探头不需要经常校准。事实上,它们根本不需要校准,因为仅仅重要的只有温度的变化率,而不是溶液的绝对温度。
今天看到一个有关容量器具校验周期的规定:具塞滴定管校验周期为3年,无塞滴定管校验周期为1年。仔细想了想,我们实验室的滴定管好象都是具塞的,按3年的周期校验的,无塞滴定管是什么样的滴定管呢?
用2,2-DMP作滴定剂进行的温度滴定水分分析法是一种比传统的卡尔费希尔(K-F)方法更优越的滴定法。相比KF的试剂,DMP具有稳定性、低毒性,并可应用于更广范围的滴定实验。与自从1935 年就开始被采用的传统的卡尔费希尔(KF)方法相比,运用DMP的温度滴定法在下列领域提供了如下优势:1、毒性:DMP毒性很低,KF试剂含有嘧啶(或其它含氮有机化物)、碘、和二氧化硫。2、稳定性:DMP特别稳定性,无需采取预防措施。无需在每次滴定前标定。 KF 试剂天生不稳定,需要频繁的重复标定,并且必须采取特别的预防措施才能存放。3、多功能性:使用DMP试剂的温度滴定可运用于K-F试剂不能使用的试样,或会易受到干扰的试样。例如强酸、含胺的、硫磺化合物,或者氧化还原试剂。4、传感器:温度滴定仪配用一个灵敏而强劲的热敏电阻,它不受阻塞的影响。5、废物的处理。 通常不受严格标准的限制。6、应用广泛,可以测定食物、油、药物、聚合物、氧化剂、催化剂和矿物中的水分(包括PPM含量的水分) 所有的滴定分析都是由位于美国费城的F.A.C.T.S公司生产的FACTS(全自动计算机控制滴定系统)完成的。滴定系统配有一台热敏电阻的传感器和一块温度滴定板,控制板主要由一条惠斯通电桥构成。滴定是在一个绝缘的带有磁力搅拌器的容器中完成的。和KF滴定仪不同的是,FACTS滴定分析平台可用于数百种不同的温度、电位、电导和光度的滴定应用。[em02] [em01]
一般常规容量法滴定,滴定剂浓度要进行温度补正,滴定管要进行体积补正?那么电位滴定仪是否需要补正呢?
请问大家做滴定分析还是用手动的滴定管滴定吗
该用哪种电极进行非水滴定?总的来说,进行非水滴定时有三种主要电极问题。第一个是水性电解质和非水溶剂的问题。更换电极电解质马上就能解决问题。第二个问题与样品不导电有关,其会导致测量和参比半电池间或复合电极的某些部分的电路不畅,从而使信号噪声大,这种情况在使用带标准陶瓷液络部的参比电极时尤为突出。这个问题的部分解决方法是使用DG113之类带伸缩性液络部的电极。该电极的电解质为LiCl乙醇溶液,其伸缩性液络部增大了测量和参比部分的接触面,因此降低了噪声。 第三个问题则非电极本身的问题,而更多涉及到电极保养。要使一支pH复合电极正常工作,需要氢化电极膜(电极泡)。将电极置于去离子水中调节。在非水滴定中该电极膜会逐渐脱去氢离子并降低电极的响应速度。所以,要避免这种现象发生,电极需要经常浸没在水中反复调节。
滴定完剩在滴定管里的溶液是放掉还是保存在滴定管里?
滴定分析法,作为一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度,滴定分析可算是实验室中最最常用的定量方法啦,很多人都有一个疑问,如果滴定分析结果总是超出了误差范围怎么办?总的来说,对于任何滴定分析,都要首先了解什么样的精度要求才是有意义的并且是必须的,之后如果发现一些结果还是超出了误差范围,你就要从以下几点去找原因:1.待测样品是否在整个样品中具有代表性?换句话说,你应该从取样时就开始寻找可能的错误。“分析结果仅代表实际被分析的样品的结果。”也许在实际测量前,样品可能来自于一个没有混合均匀的容器。亦或在取样后,样品暴露在不同的环境条件下。例如样品在滴定前放置不同的时间段,就会吸收不同量的空气中的二氧化碳。在样品转换器上用敞开式的滴定容器时,就应考虑到这一点。因此我们建议先将滴定容器密闭起来,再在滴定开始之前,用一种特殊装置将其打开(Cover- UpTM),就象Rondo样品转换器上的那种。2. 用多少样品来做分析?对于极少量的样品的分析,天平的性能就至关重要。那么进行一次最小称样量的测试就可以了解天平是否符合要求。3. 如果是滴定仪自身的问题,可从以下几个方面来做检查:a) 馈液管的末端是否有虹吸滴定头,并且工作是否正常?该滴定头是为了防止滴定剂扩散到样品中去。如果失去滴定头,滴定剂就会流入到滴定池中,并和样品反应。但这部分的消耗量是不被计算在内的,因此就能导致比较大的标准偏差。b) 滴定管应检查是否漏气。如果接头没有拧紧或阀的工作不正常,就可能出现漏液。在这种情况下,并不是所有滴定仪馈送的滴定剂都加入到样品中去。由于这种影响不具有重复性,就会导致较大的标准偏差。c) 滴定管中存在有气泡。这通常是由滴定剂中所溶解的气体如CO2、SO2或O2造成的。因此滴定剂在使用前应有个脱气过程,如放置在超声波水浴中。滴定瓶托架作为滴定仪的一个附件可以将滴定瓶提升至与滴定管一样的高度,这就确保在充满滴定管时不会出现负压而造成脱气。卡尔菲休滴定所用试剂由于溶解有SO2,对此极为敏感,因此,在DL31/DL38卡尔菲休滴定仪中,可以适当降低其充液速度。适合滴定分析的化学反应应该具备以下几个条件:(1)反应必须按方程式定量地完成,通常要求在99.9%以上,这是定量计算的基础。(2)反应能够迅速地完成(有时可加热或用催化剂以加速反应)。(3)共存物质不干扰主要反应,或用适当的方法消除其干扰。(4)有比较简便的方法确定计量点(指示滴定终点)。滴定分析法分类1.直接滴定法所谓直接滴定法,是用标准溶液直接滴定被测物质的一种方法。凡是能同时满足上述3个条件的化学反应,都可以采用直接滴定法。直接滴定法是滴定分析法中最常用、最基本的滴定方法。例如用HCl滴定NaOH,用K2Cr2O7滴定Fe2+等。往往有些化学反应不能同时满足滴定分析的三点要求,这时可选用下列几种方法之一进行滴定。2.返滴定法当遇到下列几种情况下,不能用直接滴定法:第一,当试液中被测物质与滴定剂的反应慢,如Al3+与EDTA的反应,被测物质有水解作用时。第二、用滴定剂直接滴定固体试样时,反应不能立即完成。如HCl滴定固体CaCO3。第三,某些反应没有合适的指示剂或被测物质对指示剂有封闭作用时,如在酸性溶液中用AgNO3滴定Cl- 缺乏合适的指示剂。对上述这些问题,通常都采用返滴定法。返滴定法就是先准确地加入一定量过量的标准溶液,使其与试液中的被测物质或固体试样进行反应,待反应完成后,再用另一种标准溶液滴定剩余的标准溶液。例如,对于上述Al3+的滴定,先加入已知过量的EDTA标准溶液,待Al3+与EDTA反应完成后,剩余的EDTA则利用标准Zn2+、Pb2+或Cu2+溶液返滴定;对于固体CaCO3的滴定,先加入已知过量的HCl标准溶液,待反应完成后,可用标准NaOH溶液返滴定剩余的HCl;对于酸性溶液中Cl-的滴定,可先加入已知过量的AgNO3标准溶液使Cl-沉淀完全后,再以三价铁盐作指示剂,用NH4SCN标准溶液返滴定过量的Ag+,出现2+淡红色即为终点。3.置换滴定法对于某些不能直接滴定的物质,也可以使它先与另一种物质起反应,置换出一定量能被滴定的物质来,然后再用适当的滴定剂进行滴定。这种滴定方法称为置换滴定法。例如硫代硫酸钠不能用来直接滴定重铬酸钾和其他强氧化剂,这是因为在酸性溶液中氧化剂可将S2O32-氧化为S4O62-或SO42-等混合物,没有一定的计量关系。但是,硫代硫酸钠却是一种很好的滴定碘的滴定剂。这样一来,如果在酸性重铬酸钾溶液中加入过量的碘化钾,用重铬酸钾置换出一定量的碘,然后用硫代硫酸钠标准溶液直接滴定碘,计量关系便非常好。实际工作中,就是用这种方法以重铬酸钾标定硫代硫酸钠标准溶液浓度的。4.间接滴定法有些物质虽然不能与滴定剂直接进行化学反应,但可以通过别的化学反应间接测定。例如高锰酸钾法测定钙就属于间接滴定法。由于Ca2+在溶液中没有可变价态,所以不能直接用氧化还原法滴定。但若先将Ca2+沉淀为CaC2O4,过滤洗涤后用H2SO4溶解,再用KMnO4标准溶液滴定与Ca2+结合的C2O42-,便可间接测定钙的含量。显然,由于返滴定法、置换滴定法、间接滴定法的应用,大大扩展了滴定分析的应用范围。滴定结果有误,总是预期值的一半或两倍,不知道为什么?这可能有多种原因。结果恰好是预期值的一半或两倍说明这是由于系统误差造成的。首先要做的就是在安装数据中检查为滴定剂所设定的滴定管体积是否与实际相符。滴定剂清单包含所有与滴定剂相关的信息:名义浓度,滴定管体积,所在驱动器以及在滴定度测定后自动储存的当前滴定度值。如果指定的是5mL的滴定管,但实际使用了10mL的滴定管,那么计算结果就只有预期值的一半,反之亦然。 另一种原因可能在于滴定剂的浓度。在结果的计算过程中,名义浓度乘以滴定度才能得到实际浓度,因此错误的名义浓度就可能导致错误的结果。例如:在滴定剂清单中给出的NaOH浓度是0.5 mol/L,而实际上你用的是1.0mol/L的溶液,那么你的结果也就只有预期值的一半了。此外,滴定反应的平衡数z也必须准确,也就是要知道反应的化学计量关系是什么,是不是1:1的反应。错误的平衡数也必将导致结果变成预期值的一半或两倍。终点滴定和等当点滴定有何区别?终点滴定(EP)指传统的滴定步骤:滴定剂持续加入直至反应终止,如用指示剂指定时观察到颜色的变化。对于全自动电位滴定仪来说,持续滴定样品直至达到原先设定的某值,如pH=8.2。等当点是被分析物和试剂的浓度正好相同的那个点。多数情况下,该点完全等同于滴定曲线的回归点,如酸/碱滴定的滴定曲线。曲线的回归点由相应的pH或电位值及滴定剂消耗量(mL)来定义。等当点由浓度已知的滴定剂的消耗量计算得出。通过浓度和滴定剂消耗量能算出已与样品反应的物质的量。全自动电位滴定仪根据滴定曲线应用专用数学评估步骤评估测量点,然后再依据这条评估后的滴定曲线计算出等当点。天平的精度该为多少才能保证获得准确及精
放慢滴定速度平衡时间自动增长?那么滴定终点时tmax稍微超出设定值,是不是要增加tmax?如设定值为30s,而实际上是31s,这是否正常?我的样品溶液有点粘稠,是不是应该选择较大的tmax?