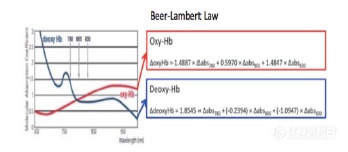
了解大脑的巨大挑战:采用功能性近红外光谱法进行神经成像
耶鲁医学院神经生物学和精神病学教授Joy Hirsch博士 在生命科学的所有挑战中,对大脑的了解是难中之最。大脑是人体最复杂的器官,拥有超过1千亿个神经元和其他细胞,形成了超过100兆个连接。这些连接由多种神经化学因子调节,这些因子跨越空间维度,从分子开始并发育到细胞、循环、系统、并最终导致包括认知过程、情绪、感知、记忆和目标导向行为。从出生到生命终结的人类发育所有阶段的大脑疾病在世界范围内的流行,导致了严重的医学、政治、经济、法律和生活质量问题。无论如何,在健康和疾病领域,大脑仍是一项科学前沿问题。 不过,这种广泛而未被满足的医疗需求的紧迫性再加上神经系统科学领域的近期进展已经激发了这样一个充满希望的愿景:对于大脑的全面理解是一个可以实现的目标。在美国,这一愿景最近已经集中到了一项被称为BRAIN(通过推进创新神经科学技术来进行大脑研究)倡议的行动计划上。此项倡议于2013年4月2日由美国总统巴拉克奥巴马(Barack Obama)公布,他宣布“加速对能够让研究人员生成显示设想速度下个体脑细胞与复杂神经回路间互相作用的大脑动态图片的新技术的开发和应用”是一项巨大挑战(The White House,2013年)。随后,国立卫生研究院(NIH)制定了一项10年计划,用以实现加速技术开发以便获得关于神经系统在健康和疾病中所起到功能的基础见解这一主要目标。一开始,BRAIN倡议的终点是大脑中的神经回路,包括组成细胞的表征、突触连接、以及行为相关活动的动态集合。这一总体目标横跨多个研究领域,从管理短程细胞回路的分子和细胞过程到由人类神经成像观察到的管理复杂行为的远程流程。行动过程人类大脑成像 针对这一倡议的一个主要目标包括现有技术的改善以及用于大脑机制及行为之间关系探索和建模的全新技术的开发。主要采用核磁共振成像(MRI)和诸如脑磁图描记术(MEG)及脑电图描记术(EEG)等电磁技术的现有脑成像技术,是正常及病理条件下人类大脑研究的基础。这些技术对一个重点为功能性脑活动与认知及行为之间相关性的神经系统科学主要分支做出了大量贡献。尤其是大脑成像技术的爆发式成长,实现了对于人类语言、记忆、决策制定、视觉和听觉过程、情绪、学习及社交互动等复杂认知行为相关的专门神经过程的操作性了解。 总之,这些系统的神经学和生理学组成部分1) 局限于特定的大脑区域和接收及传输信息的短程神经回路,并且2) 通过涉及的大脑区域之间的远程途径相互连接。因此,出现了两大大脑组织原则。首先是隔离原则,大脑特定区域专门用于特定的任务和处理;第二是互动原理,在特定任务需求下大脑中共同有效区是相互连接的。例如,在人类语言系统中,位于左颞上回的一个通常被称为威尔尼克语言区(Wernicke’s area)的区域,专门用于语言接收功能(理解并解读说出的语句)。此外,位于左额下回的一个通常被称为布鲁卡语言区(Broca’s Area)的区域专门用于产生语言功能(产生语音)。 这两种专用大脑区域的复合体通过广为人知的途径相互连接,包括弓状纤维束和用于传输了解语言并用于说话的过程相关当地信息的弓形钩突。其他被广泛认可为和记忆及情绪有关的大脑区域,在特定任务过程中和语言系统功能性连接。语言相关操作过程中这些互动区域之间的动态关系,已经采用当代神经成像技术进行了广泛研究。技术进步 主要由于采用磁共振成像(MRI)技术研究大脑过程的限制,主流神经成像技术被局限于单个个体的研究。在扫描仪环境下,两个个体之间的自然人际互动是不可能的。不过,实时交流涉及语言和非言语交流,包括目光接触,动态面部表情和反应手势。虽然涉及两个个体之间动态交流的互动社会行为是人类社会化的一个基本方面,但这些隐含的沟通线索不会出现在仅包含一个个体的扫描环境中。主要是由于这些技术的局限性,导致人类对调节和调制自然人际互动和交流的潜在神经回路知之甚少。因此,具有社交互动相关潜在深刻缺陷的神经病(例如孤独症谱系障碍、精神分裂症、焦虑症和抑郁症)的神经生理学机制仍无法确定。用于生态学上有效的条件下两个个体间交流过程中大脑成像的新技术的开发,为在传统神经成像中收集的信息不足的大型临床全体的需求的解决提供了一个特别有影响力的机会。近红外光谱法(NIRS)的基础性新角色 一种新兴的神经成像技术——功能性近红外光谱法(fNIRS)采用了固定在头戴帽上的光极,并且适合在自然情况下用于多位受试者而且不受头部移动影响。和MRI一样,NIRS能够在无离子化造成的毒性的情况下,实现对个体受试者运作中神经系统的观察。此项技术利用了活跃神经组织回路氧合的血液比例比非活跃神经组织更大这一生理学原理的优势。在这一过程中局部微脉管系统内脱氧血红蛋白(deOxyHb)的顺磁性作用降低。被称为血氧水平依赖性(BOLD)信号(Ogawa等人,1990年)的MRI中信号放大是由于deOxyHb比例降低以及由此导致的顺磁性作用减少。BOLD信号也是利用光谱吸收(J?bsis,1977年)通过NIRS测定的,这种方法能够区分氧合血红蛋白、OxyHb和deOxyHb信号。脉冲激光(采用岛津NIRS系统)发射三种波长的光,而检测器则测量氧合血红蛋白(OxyHb)和脱氧血红蛋白(deOxyHb)浓度的变化。对于每个通道,测量在780nm、805nm和830nm下的近红外光吸光度,并根据改良朗伯-比尔定律(Beer-Lambert Law)分别换算为相应的deOxyHb、总Hb(HbT)和OxyHb(Matcher & Cooper,1994年)(图1)。 图1. 脱氧血红蛋白与氧合血红蛋白吸收光谱这些函数显示了OxyHb和deOxyHb在780nm及830nm波长处的最大吸光度差异。大脑血液中的氧浓度影响着反射的光波长。改良朗伯-比尔定律被用于换算对应于deOxyHb(780nm)、总血红蛋白(805nm)和OxyHb(830nm)浓度变化的三个波长下的光衰减直接测量结果。 Shimadzu Corporation(日本东京)是一家fNIRS系统的领先制造商。图2显示了专门用于超高扫描的岛津LABNIRS配置,可为参与互动任务的两个个体同时获取信号。这种特殊系统可利用配备场景及瞳孔摄像头的SMI镜片实现实时NIRS信号的获取及眼球追踪采集。在此示例中,每顶帽子都包含42个通道,并为每位受试者分为两个半球。帽子配置是灵活性的,可以根据实验目的修改。NIRS信号的获取速率范围为10至33毫秒,空间分辨率为约3厘米。这种时间分辨率非常适合大脑内和大脑间活跃区域连接性的测量,不过和fMRI相比空间分辨率方面相对有所损失。 fMRI和fNIRS信号都反映出了大脑血流和大脑血氧饱和度的变化,而这些和潜在神经活动关联。后者已经由Eggebrecht及其同事(Eggebrecht等,2012年)最近在健康志愿者的视觉刺激过程中得到证实。fMRI BOLD和deOxyHb及OxyHb之间高度的正相关性目前已经得到很好证实(Sato等人,2013年;Scholkmann等人,2014年)。 在单个受试者、单次运行和单个光极的大拇指敲击任务中获得的“原始”fNIRS信号显示,同时获得了对任务相关时间系列作出响应的OxyHb和deOxyHb信号(图3)。注意OxyHb和deOxyHb信号之间的反相关性,和理论预期一致。由于和神经(而非心血管)事件的已知相关性,deOxyHb信号预期将是和fMRI BOLD信号最紧密相关的信号(Franceschini等人,2006年) 图2. 耶鲁大学医学院大脑功能实验室的fNIRS系统(LABNIRS,ShimadzuCorp.)。采用LABNIRS系统的参与者以SMI(ETG-2)眼部追踪镜片显示。单个受试者/单个通道/单个位置 图3显示了在不采用岛津LABNIRS系统(白色箭头)进行滤波的单次运行、单个受试者、单个通道手指大拇指敲击任务中,OxyHb(红色)和deOxyHb(蓝色)信号之间的反相关性。大脑覆盖最优的帽子设计 两位受试者相应大脑半球上的光极放置如图4所示。表1中包含了每个通道解剖学位置的示例(单个受试者),采用现行蒙特利尔神经学研究所系统(Montreal Neurological Institute)以标准解剖学坐标表示(ICBM152,Mazziota等人,2001年)。由于NIRS不会和MRI一样提供结构信息,使用标准脑图谱将通道位置与已知解剖结构相关联。 在两位受试者身上,光极被放置在相似的头部位置上,以便获得来自几乎相应脑区的皮质信号。探针被放置在每位受试者的头部,和被定义为从鼻根通过Cz到枕骨隆突的中线对齐。探针的位置以10-20国际坐标系统(Jasper,1958年)为基础,可提供与皮质解剖结构之间的准确关系(Koessler等人,2009年)。诸如PATRIOT Polhemus(Colchester,VT)等3D磁数字化仪通常被用于识别光极位置从而识别每位受试者的通道位置,根据受试者头骨的形状和尺寸进行标准化(Singh等人,2003年)。除了个体光极的位置之外,还记录了头部解剖学标志的三维坐标(Okamoto等人,2004年)。这些坐标被用于估计每个通道的位置,由发射器-检测器光极对采用比如NIRS-SPM (http://www.fil.ion.ucl.ac.uk/spm/)(一种基于MATLAB的应用)等标准软件包进行定义。继续所有渠道。表1 通道为止MNI坐标示例通道几何中心位置:MNI坐标 图4两个脑半球的通道分布 两个或以上个体的新神经系统科学 两人或以上个体间互动的近期研究已经证实了NIRS技术的功效,目前正引领着一种个体间自然交流的新神经系统科学之路(Babiloni和Astolfi,2014年;Scholkmann等人,2013年)。技术、计算算法和实验范式的突破,为社会大脑理论框架开发、以及通常社交功能受损的多种精神疾病和神经疾病的治疗的未来进展保证了一个质的飞跃。一种新的神经系统科学的新型基础,源于用以观察特定功能相关大脑间同步的高级计算方法。例如,已经采用小波分析测量了某项计算机任务合作过程中额叶皮质信号的一致性,并且显示了在同一个任务上进行竞争的受试者之间的一致性更高,表明了一种对合作特定的人际关系敏感的神经生理学底物(Cui等人,2013年)。在一项采用四个受试者群组同步记录的方法进行的合作性文字游戏中报告了相似的额极结果(Nozawa等人,2016年)。采用左前额和顶叶脑区同步NIRS记录的方法,对群组中领导者和追随者的出现进行了研究。研究发现揭露了团队领导者的出现,与领导者和追随者之间神经同步相对于追随者之间同步的增加相关(Jiang等人,2015年)。这些发现表明,未来可采用超高扫描方法和NIRS来了解领导能力的神经学机制。面对面交流中观察到的大脑间左半球神经同步相对于背对背交流中同步的增加表明面部表情为人际交流提供了特殊的神经信号,并且为将生动面部表情作为自然个体间交流的基础组成部分的研究指明了道路(Jiang等人,2012年)。参与某项手指敲击模仿人物的两个大脑的运动前区的同步,大于以自身步调进行的控制任务中的同步(Holper等人,2012年)。目光接触也可以增加大脑之间的一致性(Hirsch等人,2017年)。其他示例包括合作性按按钮(Funane等人,2011年)和正回任务(Dommer等人,2012年)。这些研究发现都为关于大脑间作用特定于某些神经区域、以及在不同人际交流条件下一致性出现增加提供了证据。这些基础性发现是记录基于NIRS的新型超高扫描技术潜在重要性的早期切入点,并且前进的轨迹正在以非常快的速度移动。当两人互相对话时两个大脑会发生什么? 在我们对健康成人配对组之间面对面交流过程中进行的大脑间同步互动早期研究中,在15秒的回合内关于对话和倾听对象的画面交替出现。这些回合是结构化的,并且决定了讲话和倾听的顺序。对受试者配对组在独白/对话和面对面/阻挡条件下获得的信号的神经活动进行了比较。三分钟的运行时间被分为十二个15秒长的回合。此处假设与独白相比,在对话过程中讲话及倾听相关的脑区中大脑内和大脑间同步将增加。对于每个回合,监视器上将显示某个对象的单独照片并由每位受试者查看。任务在面对面交流条件下以及面部被阻隔的条件下(即受试者无法看到他们的搭档)进行。结构化独白任务:在第一个示例中,受试者1识别了图片对象并提供了和对象相关的口头叙述。受试者2进行了倾听但并未回应。第二个回合采用了一个新的图片。受试者2说出了对象的名字并进行了口头叙述,而受试者1则进行了倾听。这种讲话和倾听的交换持续了3分钟,如图5所示。结构化对话任务:除了讲话的人对先前讲话人叙述进行了回应之外,结构化对话任务和结构化独白任务是相同的。预期是对话条件将揭露面对面条件下由于动态互动强度变化而到导致的语言系统的上调。 图5. 独白和对话范式 图6. 单独通道的fNIRS信号:通道12背外侧前额叶皮层(DLPFC,顶行)和通道18额极皮质(底行)显示了讲话和倾听过程中来自两位互动受试者的同源位置S1和S2的反相关信号。图片显示了OxyHb(中列)和deOxyHb(右列)的信号平均值并证实了配对受试者之间对应于角色变换(倾听和说话)的预期反相关性、以及OxyHb和deOxyHb信号之间的反相关性。 图6展示了两位受试者源自对讲话和倾听敏感的脑区S1和S2的信号之间的反相关性。和fNIRS信号的预期相同,每位受试者每个通道内的deOxyHb和OxyHb信号反相关(详见上文吸收光谱和示例)。对话过程中大脑内功能连接性大于独白期间:采用常规线性模型和心理生理互动(PPI)分析技术。 旨在了解传统人物相关、单个大脑功能连接性作用的分析,证实了面对面互动中对话的神经显著性。大脑偏远区域间功能连接性的测量表明,和独白相比在对话过程中同步会增加。尤其是在一项面部敏感性大脑区域梭状回(Kanwisher等人,1997年)被选定为重点区域的心理生理学互动(PPI)(Friston等人,1997年)的分析中,证实了面对面目光下对话可以增强威尔尼克语言区和布鲁卡语言区之间神经共变的强度(图7)。研究发现证实了对面对面过程中布鲁卡语言区和威尔尼克语言区间互动性增加的规范性语言系统的预期。对话过程中大脑间一致性大于独白过程:旨在研究大脑间互动的大脑间一致性(采用小波比较)。 根据内部(大脑内)功能连接性研究发现预计,这些区域在面对面条件下也会产生大脑间的共鸣。根据在每个通道获得的分级信号的小波核心,为对话(红色)和独白(蓝色)条件下的大脑间一致性(图8A)进行了绘图。对于两个大脑间大脑区域所有可行配对都以不偏不倚的方式进行了考虑。仅在对话和独白条件下发现了布鲁卡-威尔尼克语言区配对的核心范围内约6.34秒的大脑间一致性的显著差异(x轴)。语言产生区域(布鲁卡语言区)和语言接收区域(威尔尼克语言区)推定功能之间的大脑间一致性和这些研究发现一致,并且和以当前对这些区域的了解为基础的预期结果一致(图8B)(Jiang等人,2012年)。 图7. 在双方面对面目光下,对话条件下的大脑内功能连接性(PPI)大于独白条件下。依据是梭状区(绿色),连接区域(p ≤ 0.05)为布鲁卡区(-55, 20, 16)和威尔尼克区(-48, -36, 40)deOxyHb信号。(Hirsch, J., Noah, A., Zhang, X., Yahil, S., Lapborisuth, P., & Biriotti, M.(2014年10月)。背外侧前额叶皮层内专用于人际交流的神经专区:一项NIRS研究。神经系统科学协会年度会议上的演讲,美国伊利诺斯州芝加哥。) 这些研究表明了采用fNIRS和超高扫描技术研究互动人脑间动态关系的潜在未来方向。此外,语言超高扫描研究记录了诸如语言系统组分等广为人知的功能性神经解剖结构是可以采用fNIRS观察到的,而且两个个体间大脑一致性和同步的其他特征可以被作为新型探索方向进行研究,以便对作为社交互动神经事件基础的未知问题进行表征。这些研究还证实了光极覆盖范围可涵盖整个头部表面的技术的优势(Zhang等人,2016;Zhang等人,2017年;Dravida等人,2017年)。由于神经系统依赖于多个区域之间的信号合作(整体性原则),最成功的NIRS技术将取决于整个大脑的大脑功能采样。潜在获益包括可实现人际交往和相互交往过程中涉及的神经组织原则的方法及技术的标志性突破。进一步的研究可采用这些新的技术来进一步了解交流障碍的神经学基础,以及发育障碍中的社交能力障碍的神经学基础是如何偏离正常发育基础的。 之后我们应该怎么做? 功能性NIRS是一种正在快速成长的神经成像技术,在过去的20年间每3.5年相关著作数量就会翻一倍(Boas等人,2014年),且目前的增长轨迹呈指数型。主要开发领域包括神经发育、感知和认知、运动控制、以及精神疾病及神经疾病和治疗等传统神经系统科学主流领域中应用的仪器、分析方法、以及实验程序优化。神经反馈(Lapborisuth等人,2017年)和成人冲突认知神经系统科学(Noah等人,2017年)的近期应用展现了这些新的目录。不过,fNIRS的主要优势和自然环境中信号获取相关,而不受到高磁场以及限制头部运动及交流的不适成像条件带来的局限性的限制。这些优势让fNIRS成为了神经系统科学领域一种新前沿的潜力领先技术;这一前沿旨在了解社会行为和大脑间人际互动的神经相关性(Pinti等人,2015年;Noah等人,2015年;Hirsch等人,2017年)。旨在实现这一主要进展的各方各面基本已就绪。这一特定最终目标的关键开发优先事项 包括:1) 专注于代表和系统及其他非神经组分区分的信号的神经贡献的信号组分的计算算法(Kirilina等人,2012年; Zhang 等人,2016年);2) 光极完全覆盖头部以便获取潜在远程神经回路的动态活动;3) 同步EEG、fNIRS、以及眼部追踪综合测量(例如)用于远程大脑机制综合性报告的多模式系统。BRAIN倡议和fNIRS作为主流神经技术兴起的共同发生,催动了专门针对两个或以上个体之间人际互动的未开发神经系统的有效潜力。 图8. 大脑间同步的一致性分析。A. 为独白(蓝线)和对话(红线)条件下威尔尼克及布鲁卡语言区(WA和BA)的deOxyHb fNIRS信号绘制了一致性,表明了和独白相比对话条件下同步性显著更高(p 0.005),并且仅在面对面条件下观察到。研究发现在成对受试者中具有双边意义,并且在目标区域方面无偏倚。B. 这些一致性研究结果仅限于布鲁卡和威尔尼克语言区(群组数据)。(Hirsch, J., Noah, A., Zhang, X., Yahil, S., Lapborisuth, P., & Biriotti, M.(2014年10月)。背外侧前额叶皮层内专用于人际交流的神经专区:一项NIRS研究。神经系统科学协会年度会议上的演讲,美国伊利诺斯州芝加哥。)参考文献Babiloni, F., & Astolfi, L. (2014).Social neuroscience and hyperscanning techniques: past, present and future.Neuroscience & Biobehavioral Reviews, 44, 76-93.Boas, D. A., Elwell, C. E., Ferrari, M., & Taga, G. (2014).Twenty years of functional near-infrared spectroscopy: Introduction for the special issue.Neuroimage, 85, 1-5.Cui, X., Bryant, D. M., & Reiss, A. L. (2012).NIRS-based hyperscanning reveals increased interpersonal coherence in superior frontal cortex durintion and methodology.Neuroimage, 85, 6-27.Singh, M., Kim, S., & Kim, T. S. (2003).Correlation between BOLD‐fMRI and EEG signal changes in response to visual stimulus frequency in humans.Magnetic Resonance in Medicine, 49(1), 108-114.The White House, Office of the Press Secretary.(2013).Remarks by the President on the BRAIN Initiative and American Innovation [Press release].Retrieved fromhttps://www.whitehouse.gov/the-press-office/2013/04/02/remarks-pr esident-brain-initiative-and-american-innovationZhang, X., Noah, J. A., & Hirsch, J. (2016).Separation of the global and local components in functional near-infrared spectroscopy signals using principal component spatial filtering.Neurophotonics,3(1), 015004-015004.Zhang, X., Noah, J. A., Dravida, S., & Hirsch, J. (2017).Signal processing of functional NIRS data acquired during overt speaking.Neurophotonics, 4(4), 041409. doi: doi:10.1117/1.NPh.4.4.041409