我现在正在做白酒中甲醇,用比色法做,曲线效果很不好,相关系数才0.98,而且标准溶液吸光度很不稳定,隔10多分钟在测,吸光度上升很快,想请教一下,有哪位专家给指点一下,我现在很着急,因为正在做能力验证,马上要报结果。小女子在这里多谢了!
氮是植物生长发育的重要营养元素之一,植物叶片中氮素含量高低常可作为施氮效应及氮素需要的诊断指标。因此,氮素含量的测定在教学中是一个重要的教学内容,在科研研究中是常测定的一个指标。植物组织全氮测定常用方法是凯氏定氮法,即利用浓H2SO4-H2O2消煮,将样品中有机物和有机含氮化合物转化为无机铵盐,再用蒸馏滴定的方法测定全氮含量。有文献报道,植物样品中氮的含量也可采用纳什比色法测定,即获得消化液后,采用纳什比色方法测定消煮液中铵离子的浓度,然后通过计算获得样品中氮的含量。 甘蔗是需氮量较大的作物,氮肥不足会影响甘蔗的生长,氮营养过剩则会增加生产成本,造成肥料浪费和环境污染。本试验利用H2SO4-H2O2法消化获得消煮液,用蒸馏滴定法和纳什比色法测定甘蔗叶片样品中的全氮含量,分析比较2种方法的测定结果及其优缺点,为植物样品的快速测定提供一定的参考依据。 1 材料与方法 1.1材料来源 取生长盛期健康的甘蔗+3叶片,在105℃烘箱内杀青30min,在60℃~70℃烘干至恒重,用粉碎机粉碎密封保存备用。 1.2待测液的获得 准确称取0.2g(精确至0.0001g)粉碎样品置于消化管中,3次重复,加入5mL浓H2SO4,瓶口加一个小漏斗,摇匀,过夜,另取一个消化管,不加样品,只加同样的浓硫酸作为对照。将消化管置于控温式远红外消煮炉上消煮,中间视消化情况加1mLH2O21~2次加速氧化,直至消煮液呈无色或清亮色。待消化管冷却,用少量水冲洗小漏斗,将消化液无损失转入100mL容量瓶并定容,澄清上清液即为待测液。 1.3滴定法测定全氮 对蒸馏装置进行洗涤,并确保干净后,准确吸取定容后的消煮液10.0mL于反应器中开始蒸馏,将馏出液出口的冷凝管下端管口插入盛有30ml的硼酸吸收液和5~6滴混合指示剂的三角瓶中,当三角瓶中溶液开始变绿时开始记时,四分钟后将三角瓶移离冷凝管口,继续蒸馏1分钟后将三角瓶移离蒸馏装置,用水冲洗冷凝管及馏出液管,然后用0.01mol/LHCL标准酸滴定,溶液由绿色变为淡紫色为滴定终点并记录所用酸体积,同时作一空白试验。依据公式计算全氮含量: N(%)=(V1-V0)×C×14×Ts×10-3×100/m 其中:N:植株的全氮含量;V1:样品测定值消耗标准酸的体积数(mL);V0:空白试验所消耗标准酸的体积数(mL);C:标准酸的浓度(mol/L);14:氮原子的原子质量(g/mol);Ts:分取倍数;m:干样品质量(g)。 1.4纳什比色测定 标准曲线的制作:分别吸取10μg/mLN(NH4-N)标准液0、2.50、5.00、7.50、10.00、12.50mL于6个50mL容量瓶中,每个加入100g/L酒石酸钠溶液2mL,充分摇匀,加入纳什试剂2.5mL,用水定容后充分摇匀。30min后用分光光度计在波长420nm测定。用所得数据制作标准曲线,根据标准曲线计算NH4+浓度。 吸取待测液2mL于50mL容量瓶中,按照标准曲线的方法测定样品中中的NH4+OD值,同时在样品测定的同时做空白试验,根据标准曲线计算比色液中NH4+-N浓度,再根据下面公式计算含氮量。 N(%)=p×V×Ts×10-4/m 其中:p:从标准曲线查的显色液N(NH4+-N)的质量浓度(μg/mL);V:显色液体积(mL);Ts-分取倍数:m:干样品质量(g)。 2.结果与分析 2.1比色方法的线性关系 根据所测定的OD值,制作标准曲线如图1所示,标准曲线的函数关系式为Y=0.2228x-0.0297,相关系数R2=0.9995,线性关系较高,可以满足试验的下一步计算。 2.2两种测定方法的结果比较 试验中所采用的两种测定方法结果的偏差除了第16号外,其他几个样品的结果偏差都小于2%,滴定法与纳氏比色法比值大于1的样品有1、8、10、13号(表1)。滴定法测定结果的标准差和标准误都小于纳氏比色法测定结果,同时滴定法的变异系数也比纳氏比色法的要小,但二者都小于2%(表2),两种测定结果都是可靠的。对两种测定方法的t检验结果从表3可知,95%置信区间的上下限分别为0.017和0.174,t值为2.582大于0.021,说明两组测定结果之间差异不显着,即用凯氏滴定法和纳氏比色测定法两种方法测定甘蔗样品的全氮含量差异不显着,表明用两种方法的任何一种测定甘蔗叶片全氮,均不影响其试验结果。 3 讨论与结论 [url=http://www.kaishitest.com/][color=#ffffff]凯氏定氮法[/color][/url]是测定植物组织全氮的国家标准方法。该方法虽不需复杂的仪器设备,但滴定终点易受人为因素的影响,且蒸馏耗时太多,对快速批量测试来说费时费力。纳什比色法采用比色的方法,根据分光光度计比色槽的设定可同时测定5~7个样品,避免人工蒸馏和滴定的繁琐过程,大大提高了工作效率。 本试验测定结果表明,凯氏定氮法和纳什比色法二者测定结果关系不显着,其中凯氏滴定法变异系数小,蒸馏结果准确可靠,优于纳什比色法,但纳什比色法设备简单,效率较高,且与滴定法没有达到显着差异,如果样品量较大,又仅仅是比较不同处理间的氮含量差异,纳什比色法是一种快速效率较高的测定方法,减少了凯氏定氮法中的蒸馏与滴定操作,节省时间与资源,更为方便。在实验过程中,可根据自己试验的目的要求,选择合适的测定方法。 值得注意的是要使测定结果有更好的准确度,在测定过程中要认真掌握各个细节及相应的注意事项。如在滴定法测定时要注意加入NaOH量得控制,过多反应剧烈,造成NH4+-N损失,过少蒸馏又不完全。在应用纳什比色法测定时要注意显色溶液的pH值应≥11,NH4+-N的浓度控制在0.2~3.0mg/L;稳定时间要有保证,当温度低时应稳定1h再进行比色测定。只有注意到这几个测定细节,才能保证测定结果的准确性。 因此,[url=http://www.kaishitest.com/]凯氏滴定法[/url]和纳什比色法都可以用来测定甘蔗组织中的全氮含量,二者的测定结果差异不显着。在方法选择上,可根据自己的试验条件和试验目的要求,选择合适的测定方法,但在使用两种方法的同时,应该细致掌握各方法的注意事项。
这主题我不知道发没发过,这是我急需要知道的!我做吸收液比色分析,通常做三个色阶,我想知道的是,这样的比色分析,其比色管需要检定吗?也就是定个容,比个色。色阶之间,要么没变化,要么差别很明显,差个一点半点,根本没影响。特别是搞过认证的同行,在检查中,这点是否很重要?请告知,不胜感激!
在进行氨氮纳氏比色的时候,加入屏蔽剂后,溶液变得更加浑浊,从而导致吸光度更大;但当我更换为别人提供的屏蔽剂后,未出现此现象。问各位: 大家在进行实验的时候,一般使用那些厂家生产的试剂? 有人说这是由于酒石酸钾钠中含有大量钙离子,这个钙能否去除?
比色管定容时该如何读数?比如说10ml比色管定容该读10.0还是10.00?是否有标准可以依据?
昨天和同事去送检玻璃仪器人家说价格的时候我都怀疑我的耳朵听错了举个例子:检定一个比色管需要60元钱我真是狂晕!无话可说了![em06]
新购的比色可以和旧的比色皿混着用吗?影响大吗?
一般而言,样品消化液需要用容量瓶作定容器具。目前多见用比色管来作定容,虽不符合实验规范,但操作起来方便很多,不知各位有和高招?
一次性比色皿在使用之前怎么处理?若窗面有水可以用擦镜纸擦吗,我用擦镜纸擦了,越擦吸光度越高,不知道什么原因?若不能用擦镜纸擦拭,那应该用什么拭去窗面的水分? 谢谢大家!
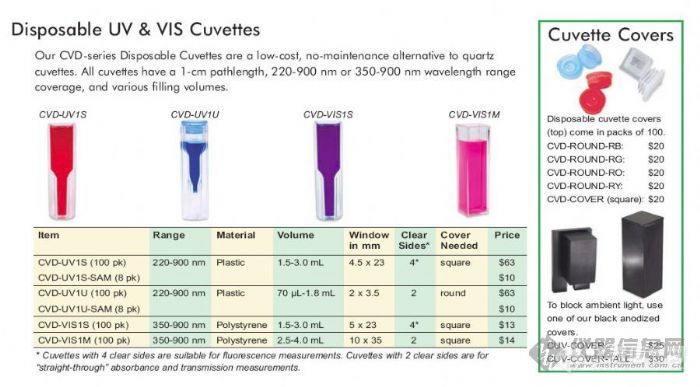
有用过的请交流一下。不知国内哪些企业使用一次性比色皿?哪些企业生产一次性比色皿?性能如何?我看07年有人在本版发过类似的帖子,好像反对使用的意见占多数。实际上这种比色皿最适合实验室外使用,用完后还可以塞上塞子、贴上标签当样品瓶保存。从价格看不是太贵,普通的也就1.5元左右一只。上海安普公司网上标价100个125元,进口的。这可是一个商机啊,可是你愿意用吗?以下是国外生产的一次性比色皿,价格是07年的(美元),可以参考。[img]http://ng1.17img.cn/bbsfiles/images/2009/02/200902021752_130838_1633752_3.jpg[/img]
铂钴比色液时间越久颜色是不是越深呢
如题,食品中铅的测定,使用比色法时,酒类试样预处理可否用灰化法?因为硝酸-硫酸法感觉麻烦也危险
RT,比色皿需不需要检定呢?如果需要,是要检定什么?
我在做食品中铜测定时,用到四氯化碳萃取比色,但当比色时,发现数据一直稳定不了,用了配的一个盖子盖住,反把盖子沾在比色皿上了,不知谁来帮我解答一下?
看到周版主的帖子,也自己想看看到底340nm处有什么不同。我没有他的设备好,只好因陋就简,比划一下。晚上吃过饭,真的做了两个试验试验方法和结果1. 一台紫外可见光的老设备,氘灯,在340nm处(旋钮型)比较了两个空石英比色皿(1ml)(新的,从没用过)的和两个空普通玻璃比色皿(1ml)(使用过)的吸光度,发现石英比色皿的吸光度一只在0.029,另一只在0.031,测定五次都比较稳定。而玻璃比色皿的吸光度为0.129和0.137,五次连续测定也比较稳定。2. 使用一个可见光分光光度计,Sectrolab 22c,只有钨灯,但旋钮在330-700nm(旋钮型),选择340nm,同样比较上述同样的空石英比色皿和玻璃比色皿,吸光度分别为0.063, 0.066, 0.132,0.136。结论:a. 新的石英比色皿在340nm处的吸收远小于玻璃比色皿,且比二虎的石英比色皿吸光度小很多,但是否是因为我的石英比色皿是新的,而二虎的可能用过有关不清楚,也可能与我的氘灯(老氘灯)能量低有关也需要研究,但我的玻璃比色皿的340nm处吸光度与二虎的相似,说明能量也不算低。即比色皿的新旧对吸光度有影响(明显的结论,哈哈)。b. 在使用钨灯及光栅在340nm处进行比色,石英比色皿的吸光度增加到0.063-0.066,还是比二虎的低,此时玻璃比色皿的吸光度与氘灯下340nm测定的吸光度相似也在0.132-0.136之间。c. 一个弱弱的问题,带光栅(单色器的设备),如果只有钨灯,在330-400nm之间进行紫外检测可以么?钨灯的波长范围是多大,有紫外区段么?不想查资料了,在这里聆听大家的经验。d. 在340nm处,不论氘灯或钨灯产生的紫外光,玻璃比色皿的吸光度都比石英比色皿的大得多,如果进行非常微量吸光度物质的测定,可能不合适使用玻璃比色皿;比色皿之间的吸光度不同,要尽量使用一只比色皿。e. 只所以关注340nm,主要是很多检测使用340nm,如尿素氮,谷丙转氨酶等使用NADPH变化进行检测时要用340nm
本单位所用的日立F4500荧光光谱仪上面的荧光比色皿不小心给裂掉了,不知道国产的哪种适用于该仪器?大小跟紫外的比色皿相比,是721型的合适还是751型的合适,在线等消息,谢谢。
如题。我们实验室用的是承德华通的CTL-12型COD快速测定仪,最近发现读数很不稳定,可能是光学比色部件出现问题,有可能是长时间的使用污染了比色池,这个比色池能自行拆下清洗吗?怎么洗?谢谢大家!~
比色皿清洗液:浓盐酸:甲醇:水=1:4:3如果比色皿被有机物污染,宜用盐酸—乙醇(1:2)混合液浸沉,也可用相应的有机溶剂浸泡洗涤。如:油脂污染可用石油醚浸洗,铬天青显色剂污染可用硝酸(1:2)浸沉等。比色皿不可用碱液洗涤,也不能用硬布、毛刷刷洗。一个干净的比色皿装满水后,相对于空气应有表中所得到的吸光度: λ(nm) 吸光度光学玻璃皿 650 0.035石英比色皿 240 0.093在多次实验中发现,比色皿换向后误差可达4%一7%左右。所以在精确测量时 定要看准比色皿箭头标志。如无标志,可作配套捡定后按方向在毛玻璃上端作上箭头一致的标记。以避免操作时搞反。比色皿必须保持清洁和无伤痕,玻璃和石英吸收池通常可用冷酸或酒精、乙醚等有机密剂清洗。避免使用重铬酸钾洗涤液,因为它会被吸附在比色皿壁上而出现一层格化物的薄膜,这种薄膜很难除去。粘合的玻璃比色皿不能用酸或碱清洗,更要避免用热浓酸清洗,通常用蒸馏水漂洗,然后用少量溶液淌洗 比色皿外壁要用擦镜纸或软绸布小心擦干
总磷监测中因消解的需要,比色管需进行长时间的加热消解,比色管体积可能发生变化,如何保证样品定容体积的一致。大家有什么好办法。
比色皿清洗液:浓盐酸:甲醇:水=1:4:3,如果比色皿被有机物污染,宜用盐酸—乙醇(1:2)混合液浸沉,也可用相应的有机溶剂浸泡洗涤。如:油脂污染, 可用石油醚浸洗,铬天青显色剂污染可用硝酸(1:2)浸沉等。比色皿不可用碱液洗涤,也不能用硬布、毛刷刷洗。一个干净的比色皿装满水后,相对于空气应有 表中所得到的吸光度: λ(nm) 吸光度光学玻璃皿 650 0.035石英比色皿 240 0.093在多次实验中发现,比色皿换向后误差可达4%一7%左右。所以在精确测量时;定要看准比色皿箭头标志。如无标志,可作配套捡定后按方向在毛玻璃 上端作上箭头一致的标记。以避免操作时搞反。比色皿必须保持清洁和无伤痕,玻璃和石英吸收池通常可用冷酸或酒精、乙醚等有机密剂清洗。避免使用重铬酸钾洗 涤液,因为它会被吸附在比色皿壁上而出现一层格化物的薄膜,这种薄膜很难除去。粘合的玻璃比色皿不能用酸或碱清洗,更要避免用热浓酸清洗,通常用蒸馏水漂洗,然后用少量溶液淌洗;比色皿外壁要用擦镜纸或软绸布小心擦干.
哪位朋友有581-S型光电比色计的使用说明,能否给我一份,谢谢啦。E-mail:zhendebing33@126.com
操作光度计时,大家使用一次性的VIS 或 UV-VIS比色皿吗?价格贵吗?好用吗? 谢谢了!
我按照国标做甲醇的测定,怎么配制的品红-亚硫酸溶液有点带黄色,再就是标准溶液用配的试剂显色时也没看到蓝紫色. 而切配好的标准液在比色皿内表面有气泡,这是怎么回事呀!望各位指点一下
实验室买一台比色计测铂-钴色度,因样品是树脂,很难清洗,用玻璃的洗不干净,重现性很差,请哪里可以买到5cm光程的一次性比色皿,急!国外的要二十多元一个,实验室用量大,每年要用5000个左右,用进口的太浪费了,大家知道哪里有国产的卖吗?
我们实验室,有容量瓶,比色管,移液管好几百个,是否每个都需要经过检定,这周末就要评审了,发现只检定了部分,这应该如何应对评审老师。 另外,检定的是否要贴上检定标识,那岂不是洗一下就没了吗?特别泡酸的,不知大家怎么解决???
酒精检测仪的牌子有哪些?全线产品包括:立柜式、台式、壁挂式、便携式、指纹考勤式等覆盖到更多的十多个行业版本。酒精测试仪是可供执法交警作为检测驾驶人员呼气酒精含量的一种检测工具。酒精检测仪通常是对气体中酒精含量进行检测的设备可以分为五种基本类型,即:燃料电池型、半导体型、红外线型、气体色谱分析型、比色型。但由于价格相对较低和使用方便的原因,目前常用的有燃料电池型和半导体型的主要的两种。
用hj636-2012的这个方法测总氮,总氮定容完之后,多久时间可以进行比色
1、 比色皿的正确选择比色皿透光面是由能够透过所使用的波长范围的光的材料制成。在200-350nm工作的比色皿适用于紫外区,必须使用石英或熔熔硅石制成透光面的石英比色皿。(注:熔熔硅石的俺还真没见过,只用过石英的)石英比色皿既可用于紫外区又可用于可见区,但是价格一般比较贵哦,所以要根据使用波长选择比色皿,如果不用紫外区的话,用普通玻璃比色皿就行了,一则浪费没必要,二则,嘿嘿,摔碎了也不心疼,哈哈。而普通硅酸盐光学玻璃制成的透光面的比色皿,只能用于350nm至1000nm的可见区。2、 比色皿的正确使用和注意事项 在使用比色皿时,两个透光面要完全平行,并垂直置于比色皿架中,以保证在测量时,入射光垂直于透光面,避免光的反射损失,保证光程固定。 比色皿一般为长方体,其底及两侧为磨毛玻璃,另两面为光学玻璃制成的透光面粘结而成。所以使用时应注意以下几点:2.1拿取比色皿时,只能用手指接触两侧的毛玻璃,避免接触光学面。2.2不得将光学面与硬物或脏物接触。盛装溶液时,高度为比色皿的2/3处即可,光学面如有残液可先用滤纸轻轻吸附,然后再用镜头纸或丝绸擦拭。2.3凡含有腐蚀玻璃的物质的溶液,不得长期盛放在比色皿中。2.4比色皿在使用后,应立即用水冲洗干净。必要时可用1∶1的盐酸浸泡,然后用水冲洗干净。2.5不能将比色皿放在火焰或电炉上进行加热或干燥箱内烘烤;2.6在测量时如对比色皿有怀疑,可自行检测。用户可将波长选择置实际使用的波长上,将一套比色皿都注入蒸馏水,将其中一只的透射比调至95%(数显仪器调置100%)处,测量其他各只的透射比,凡透射比之差不大于0.5%,即可配套使用。2.7有人用过的经验:2.7.1使用前将比色皿在2%的硝酸溶液中浸泡24小时,然后用水,蒸馏水依次冲洗干净,擦干。2.7.2比色前将各个比色皿中装入蒸馏水,在比色波长下进行比较,误差在±0.001吸光度以内的比色皿选出4-8个进行比色测定,可避免因比色皿差异造成测量误差2.7.3 比色皿中的液体,应沿毛面倾斜,慢慢倒掉,不要将比色皿翻转,直接口向下放在干净的滤纸上吸干剩余液,然后用蒸馏水冲洗比色皿内部倒掉(操作同上)避免液体外流,使第2次测量时不用擦拭比色皿,不致因擦拭带来的误差。3、比色皿的洗涤方法3.1分光光度法中比色皿洁净与否是影响测定准确度的因素之一。因此,必须重视选择正确的洗净方法。 俺的经验是:要是你测定溶液是酸,如果不干净,就用弱碱溶液洗,要是你测定溶液是碱,如果不干净,就用弱酸溶液洗,要是你测定溶液是有机物质,如果不干净,就用有机溶剂,比如酒精等溶液洗。3.2看看文献上写的: 选择比色皿洗涤液的原则是去污效果好,不损坏比色皿,同时又不影响测定。3.2.1分析常用的铬酸洗液不宜用于洗涤比色皿,这是因为带水的比色皿在该洗液中有时会局部发热,致使比色皿胶接面裂开而损坏。同时经洗液洗涤后的比色皿还很可能残存微量铬,其在紫外区有吸收,因此会影响铬及其他有关元素的测定。
[size=4]最近突然发现一个问题,让我非常的苦恼,在测试铁的时候,把试样倒入新比色皿中,停10多秒的时候就会起一层水泡,吸附在比色皿的内壁上,严重影响试样的测定,尝试用各种浓酸,稀酸进行清洗浸泡,全没有用,依旧是吸附一层气泡,可是旧的比色皿上则没有。而空白和做曲线用的标,全没有气泡,就是试样有,不知道是什么原因,哪位大侠帮帮忙,先谢谢了!~~我昨天看了比色皿的清洗的那个文章,里面的方法我今天全用过了,依旧无效。我该如何处理呢?[/size]
各路大侠 小弟在此求助 我有一台上海光谱生产的721E型可见光分光光度计,需要买比色皿,想问下在挑选的时候有什么注意的,如厚度,材质,等等。先行谢过!!![em09505][em09505][em09505]