合成反应中如何控制反应温度为-10度
[b]微波有机合成反应的新进展[/b][i]王静,姜凤超[/i]摘 要:综述了近年来微波辐射技术在有机合成应用中的新进展。 着重介绍了微波有机合成反应技术及其在重要有机合成反应中的应用。关键词:微波化学,有机反应,微波辐射 微波最早被人们认识并应用在军事通讯领域,本世纪 40 年代后期逐渐应用于工业、农业、医疗、科学研究等各种领域。 在有机合成应用中的研究始于1986 年,当年加拿大化学家 Gedye 等发现微波辐射下的 4-氰基苯氧离子与氯苄的 SN2 亲核取代反应可以使反应速率提高 1 240 倍,并且产率也有不同程度的提高。 这一发现得到人们的高度重视并引起化学界的极大兴趣。 自此,在短短的十几年里,微波辐射促进有机化学反应的研究已成为有机化学领域中的一个热点,并逐步形成了一门引人注目的全新领域——MORE 化 学 (Microwave Induced Organic Reaction Enhancement Chemistry) 。 我国近年来关于MORE化学的研究也越来越多,发表的综述文章已有多篇,现仅就最近的进展作一综述。 1. 基本原理 微波(microwave, MW)即指波长从 1 mm~1 m,频率从 300 MHz~300 GHz 的超高频电磁波,广泛应用于雷达和电子通讯中。 为避免相互干扰,国际上规定工业、科学研究、医学及家用等民用微波频率一般为 900( ±15) MHz 和 2450( ±50) MHz。 微波加速有机反应的原理,传统的观点认为是对极性有机物的选择性加热,是微波的致热效应。 极性分子由于分子内电荷分布不平衡,在微波场中能迅速吸收电磁波的能量,通过分子偶极作用以每秒 4. 9 ×109 次的超高速振动,提高了分子的平均能量,使反应温度与速度急剧提高。 但其在非极性溶剂(如甲苯、正己烷、乙醚、四氯化碳等) 中吸收 MWI 能量后,通过分子碰撞而转移到非极性分子上,使加热速率大为降低,所以微波不能使这类反应的温度得以显著提高。实际上微波对化学反应的作用是复杂的,除了具有热效应以外,还具有因对反应分子间行为的作用而引起的所谓“非热效应”,已有文献报道此观点。2. 微波有机合成反应技术 与一般的有机反应不同,微波反应需要特定的反应技术并在微波炉中进行。 微波有机合成反应技术一般分为密闭合成反应技术和常压合成反应技术等。随着对微波反应的不断深入研究,微波连续合成反应新技术逐渐形成并得到发展。[color=red]最后有全文下载[/color]
[color=#DC143C]今天为大家推荐一本好书,希望对大家能够有所帮助![/color]书中主要内容如下:第一章 硝化反应第二章 重氮化和重氮盐的转化反应第三章 卤化反应第四章 酰化反应第五章 烃化反应第六章 消除反应第七章 氧化反应第八章 还原反应第九章 重拍反应第十章 缩合反应第十一章 环合反应第十二章 不对称合成反应第十三章 保护基在有机合成中的应用[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=171189]药物合成反应[/url][em09511]
[u][i]精细化工中间体:2004,34(2):1-4[/i][/u][b]微波有机合成及反应器研究新进展[/b][i]刘福萍,陆明[/i]摘 要:综述了近年来微波辐射技术在有机合成应用中的新进展。针对微波有机合成反应技术及专用微波反应器作了重点介绍。关键词:微波化学;有机反应;微波反应器1 前言 微波是频率大约在 300 MHz~300 GHz,即波长在 1000~1 mm 范围内的电磁波,它位于电磁波谱的红外光波和无线电波之间。在 20 世纪 60 年代,N. H. Williams就曾经报道了用微波加速某些化学反应的研究结果,但在化学合成中应用微波技术则直到 20 世纪 80 年代初期才开始,当时人们并未预料到它对化学研究领域的重大作用。微波应用于有机合成的研究则始于 1986 年, Gedye 和 Smith等通过比较常规条件与微波辐射条件下进行酯化、水解、氧化等反应,发现在微波辐射下,反应得到了不同程度的加快,而且有的反应速度被加快了几百倍。至今,微波促进有机合成反应已经越来越被化学界人士所看好,而且形成了一门倍受关注的领域 —MORE化学(Microwave-Induced Organic Reaction Enhancement Chemistry) 。将微波用于有机合成的研究涉及酯化、Diels -Alder、重排、Knoevenagel、Perkin、 Witting、 Reformatsky、 Dveckman、羧醛缩合、开环、烷基化、水解、烯烃加成、消除、取代、自由基、立体选择性、成环、环反转、酯交换、酯胺化、催化氢化、脱羧等反应及糖类化合物、有机金属、放射性药剂等的合成反应。2 微波促进有机反应机理 微波广泛应用于雷达和电讯传输产品中,为了防止微波功率对无线电通讯、广播、电视和雷达造成干扰,国际上规定工业、科学研究、医学及家用微波炉等民用微波频率为 915 ±15 MHz 和 2450 ±50MHz。微波技术应用于有机合成反应,反应速度较常规方法相比有的能加快数倍、数十倍,有些反应能加速数百倍甚至数千倍。为什么微波有如此大的效果呢 ? 目前关于微波加速有机反应的机理,化学界存在着两种观点。一种观点认为,虽然微波是一种内加热,具有加热速度快、加热均匀无温度梯度、无滞后效应等特点,但微波应用化学反应仅仅是一种加热方式,与传统加热反应并无区别。他们认为微波应用于化学反应的频率 2450 MHz 属于非电离辐射,在与分子的化学键共振时不可能引起化学键断裂,也不能使分子激发到更高的转动或振动能级。微波对化学反应的加速主要归结为对极性有机物的选择加热,既微波的致热效应。1990 年,Edwin G. E.Jahngen 等研究了三磷酸腺甙 (ATP) 在微波作用下的水解反应,发现微波作用下反应速度是常规加热方式下的25 倍,但在两种加热方式下,反应动力学并没有明显的改变。1992 年, Kevin D. Raner 等通过研究微波对 2,4,6-三甲基苯甲酸与 2-丙醇的酯化反应速度的影响,也得出结果表明最终酯化产率仅与温度因素有关,而与加热方式无关。
[em09] 高等有机化学 A卷 结构与机理[em09] 高等有机化学 B卷 反应与合成 本书译自美国F.A.凯里和R.J.森德伯格所著《高等有机化学》一书。全书分A卷结构与机理及B卷反应与合成两部分。 A卷共有十二章,前三章讨论有机分子结构的三个基本方面,即成键作用、立体化学和构象。第四章综述了研究有机反应机理所使用的各种方法。其余各章分别讨论机理的基本类型。 B卷共有十一章,前九章讨论了目前有机合成中最重要的反应,并附有与反应有关的机理。第十章讨论一般性合成的技巧。第十一章阐述了高分子合成的某些特征。
求用酰胺合成的异氰酸酯如何分析,反应如何中控?
我公司是个贸易公司,有个厂家推销平行化学合成反应仪,我看了看,发现确实不错,能缩短不少时间。但是考虑到国内一般都是用人低廉,不知道合成单位会不会用这个产品。小弟有些迷茫,还希望这方面的大虾给个建议。有没有市场需求。
6位个性化学合成反应技术参数:1、每个单元独立控制温度 2、每个单元具有独立的磁力搅拌功能;3、反应瓶6个,每个容量30ml 4、控温范围:-10℃—+160℃5、控温精度:±1℃
人名反应在有机合成中的战略性应用都有哪些?
拜托,讲一下水热合成反应釜的具体操作步骤,应该注意哪些事项,谢谢啦[em0904]
要购买常压普及型微波合成反应仪,哪个公司哪个型号比较好?是大专院校用的。MAS-3型微波合成反应仪是上海新仪的,好吗?价格多少?技术参数(包括使用功能、性质用途、安装要求、售后服务内容、保修期限)等标书上要表明的内容,谁能告诉我
我们课题组近几年来常利用微波进行有机合成反应探讨. 不知道北京或邻近地区是否有同好的课题组?
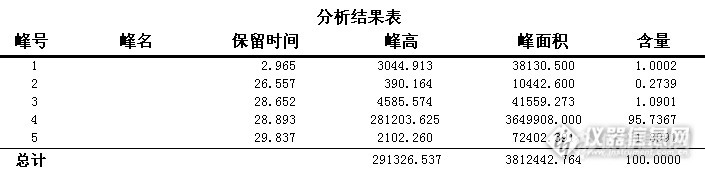
实验目的:研究化合物合成反应监测及分离纯化一般步骤。一、监测合成反应TLC-MS检测,确定是否有合成产物:1、将待测样品通过硅胶板爬板分开。http://ng1.17img.cn/bbsfiles/images/2015/08/201508212000_562106_2307604_3.png(其实板爬的不歪,只是照片上有点歪,截完图就成这样了。)2、利用TLC-MS仪器快速检测TLC板的两个点,确定目标物。http://ng1.17img.cn/bbsfiles/images/2015/08/201508212002_562107_2307604_3.png点1质谱检测图谱:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212106_562110_2307604_3.png点2质谱检测图谱:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212111_562115_2307604_3.png结论:经TLC-MS检测,合成反应有效,点2中含有分子量432的目标物,点1为原料。二:液相分析由于目标物极性较小,液相分析色谱柱选用C18色谱柱保留太强,因此选用保留稍弱的C8色谱柱。色谱条件如下:色谱柱: C8 5 μm 100 Å 4.6*250 mm流动相:A:水 B:乙醇流速:1.0 mL/min检测器:ELSD,65℃梯度:TimeB%0752510035100原样分析图谱:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212115_562117_2307604_3.png27.448min峰为目标峰三、分离纯化:经测试:硅胶柱纯化条件不能把目标物前21-26 min杂质分离除去,C8柱纯化条件不能将26.1 min和27.9 min杂质分离除去。因此最终方案选用C18色谱柱,以甲醇和二氯甲烷为流动相,达到了很好的分离效果。纯化条件如下: 色谱柱:C18 10 μm 100 Å 30*250 mm 流动相:A:甲醇 B:二氯甲烷 流速:35 mL/min 紫外波长:210 nm(红色信号线) ELSD:65℃(浅蓝色信号线) 梯度:TimeB%053035 进样量:300 mg(10mL甲醇溶解) 分流: 流动相进紫外检测器与蒸发光散射检测器的分流比为34.5:0.5 制备图谱如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212116_562118_2307604_3.png馏分收集:收集10.3-11.7 min和21.3-23.4 min馏分四、纯度检测(条件为液相分析条件):1、 10.3-11.7 min馏分:取200 uL馏分,氮吹干,加200 uL甲醇溶解,进样10 uL检测,检测结果如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212117_562119_2307604_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508212118_562120_2307604_3.png2、 21.3-23.4 min馏分:取200 uL馏分,氮吹干,加100 uL甲醇溶解,进样10 uL检测,检测结果如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508212119_562121_2307604_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508212119_562122_2307604_3.png结论:1、合成反应可以利用TLC-MS设备快速监测合成反应成功与否。2、根据待分离样品的极性和硅胶板上的保留,选择合适的填料和流动相,摸索纯化条件。五、总结:1、合成反应可以利用TLC-MS设备快速监测合成反应成功与否。2、根据待分离样品的极性和硅胶板上的保留,选择合适的填料和流动相,摸索纯化条件。六、实验心得:1、利用TLC-MS检测仪,直接检测TLC板上的样品点,不需要将硅胶板上的点刮下来再处理后扫质谱。2、部分极性较小的样品可以用C18色谱柱,配二氯甲烷等弱极性试剂作为流动相进行分析或纯化。3、对于紫外吸收弱的样品,可并联蒸发光散射检测器,由于ELSD为分析型检测器,在大流速制备情况下,需要调节分流比,ELSD的分流速不能高于0.5 mL/min,以防检测器过载。4、制备条件下,由于并联检测器分流比差别大,且检测过程耗时不同,两个检测器在图谱中出现信号的时间就会有差异。这时需要提前判断两个信号的相对延迟时间,通常以流速大的紫外信号作为收集信号。5、紫外下吸收很弱的样品,放大到制备,加大上样量后,紫外下也会有吸收,也可作为制备收集的信号。6、当制备馏分溶剂为弱极性溶剂时,而检测条件的流动相为较强极性流动相,或存在溶剂不互溶问题,需要将制备馏分浓缩干,再用接近检测条件流动相极性的溶剂溶解,进行分析,避免溶剂效应。
高等有机化学没学过,乙腈难道没有办法通过有机反应大规模合成制造吗?
求用羧酸合成酰 氯,羧酸分子350以上,酰 氯如何分析,酰 氯反应如何中控?
苯并吡喃酮作为一个非常重要的结构内核单元,广泛地存在于很多天然产物中,并且是一些具有生物活性的化合物的特定前导化合物。此外该类化合物也因其具有一些光致变色效应和热致变色性质而受到广泛关注。 生物催化作为一种绿色高效的现代有机合成技术,在医药、能源、材料等领域显示出巨大的潜力。酶作为一种高效,环境友好的催化剂,已经成为传统有机金属和小分子催化剂的有效补充,尤其是酶的非专一性在有机合成方面的应用备受研究者的青睐。近些年,已有一系列关于水解酶催化非专一性的C-C键以及C-杂原子键的形成反应的报道,但是对于单酶催化的多步串联反应的报道较少。基于此,我们设计和发展基于水解酶催化非专一性的domino反应,发现枯草杆菌α-淀粉酶可以有效地催化水杨醛和丁烯酮发生oxa-Michael/aldol缩合反应合成2H-苯并吡喃酮类化合物。2H-苯并吡喃酮的生物合成在25 mL烧瓶中加入水杨醛(2 mmol),不饱和醛或酮(10 mmol),50 mg 枯草杆菌α-淀粉酶(BSA),再加入500μL去离子水和4.5 mL DMSO,将其置于50℃恒温摇床中震荡反应(200 rpm)。TLC跟踪检测反应(紫外灯下观测),反应完全后,加入20 mL蒸馏水停止反应,然后用乙酸乙酯萃取(3×10 mL),有机相用无水硫酸钠干燥后,经减压蒸馏除去溶剂,经柱层析分离得目标产物(硅胶:300-400目,流动相:石油醚[font='Times
请教2:谢谢各位专家。我的问题接着楼下,最近我在重复一篇有机合成英国文献,该合成在DMF(二甲基甲酰胺)中进行,根据该文献反应物混合液的pH值应在8.5左右,我用pH试纸则接近文献值,而用pH计则在10左右,有时两种方法测的pH值甚至相差2-3。请问产生两者差距的原因主要有哪些?谢谢,
多肽合成又叫肽链合成,是一个固相合成顺序一般从C端(羧基端)向N端(氨基端)合成。过去的多肽合成是在溶液中进行的称为液相合成法。多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。请移步百度搜“合肥国肽生物”即可多肽合成的原理多肽合成就是如何把各种氨基酸单位按照天然物的氨基酸排列顺序和连接方式连接起来。由于氨基酸在中性条件下是以分子内的两性离子形式(H3+NCH(R)COO-)存在,因此,氨基酸之间直接缩合形成酰胺键的反应在一般条件下是难于进行的。氨基酸酯的反应活性较高。在100℃下加热或者室温下长时间放置都能聚合生成肽酯,但反应并没有定向性,两种氨基酸a1和a2的酯在聚合时将生成a1a2…、a1a1…、a2a1…等各种任意顺序的混合物。为了得到具有特定顺序的合成多肽,采用任意聚合的方法是行不通的,而只能采用逐步缩合的定向多肽合成方法。一般是如下式所示,即先将不需要反应的氨基或羧基用适当的基团暂时保护起来,然后再进行连接反应,以保证多肽合成的定向进行。式中的X和Q分别为氨基和羧基的保护基,它不仅可以防止乱接副反应的发生,还具有能消除氨基酸的两性离子形式,并使之易溶于有机溶剂的作用。Q在有的情况下也可以不是共价连接的基团,而是由有机强碱(如三乙胺)同氨基酸的羧基氢离子组成的有机阳离子。Y为一强的吸电子基团,它能使羧基活化,而有利于另一氨基酸的自由氨基,对其活化羧基的羧基碳原子进行亲核进攻生成酰胺键。由此所得的连接产物是N端和C端都带有保护基的保护肽,要脱去保护基后才能得到自由的肽。如果肽链不是到此为止,而是还需要从N端或C端延长肽链的话,则可以先选择性地脱去X或Q,然后再同新的N保护氨基酸(或肽)或C保护的氨基酸(或肽)进行第二次连接,并依次不断重复下去,直到所需要的肽链长度为止。对于长肽的多肽合成来说,一般有逐步增长和片段缩合两种伸长肽链的方式,前者是由起始的氨基酸(或肽)开始。每连接一次,接长一个氨基酸,后者则是用N保护肽同C保护肽缩合来得到两者长度相加的新的长肽链。对于多肽合成中含有谷氨酸、天冬氨酸、赖氨酸、精氨酸、组氨酸、半胱氨酸等等带侧链功能团的氨基酸的肽来说,为了避免由于侧链功能团所带来的副反应,一般也需要用适当的保护基将侧链基团暂时保护起来。多肽合成方法分类多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。化学合成主要是以氨基酸与氨基酸之间缩合的形式来进行。在合成含有特定顺序的多肽时,由于多肽合成原料中含有官能度大于2的氨基酸单体,多肽合成时应将不需要反应的基团暂时保护起来,方可进行成肽反应,这样保证了多肽合成目标产物的定向性。多肽的化学合成又分为液相合成和固相合成。多肽液相合成主要分为逐步合成和片段组合两种策略。逐步合成简洁迅速,可用于各种生物活性多肽片段的合成。片段组合法主要包括天然化学连接和施陶丁格连接。近年,多肽液相片段合成法发展迅速,在多肽和蛋白质合成领域已取得了重大突破。在多肽片段合成法中,根据多肽片段的化学特定性或化学选择性,多肽片段能够自发进行连接,得到目标多肽。因为多肽片段含有的氨基酸残基相对较少,所以纯度较高,且易于纯化。多肽的生物合成方法主要包括发酵法、酶解法,随着生物工程技术的发展,以DNA重组技术为主导的基因工程法也被应用于多肽的合成。多肽的固相合成多肽的合成是氨基酸重复添加的过程,通常从C端向N端(氨基端)进行合成。多肽固相合成的原理是将目的肽的第一个氨基酸C端通过共价键与固相载体连接,再以该氨基酸N端为合成起点,经过脱去氨基保护基和过量的已活化的第二个氨基酸进行反应,接长肽链,重复操作,达到理想的合成肽链长度,最后将肽链从树脂上裂解下来,分离纯化,获得目标多肽。1、Boc多肽合成法Boc方法是经典的多肽固相合成法,以Boc作为氨基酸α-氨基的保护基,苄醇类作为侧链保护基,Boc的脱除通常采用三氟乙酸(TFA)进行。多肽合成时将已用Boc保护好的N-α-氨基酸共价交联到树脂上,TFA切除Boc保护基,N端用弱碱中和。肽链的延长通过二环己基碳二亚胺(DCC)活化、偶联进行,最终采用强酸氢氟酸(HF)法或三氟甲磺酸(TFMSA)将合成的目标多肽从树脂上解离。在Boc多肽合成法中,为了便于下一步的多肽合成,反复用酸进行脱保护,一些副反应被带入实验中,例如多肽容易从树脂上切除下来,氨基酸侧链在酸性条件不稳定等。2、Fmoc多肽合成法Carpino和Han以Boc多肽合成法为基础发展起来一种多肽固相合成的新方法——Fmoc多肽合成法。Fmoc多肽合成法以Fmoc作为氨基酸α-氨基的保护基。其优势为在酸性条件下是稳定的,不受TFA等试剂的影响,应用温和的碱处理可脱保护,所以侧链可用易于酸脱除的Boc保护基进行保护。肽段的最后切除可采用TFA/二氯甲烷(DCM)从树脂上定量完成,避免了采用强酸。同时,与Boc法相比,Fmoc法反应条件温和,副反应少,产率高,并且Fmoc基团本身具有特征性紫外吸收,易于监测控制反应的进行。Fmoc法在多肽固相合成领域应用越来越广泛。多肽液相分段合成随着多肽合成的发展,多肽液相分段合成(即多肽片段在溶液中依据其化学专一性或化学选择性,自发连接成长肽的合成方法)在多肽合成领域中的作用越来越突出。其特点在于可以用于长肽的合成,并且纯度高,易于纯化。多肽液相分段合成主要分为天然化学连接和施陶丁格连接。天然化学连接是多肽分段合成的基础方法,局限在于所合成的多肽必须含半光氨酸(Cys)残基,因而限定了天然化学连接方法的应用范围。天然化学连接方法的延伸包括化学区域选择连接、可除去辅助基连接、光敏感辅助基连接。施陶丁格连接方法是另一种基础的片段连接方法,其为多肽片段连接途径开拓了更广阔的思路。正交化学连接方法是施陶丁格连接方法的延伸,通过简化膦硫酯辅助基来提高片段间的缩合率。其他多肽合成方法1、氨基酸的羧内酸酐法(NCA)氨基酸的羧内酸酐的氨基保护基也可活化羧基。NCA的原理:在碱性条件下,氨基酸阴离子与NCA形成一个更稳定的氨基甲酸酯类离子,在酸化时该离子失去二氧化碳,生成二肽。生成的二肽又与其他的NCA结合,反复进行。NCA适用于短链肽片段的多肽合成,其周期短、操作简单、成本低、得到产物分子量高,在目前多肽合成中所占比例较大,技术也较为通用。2、组合化学法20世纪80年代,以固相多肽合成为基础提出了组合化学法,即氨基酸的构建单元通过组合的方式进行连接,合成出含有大量化合物的化学库,并从中筛选出具有某种理化性质或药理活性化合物的一套多肽合成策略和筛选方案。组合化学法的多肽合成策略主要包括:混合-均分法、迭代法、光控定位组合库法、茶叶袋法等。组合化学法的最大优点在于可同时合成多种化合物,并且能最大限度地筛选各种新化合物及其异构体。3、酶解法酶解法是用生物酶降解植物蛋白质和动物蛋白质,获得小分子多肽。酶解法因其多肽产量低、投资大、周期长、污染严重,未能实现工业化生产。酶解法获得的多肽能够保留蛋白质原有的营养价值,并且可以获得比原蛋白质更多的功能,更加绿色,更加健康。4、基因工程法基因工程法主要以DNA重组技术为基础,通过合适的DNA模板来控制多肽的序列合成。有研究者通过基因工程法获得了准弹性蛋白-聚缬氨酸-脯氨酸-甘氨酸-缬氨酸-甘氨酸肽(VPGVG)。利用基因工程技术生产的活性多肽还有肽类抗生素、干扰素类、白介素类、生长因子类、肿瘤坏死因子、人生长激素,血液中凝血因子、促红细胞生成素,组织非蛋白纤溶酶原等。基因工程法合成多肽具有表达定向性强,安全卫生,原料来源广泛和成本低等优点,但因存在高效表达,不易分离,产率低的问题,难以实现规模化生产。5、发酵法发酵法是从微生物代谢产物中获得多肽的方法。虽然发酵法的成本低,但其应用范围较窄,因为现在微生物能够独立合成的聚氨基酸只有ε-聚赖氨酸(ε-PL)、γ-聚谷氨酸(γ-PGA)和蓝细菌肽。[align=center][img=,770,348]https://ng1.17img.cn/bbsfiles/images/2019/03/201903151633244062_8177_3531468_3.jpg!w770x348.jpg[/img][/align]请移步百度搜“合肥国肽生物”即可我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。
各位大哥大姐:我现在在做一个抗生素的化学酰化反应,用HPLC控制反应,我用流动相:ph8的缓冲液:乙腈=95:5,产物在4分钟出峰,副产物在2.5分钟出峰,底物在6分钟出峰,我想请问如果我想得到产物,用什么办法可以得到啊?如果我用树脂分离,选用何种树脂比较好?
前段时间实验室试用了一家仪器公司代理的进口流动合成仪,效果蛮好的。就是类似于微管道反应器,反应液边流动边反应。之前做了两个实验,都是平时很迟钝的那种,一天一夜或者两天两夜那种,后来使用流动合成仪,增加了系统压力从而可以大大升高反应温度,实验进行了一个小时就达到甚至比之前的反应效果还好。正好我们实验室有一个才从国外回来的博后,他以前就用过流动合成,效率提高很多,也完成了一些平时烧瓶条件不好进行的反应,尤其是在新药研发和条件优化时具有很大的优势。大家有没有知道这款仪器的呢?想多交流交流。加上最近听到的关于流动化学的讲座,我觉得这样的仪器在国内市场上会有很大前景的哦,不过需要一个过程,不知道大家怎么看。
做高压反应釜实验时,我做的样品沸点才20度,加完样,升温加压前需抽真空吗,会把样品抽走吗?

合成多肽是α-氨基酸以肽链连接在一起而形成的化合物,它也是蛋白质水解的中间产物。 由两个氨基酸分子脱水缩合而成的化合物叫做二肽,同理类推还有三肽、四肽、五肽等。合成多肽方法分类 多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。 化学合成主要是以氨基酸与氨基酸之间缩合的形式来进行。在合成含有特定顺序的多肽时,由于多肽合成原料中含有官能度大于2的氨基酸单体,多肽合成时应将不需要反应的基团暂时保护起来,方可进行成肽反应,这样保证了多肽合成目标产物的定向性。多肽的化学合成又分为液相合成和固相合成。 多肽液相合成主要分为逐步合成和片段组合两种策略。逐步合成简洁迅速,可用于各种生物活性多肽片段的合成。片段组合法主要包括天然化学连接和施陶丁格连接。近年,多肽液相片段合成法发展迅速,在多肽和蛋白质合成领域已取得了重大突破。在多肽片段合成法中,根据多肽片段的化学特定性或化学选择性,多肽片段能够自发进行连接,得到目标多肽。因为多肽片段含有的氨基酸残基相对较少,所以纯度较高,且易于纯化。 多肽的生物合成方法主要包括发酵法、酶解法,随着生物工程技术的发展,以DNA重组技术为主导的基因工程法也被应用于多肽的合成。合成多肽的原理 多肽合成就是如何把各种氨基酸单位按照天然物的氨基酸排列顺序和连接方式连接起来。由于氨基酸在中性条件下是以分子内的两性离子形式(H3+NCH(R)COO-)存在,因此,氨基酸之间直接缩合形成酰胺键的反应在一般条件下是难于进行的。氨基酸酯的反应活性较高。在100℃下加热或者室温下长时间放置都能聚合生成肽酯,但反应并没有定向性,两种氨基酸a1和a2的酯在聚合时将生成a1a2…、a1a1…、a2a1…等各种任意顺序的混合物。 为了得到具有特定顺序的合成多肽,采用任意聚合的方法是行不通的,而只能采用逐步缩合的定向多肽合成方法。一般是如下式所示,即先将不需要反应的氨基或羧基用适当的基团暂时保护起来,然后再进行连接反应,以保证多肽合成的定向进行。 式中的X和Q分别为氨基和羧基的保护基,它不仅可以防止乱接副反应的发生,还具有能消除氨基酸的两性离子形式,并使之易溶于有机溶剂的作用。 Q在有的情况下也可以不是共价连接的基团,而是由有机强碱(如三乙胺)同氨基酸的羧基氢离子组成的有机阳离子。Y为一强的吸电子基团,它能使羧基活化,而有利于另一氨基酸的自由氨基,对其活化羧基的羧基碳原子进行亲核进攻生成酰胺键。 由此所得的连接产物是N端和C端都带有保护基的保护肽,要脱去保护基后才能得到自由的肽。如果肽链不是到此为止,而是还需要从N端或C端延长肽链的话,则可以先选择性地脱去X或Q,然后再同新的N保护氨基酸(或肽)或C保护的氨基酸(或肽)进行第二次连接,并依次不断重复下去,直到所需要的肽链长度为止。 对于长肽的多肽合成来说,一般有逐步增长和片段缩合两种伸长肽链的方式,前者是由起始的氨基酸(或肽)开始。每连接一次,接长一个氨基酸,后者则是用N保护肽同C保护肽缩合来得到两者长度相加的新的长肽链。 对于多肽合成中含有谷氨酸、天冬氨酸、赖氨酸、精氨酸、组氨酸、半胱氨酸等等带侧链功能团的氨基酸的肽来说,为了避免由于侧链功能团所带来的副反应,一般也需要用适当的保护基将侧链基团暂时保护起来。[img=,690,163]https://ng1.17img.cn/bbsfiles/images/2019/02/201902191018209926_3198_3531468_3.jpg!w690x163.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。请移步百度搜“合肥国肽生物”即可
多肽合成是一个重复添加氨基酸的过程,固相合成顺序一般从C端(羧基端)向 N端(氨基端)合成。固相合成法,大大的减轻了每步产品提纯的难度。为了防止副反应的发生,参加反应的氨基酸的侧链都是保护的。羧基端是游离的,并且在反应之前必须活化。固相合成方法有两种,即Fmoc和tBoc。由于Fmoc比tBoc存在很多优势,现在大多采用Fmoc法合成。【详情请咨询合肥国肽生物】(1)具体合成由下列几个循环组成:1. 去保护:Fmoc保护的柱子和单体必须用一种碱性溶剂(piperidine)去 除氨基的保护基团。2. 激活和交联:下一个氨基酸的羧基被一种活化剂所活化。活化的单体与游离的氨基反应交联,形成肽键。在此步骤使用大量的超浓度试剂驱使反应完成。循环:这两步反应反复循环直到合成完成。3. 洗脱和脱保护:多肽从柱上洗脱下来,其保护基团被一种脱保护剂(TFA) 洗脱和脱保护。(2)树脂的选择及氨基酸的固定将固相合成与其他技术分开来的最主要的特征是固相载体,能用于多肽合成的固相载体必须满足如下要求:必须包含反应位点(或反应基团),以使肽链连在这些位点上,并在以后除去;必须对合成过程中的物理和化学条件稳定;载体必须允许在不断增长的肽链和试剂之间快速的、不受阻碍的接触;另外,载体必须允许提供足够的连接点,以使每单位体积的载体给出有用产量的肽,并且必须尽量减少被载体束缚的肽链之间的相互作用。用于固相法合成多肽的高分子载体主要有三类:聚苯乙烯-苯二乙烯交联树脂、聚丙烯酰胺、聚乙烯-乙二醇类树脂及衍生物,这些树脂只有导入反应基团,才能直接连上(第一个)氨基酸。根据所导入反应基团的不同,又把这些树脂及树脂衍生物分为氯甲基树脂、羧基树脂、氨基树脂或酰肼型树脂。BOC合成法通常选择氯甲基树脂,如Merrifield树脂;FMOC合成法通常选择羧基树脂如王氏树脂。氨基酸的固定主要是通过保护氨基酸的羧基同树脂的反应基团之间形成的共价键来实现的,形成共价键的方法有多种:氯甲基树脂,通常先制得保护氨基酸的四甲铵盐或钠盐、钾盐、铯盐,然后在适当温度下,直接同树脂反应或在合适的有机溶剂如二氧六环、DMF或DMSO中反应;羧基树脂,则通常加入适当的缩合剂如DCC或羧基二咪唑,使被保护氨基酸与树脂形成共酯以完成氨基酸的固定;氨基树脂或酰肼型树脂,却是加入适当的缩合剂如DCC后,通过保护氨基酸与树脂之间形成的酰胺键来完成氨基酸的固定。(3)氨基、羧基、侧链的保护及脱除要成功合成具有特定的氨基酸顺序的多肽,需要对暂不参与形成酰胺键的氨基和羧基加以保护,同时对氨基酸侧链上的活性基因也要保护,反应完成后再将保护基因除去。同液相合成一样,固相合成中多采用烷氧羰基类型作为α氨基的保护基,因为这样不易发生消旋。最早是用苄氧羰基,由于它需要较强的酸解条件才能脱除,所以后来改为叔丁氧羰基(BOC)保护,用TFA(三氟乙酸)脱保护,但不适用含有色氨酸等对酸不稳定的肽类的合成。chang Meienlofer和Atherton等人采用Carpino报道的Fmoc(9-芴甲氧羰基)作为α氨基保护基,Fmoc基对酸很稳定,但能用哌啶-CH2CL2或哌啶-DMF脱去,近年来,Fmoc合成法得到了广泛的应用。羧基通常用形成酯基的方法进行保护。甲酯和乙酯是逐步合成中保护羧基的常用方法,可通过皂化除去或转变为肼以便用于片断组合;叔丁酯在酸性条件下除去;苄酯常用催化氢化除去。对于合成含有半胱氨酸、组氨酸、精氨酸等带侧链功能基的氨基酸的肽来说,为了避免由于侧链功能团所带来的副反应,一般也需要用适当的保护基将侧链基团暂时保护起来。保护基的选择既要保证侧链基团不参与形成酰胺的反应,又要保证在肽合成过程中不受破坏,同时又要保证在最后肽链裂解时能被除去。如用三苯甲基保护半胱氨酸的S-,用酸或银盐、汞盐除去;组氨酸的咪唑环用2,2,2-三氟-1-苄氧羰基和2,2,2-三氟-1-叔丁氧羰基乙基保护,可通过催化氢化或冷的三氟乙酸脱去。精氨酸用金刚烷氧羰基(Adoc)保护,用冷的三氟乙酸脱去。我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:0551-62626599
多肽合成技术主要采用多肽合成仪,以固相合成为反应原理,在密闭的防爆玻璃反应器中使氨基酸按照已知顺序(序列,一般从C端-羧基端 向 N端-氨基端)不断添加、反应、合成,操作最终得到多肽载体。固相合成法,大大的减轻了每步产品提纯的难度。为了防止副反应的发生,参加反应的氨基酸的侧链都是保护的。羧基端是游离的,并且在反应之前必须活化。固相合成方法有两种,即Fmoc和tBoc。由于Fmoc比tBoc存在很多优势,现在大多采用Fmoc法合成,但对于某些短肽,tBoc因其产率高的优势仍然被很多企业所采用。【请移步百度搜“[b]合肥国肽生物[/b]”即可】具体合成由下列几个循环组成:(1)去保护:Fmoc保护的柱子和单体必须用一种碱性溶剂(piperidine)去 除氨基的保护基团。(2)激活和交联:下一个氨基酸的羧基被一种活化剂所活化。活化的单体与游离的氨基反应交联,形成肽键。在此步骤使用大量的超浓度试剂驱使反应完成。循环:这两步反应反复循环直到合成完成。(3)洗脱和脱保护:多肽从柱上洗脱下来,其保护基团被一种脱保护剂(TFA) 洗脱和脱保护。多肽的分类多肽有生物活性多肽和人工合成多肽两种。1、生物活性肽生物活性肽(Bioactive Peptides ,BAP)是对生物机体的生命活动有益或是具有生理作用的肽类化合物,是一类相对分子质量小于6000Da , 具有多种生物学功能的多肽。生物活性肽具有多种人体代谢和生理调节功能,易消化吸收,有促进免疫、激素调节、抗菌、抗病毒、降血压、降血脂等作用,是当前国际食品界最热门的研究课题和极具发展前景的功能因子。2、人工合成多肽固相多肽合成方法(SPPS),由于其合成方便,迅速,成为多肽合成的首选方法,而且带来了多肽有机合成上的一次**,并成为了一支独立的学科——固相有机合成,固相合成的发明同时促进了肽合成的自动化。世界上第一台真正意义上的多肽合成仪出现在1980年代初期。基于将单个N-α保护氨基酸反复加到生长的氨基成份上,合成一步步地进行, 通常从合成链的C端氨基酸开始,接着的单个氨基酸的连接通过用DCC,混合炭酐, 或N-carboxy酐方法实现。Carbodiimide方法包括用DCC做连接剂连接N-和C-保护氨基酸。重要的是, 这种连接试剂促接N保护氨基酸自己炭基和C保护氨基酸自由氨基间的缩水,形成肽链, 同时产出N,N?/FONT-dyaylcohercylurea副产物。多肽合成方法1、酸酐法在多肽合成中,最初考虑应用酸酐要追溯到1881年Theodor Curtius对苯甲酰基氨基乙酸合成的早期研究。从氨基乙酸银与苯甲酰氯的反应中,除获得苯甲酰氨基乙酸外,还得到了BZ-Glyn-OH(n=2-6)。早期曾认为,当用苯甲酰氯处理时,N-苯甲酰基氨基酸或N-苯甲酰基肽与苯甲酸形成了活性中间体不对称酸酐。 大约在70年后,Theodor Wieland利用这些发现将混合酸酐法用于现代多肽合成。目前,除该方法外,对称酸酐以及由氨基酸的羧基和氨基甲酸在分子内形成的N-羧基内酸酐(NCA,Leuchs anhydrides)也用肽缩合。最后应该提到,不对称酸酐常常参与生化反应中的酰化反应。2、混合酸酐法有机羧酸和无机酸皆可用于混合酸酐的形成。然而,仅有几个得到了广泛的实际应用,多数情况下,采用氯甲酸烷基酯。过去频繁使用的氯甲酸乙酯,目前主要被氯甲酸异丁酯所替代。由羧基组分和氯甲酸酯起始形成的混合酸酐,其氨解反应的区域选择性依赖依赖于两个互相竞争的羰基的亲电性和(或)空间位阻。在由N保护的氨基酸羧酸盐(羧基组分)和氯甲酸烷基酯(活化组分,例如源于氯甲酸烷基酯)形成混合酸酐时,亲核试剂胺主要进攻氨基酸组分的羧基,形成预期的肽衍生物,并且释放出游离酸形式的活性成分。3、酰基叠氮物法酰基叠氮物法早在1902年就被引入到肽化学中,因此它是最古老的缩合方法之一。在碱性水溶液中,除了与酰基叠氨缩合的游离氨基酸和肽以外,氨基酸酯可用于有机溶剂中。与其他许多缩合方法不同的是,它不需要增加辅助碱或另一等当量的氨基组分来捕获腙酸。 长期以来,一直认为叠氮物法是唯一不发生消旋的缩合方法,随着可选择性裂解的氨基酸保护基引入,该方法经历了一次大规模的复兴。该方法的起始原料分别是晶体状的氨基酸酰肼或肽酰肼64,通过肼解相应的酯很容易得到。4、对称酸酐法Nα-酰基氨基酸的对称酸酐是用于肽键形成的高活性中间体。与混合酸酐法多肽合成相反,它与胺亲核试剂的反应没有模棱两可的区域选择性。但肽缩合产率最高,为50%(以羧基组分计)。虽然由对称酸酐氨解形成的游离Nα-酰基氨基酸可以和目标肽一起,通过饱和碳酸氢钠溶液萃取回收,但在最初,这种方法的实用价值极低。对称酸酐可以用Nα-保护氨基酸与光气,或方便的碳二亚胺反应制得。两当量的Nα-保护氨基酸与-当量的碳二亚胺反应有利于对称酸酐的形成,对称酸酐可以分离出来,也可不经纯化而直接用于后面的缩合反应。基于Nα-烷氧羰基氨基酸的对称酸酐对水解稳定,可采用类似上述纯化混合酸酐的方法进行纯化。[img=,690,300]https://ng1.17img.cn/bbsfiles/images/2019/04/201904221451156040_1751_3531468_3.jpg!w690x300.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
摘 要:微波对物质的作用机理及微波合成反应技术是目前微波化学研究的重点。本文简要介绍了微波化学的发展历史,讨论了微波对反应体系的热效应和非热效应,研究了微波合成反应技术的发展以及在有机合成方面的应用。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=23209]微波合成技术及在有机合成中的应用[/url]
鉴于水热合成1QQ群*******已满,新建水热合成2群39444565,大家进啊,进了1群的请不要进2群了!材料制备,晶体生长分子筛研究,药物合成纳米材料合成水热合成反应釜用到的进啊

多肽合成方法分类多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。化学合成主要是以氨基酸与氨基酸之间缩合的形式来进行。在合成含有特定顺序的多肽时,由于多肽合成原料中含有官能度大于2的氨基酸单体,多肽合成时应将不需要反应的基团暂时保护起来,方可进行成肽反应,这样保证了多肽合成目标产物的定向性。多肽的化学合成又分为液相合成和固相合成。【合肥国肽生物】多肽液相合成主要分为逐步合成和片段组合两种策略。逐步合成简洁迅速,可用于各种生物活性多肽片段的合成。片段组合法主要包括天然化学连接和施陶丁格连接。近年,多肽液相片段合成法发展迅速,在多肽和蛋白质合成领域已取得了重大突破。在多肽片段合成法中,根据多肽片段的化学特定性或化学选择性,多肽片段能够自发进行连接,得到目标多肽。因为多肽片段含有的氨基酸残基相对较少,所以纯度较高,且易于纯化。多肽的生物合成方法主要包括发酵法、酶解法,随着生物工程技术的发展,以DNA重组技术为主导的基因工程法也被应用于多肽的合成。多肽的固相合成多肽的合成是氨基酸重复添加的过程,通常从C端向N端(氨基端)进行合成。多肽固相合成的原理是将目的肽的第一个氨基酸C端通过共价键与固相载体连接,再以该氨基酸N端为合成起点,经过脱去氨基保护基和过量的已活化的第二个氨基酸进行反应,接长肽链,重复操作,达到理想的合成肽链长度,最后将肽链从树脂上裂解下来,分离纯化,获得目标多肽。1、Boc多肽合成法Boc方法是经典的多肽固相合成法,以Boc作为氨基酸α-氨基的保护基,苄醇类作为侧链保护基,Boc的脱除通常采用三氟乙酸(TFA)进行。多肽合成时将已用Boc保护好的N-α-氨基酸共价交联到树脂上,TFA切除Boc保护基,N端用弱碱中和。肽链的延长通过二环己基碳二亚胺(DCC)活化、偶联进行,最终采用强酸氢氟酸(HF)法或三氟甲磺酸(TFMSA)将合成的目标多肽从树脂上解离。在Boc多肽合成法中,为了便于下一步的多肽合成,反复用酸进行脱保护,一些副反应被带入实验中,例如多肽容易从树脂上切除下来,氨基酸侧链在酸性条件不稳定等。2、Fmoc多肽合成法Carpino和Han以Boc多肽合成法为基础发展起来一种多肽固相合成的新方法——Fmoc多肽合成法。Fmoc多肽合成法以Fmoc作为氨基酸α-氨基的保护基。其优势为在酸性条件下是稳定的,不受TFA等试剂的影响,应用温和的碱处理可脱保护,所以侧链可用易于酸脱除的Boc保护基进行保护。肽段的最后切除可采用TFA/二氯甲烷(DCM)从树脂上定量完成,避免了采用强酸。同时,与Boc法相比,Fmoc法反应条件温和,副反应少,产率高,并且Fmoc基团本身具有特征性紫外吸收,易于监测控制反应的进行。Fmoc法在多肽固相合成领域应用越来越广泛。多肽液相分段合成随着多肽合成的发展,多肽液相分段合成(即多肽片段在溶液中依据其化学专一性或化学选择性,自发连接成长肽的合成方法)在多肽合成领域中的作用越来越突出。其特点在于可以用于长肽的合成,并且纯度高,易于纯化。多肽液相分段合成主要分为天然化学连接和施陶丁格连接。天然化学连接是多肽分段合成的基础方法,局限在于所合成的多肽必须含半光氨酸(Cys)残基,因而限定了天然化学连接方法的应用范围。天然化学连接方法的延伸包括化学区域选择连接、可除去辅助基连接、光敏感辅助基连接。施陶丁格连接方法是另一种基础的片段连接方法,其为多肽片段连接途径开拓了更广阔的思路。正交化学连接方法是施陶丁格连接方法的延伸,通过简化膦硫酯辅助基来提高片段间的缩合率。其他多肽合成方法1、氨基酸的羧内酸酐法(NCA)氨基酸的羧内酸酐的氨基保护基也可活化羧基。NCA的原理:在碱性条件下,氨基酸阴离子与NCA形成一个更稳定的氨基甲酸酯类离子,在酸化时该离子失去二氧化碳,生成二肽。生成的二肽又与其他的NCA结合,反复进行。NCA适用于短链肽片段的多肽合成,其周期短、操作简单、成本低、得到产物分子量高,在目前多肽合成中所占比例较大,技术也较为通用。2、组合化学法20世纪80年代,以固相多肽合成为基础提出了组合化学法,即氨基酸的构建单元通过组合的方式进行连接,合成出含有大量化合物的化学库,并从中筛选出具有某种理化性质或药理活性化合物的一套多肽合成策略和筛选方案。组合化学法的多肽合成策略主要包括:混合-均分法、迭代法、光控定位组合库法、茶叶袋法等。组合化学法的最大优点在于可同时合成多种化合物,并且能最大限度地筛选各种新化合物及其异构体。3、酶解法酶解法是用生物酶降解植物蛋白质和动物蛋白质,获得小分子多肽。酶解法因其多肽产量低、投资大、周期长、污染严重,未能实现工业化生产。酶解法获得的多肽能够保留蛋白质原有的营养价值,并且可以获得比原蛋白质更多的功能,更加绿色,更加健康。4、基因工程法基因工程法主要以DNA重组技术为基础,通过合适的DNA模板来控制多肽的序列合成。有研究者通过基因工程法获得了准弹性蛋白-聚缬氨酸-脯氨酸-甘氨酸-缬氨酸-甘氨酸肽(VPGVG)。利用基因工程技术生产的活性多肽还有肽类抗生素、干扰素类、白介素类、生长因子类、肿瘤坏死因子、人生长激素,血液中凝血因子、促红细胞生成素,组织非蛋白纤溶酶原等。基因工程法合成多肽具有表达定向性强,安全卫生,原料来源广泛和成本低等优点,但因存在高效表达,不易分离,产率低的问题,难以实现规模化生产。5、发酵法发酵法是从微生物代谢产物中获得多肽的方法。虽然发酵法的成本低,但其应用范围较窄,因为现在微生物能够独立合成的聚氨基酸只有ε-聚赖氨酸(ε-PL)、γ-聚谷氨酸(γ-PGA)和蓝细菌肽。[img=,457,333]https://ng1.17img.cn/bbsfiles/images/2019/04/201904221507346400_2482_3531468_3.jpg!w457x333.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
多肽化学合成方法,包括液相和固相两种方法。液相合成方法现在主要采用BOC和Z两种保护方法,现在主要应用在短肽合成,如阿斯巴甜,力肽,催产素等,其相对与固相合成,具有保护基选择多,成本低廉,合成规模容易放大的许多优点。【请移步百度搜“合肥国肽生物”即可】与固相合成比较,液相合成主要缺点是,合成范围小,一般都集中在10个氨基酸以内的多肽合成,还有合成中需要对中间体进行提纯,时间长,工作量大。固相合成方法现在主要采用FMOC和BOC两种方法,它具有合成方便,迅速,容易实现自动化,而且可以比较容易的合成到30个氨基酸左右多肽。1.氨基酸保护基 20种常见氨基酸,根据侧链可以分为几类:脂肪族氨基酸(Ala,Gly,Val,Leu,Ile,),芳香族氨基酸(Phe,Tyr,Trp,His),酰胺或羧基侧链氨基酸(Asp,Glu,Asn,Gln),碱性侧链氨基酸(Lys,Arg),含硫氨基酸(Cys,Met),含醇氨基酸(Ser,Thr),亚氨型基酸(Pro)。多肽化学合成中氨基酸的保护非常关键,直接决定了合成能够成功的关键。因为常见的20中氨基酸中有很多都是带有活性侧链的,需要进行保护,一般要求,这些保护基在合成过程中稳定,无副反应,合成结束后可以完全定量的脱除。合成中需要进行保护的氨基酸包括:Cys,Asp,Glu,His,Lys,Asn,Gln,Arg,Ser,Thr,Trp,Tyr。需要进行保护的基团:羟基,羧基,巯基,氨基,酰胺基,胍基,吲哚,咪唑等。其中Trp也可以不保护,因为吲哚性质比较稳定。当然在特殊的情况下,有些氨基酸也可以不保护,象,Asn,Gln ,Thr,Tyr。氨基酸侧链保护基团非常多,同一个侧链有多种不同的保护基,可以在不同的条件下选择性的脱除,这点在环肽以及多肽修饰上具有很重要的意义。而且侧链保护基和选择的合成方法有密切的关系,液相和固相不一样,固相中BOC和FMOC策略也不一样,从某种意义上看,多肽化学就是氨基酸保护基的灵活运用与搭配。关于侧链保护基的使用,请参考王德心的《固相有机合成——原理及应用指南》第四章,我们这里主要介绍Cys,Lys,Asp的几种保护基及其脱除方法。Cys最常见的保护基有三种,Trt,Acm,Mob,这三个保护基可以完成多对二硫键多肽的合成。Lys最常见的保护基有:Boc,Fmoc,Trt,Dde,Allyl,这对于固相合成环肽提供了很多正交的保护策略。Asp最常见的保护基有:Otbu,OBzl,OMe,OAll,OFm,同样也提供了多种正交的保护策略。2.多肽缩合试剂 目前多肽合成中,主要采用羧基活化方法来完成接肽反应,最早使用的是将氨基酸活化为酰氯,叠氮,对称酸酐以及混合酸酐的方法,但是由于这些条件下,存在氨基酸消旋,以及反应试剂危险以及制备比较复杂,逐渐被后来的缩合试剂取代,按照其结构可以分为两种:缩合试剂主要有:碳二亚胺型,鎓盐型(Uronium)。3.碳二亚胺型 主要包括:DCC,DIC,EDC.HCl等。采用DCC进行反应,由于反应中生成的DCU,在DMF中溶解度很小,产生白色沉淀,所以一般不用在固相合成中,但是由于其价格便宜,在液相合成中,可以通过过滤除去,应用仍然相当广泛。EDC.HCl因为其水溶解性的特点,在多肽与蛋白的连接中使用比较多,而且也相当成功。但是该类型的缩合试剂的一个最大的缺点,就是如果单独使用,会有比较多的副反应,但是研究表明如果在活化过程中添加HOBt,HOAt等试剂,可以将其副反应控制在很低的范围。多肽合成方法比较 1.液相多肽合成(solution phase synthesis) 液相多肽合成现在仍然广泛的使用,在合成短肽和多肽片段上具有合成规模大,合成成本低的显著优点,而且由于是在均相中进行反应,可以选择的反应条件更加丰富,象一些催化氢化,碱性水解等条件,都可以使用,这在固相中,使用却由于反应效率低,以及副反应等原因,无法应用。液相多肽合成中主要采用BOC和Z两种反应策略。2.固相多肽合成固相多肽合成现在使用的主要有两种策略:BOC和FMOC两种。BOC方法合成过程中,需要反复使用TFA脱BOC,而且在最后从树脂上切割下来需要使用HF,由于HF必须使用专门的仪器进行操作,而且切割过程中容易产生副反应,因此现在使用受到实验条件限制,使用也逐渐减少。FMOC方法反应条件温和,在一般的实验条件下就可以进行合成,因此,也得到了非常广泛的应用。[align=center][img=,770,348]https://ng1.17img.cn/bbsfiles/images/2019/03/201903151637572385_7105_3531468_3.jpg!w770x348.jpg[/img][/align]请移步百度搜“合肥国肽生物”即可我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。
固相合成 固相合成(Solid PhaseSynthesis)通常是指连接在固相载体(如树脂等)上的活性官能团与溶解在有机溶剂中的试剂之间的反应。在肽固相合成中,肽链的延长是在不溶性的聚苯乙烯树脂载体上进行的。合成多肽的C-末端先和氯甲基聚苯乙烯树脂(氯化苄酯树脂)反应形成苄酯,然后按肽链一级结构的顺序将氨基端已被保护的氨基酸逐个加上去,使肽链延长。固相法比液相法简单,时间缩短,可以自动化。在我国医药工业上已经得到应用。逗点生物推出的固相合成用筛板,选用高分子材料加工而成,有广泛的溶剂兼容性。
[align=center][size=21px]化药合成的几个重要环节[/size][/align][size=16px] 现在生活水平提高了,人们对身体健康的期望也高了,对药物的要求高了需要大了,尤其是在化学合成药物方面。[/size][size=16px] 我国在化药合成方面还有很大的提升空间,尤其是在研发(包括合成工艺)和生产工艺方面。我们传统的[/size][size=16px]合成[/size][size=16px]方式大多都是靠[/size][size=16px]反应釜[/size][size=16px]在一定的条件完成。反应釜合成有几大问题导致在有些合成项目中逐渐不被看好,第一,反应釜合成效率慢,有时合成[/size][size=16px]一釜[/size][size=16px]需要好几天时间;第二,反应釜合成反应[/size][size=16px]率[/size][size=16px]低,一般有效产出百分之七八十就算相当不错了,如果某些条件控制不当[/size][size=16px]甚至会零产出[/size][size=16px];第三,环保压力大,产出低废料多,增加后期处理费用甚至有污染环境的风险(实际都不同程度的造成了环境污染);第四,合成时危险性大,[/size][size=16px]有时发生泄漏或条件没控制好会发生危险;第五,所需要的空间大,一般小的反应釜需要半间房,大的可能需要几间房的空间[/size][size=16px],另外功耗也较大[/size][size=16px];第六,需要的人手多,在加料、取料及合成过程中的一些事项中一般都需要几个甚至更多人协同完成;第七,合成成本高,综上几项所述合成成本偏高。[/size][size=16px] 现在有一种先进的[/size][size=16px]药物[/size][size=16px]合成工艺在我国已经开始发展,那就是流动化学合成方法。[/size][size=16px]流动化学顾名思义就是边[/size][size=16px]流动边[/size][size=16px]合成,是用两台或多台泵[/size][size=16px]泵[/size][size=16px]合成所需要的化学试剂,经过一系列控制方式,比如压力控制、温度控制等,后在反应器里反应,最后出料,合成完成。目前常见的流动化学合成泵流速一般在零点几到几千毫升每分钟,流速相对较小,但时间长了合成的量也相当可观。它合成速度非常快,是反应釜的几十倍到几千上万倍;合成反应[/size][size=16px]率高,一般在[/size][size=16px]80[/size][size=16px]%[/size][size=16px]以上[/size][size=16px],[/size][size=16px] 95%[/size][size=16px]以上也比较常见[/size][size=16px];反应率高废料就少,后期处理相对容易,污染环境的可能性就小;瞬时流动合成的量较小,所以危险性也较小;设备体积小[/size][size=16px](最简单的配置只需要两台进料泵一台反应器)[/size][size=16px],功耗小[/size][size=16px](最小只需几十瓦[/size][size=16px])[/size][size=16px],需要的人手少;如果在系统中再加一台检测器还能时时监测合成情况;总体省时省力省成本。尤其对药物合成、化工合成、新材料合成等研发非常[/size][size=16px]方便适用[/size][size=16px],[/size][size=16px]在一个小实验室里可随时试验。时间快,最快几秒就可完成,结果还非常准确。[/size][size=16px] 流动化学合成工艺是一门新兴技术,在不久的将来肯定会迅猛的发展,为合成领域做贡献创利率。[/size]