出口食品平板菌落计数 中华人民共和国进出口商品检验行业标准 SN 0168-92代替 ZB X09 001-86 Plate count for bacterial colonies in food for export 1 主题内容与适用范围 本标准规定了出口食品平板菌落计数的方法。 本标准适用于各种出口食品及其原料,有专门规定检验方法的除外。2 设备和材料2.1 工作台:超净工作台或放于清洁、光线充足的实验室里的水平工作台。琼脂平板在工作台上暴露15 min,每平板不得超过15个菌落。2.2 恒温培养箱:36±1℃。2.3 恒温水浴箱:45±1℃。2.4 均质器。 2.5 振荡器。2.6 吸管:1、10和25mL,具0.1mL刻度。2.7 平皿:直径为90 mm。2.8 稀释瓶:广口瓶或三角烧瓶,容量为200 mL和500 mL。2.9 玻璃珠:直径为5mm左右。 2.10 天平:感量0.1g。3 培养基和试剂 3.1 平板计数琼脂。3.2 75%乙醇。3.3 稀释剂:磷酸盐缓冲稀释液。4 操作程序 4.1 样品制备 4.1.1 以无菌操作取有代表性的样品盛于灭菌容器内,如有包装,则用75%乙醇在包装开口处擦拭后取样。4.1.2 制备样品匀液4.1.2.1 固体或半固体食品:以无菌操作取25 g样品,放入装有225mL稀释剂的灭菌均质杯内,于8000r/min均质1~2min,制成1:10的样品匀液。如样品均质时间超过2min,应在均质杯外加冰水冷却。4.1.2.2 干燥或干粉食品:以无菌操作取25 g样品,放入装有225mL稀释剂和适量玻璃珠的500 mL稀释瓶中。迅速振摇,将样品混匀,制成1 : 10的样品匀液。振摇时,幅度为30cm,7s内振摇25次,也可用机械振荡器振荡15s代替手摇。4.1.2.3 液体食品: 用灭菌吸管吸取25mL样品, 放入装有225mL稀释剂的500mL稀释瓶中,按4.1.2.2条中所述方法迅速振摇,制成1:10的样品匀液。吸取样品时,吸管插入液面下不要超过2.5cm。吸管内液体要在2~4s内完全排入稀释剂中。不要在稀释剂中吹洗吸管。4.2 稀释样品匀液 4.2.1 用10 mL灭菌吸管准确吸取1:10的样品匀液10 mL,放入装有90 mL稀释剂的200mL, 稀释瓶中。按4.1.2.2条中所述的方法,迅速振摇。制成1:100的样品液。从容器中吸取样品匀液和以后的稀释操作中,吸管尖不要碰着瓶口。吸入的液体应先高于所要求的刻度,然后提起吸管使其尖端离开液面并贴在容器内壁将液体调至所要求的刻度。4.2.2 分别用10mL灭菌吸管按4.2.1条所述方法将样品匀液制成10倍递增稀释的样品液,如10**-3、10**-4、10**-5……。4.3 平板接种4.3.1 对于每一个样品,选用合适的三个连续稀释度的样品液进行平板计数。 4.3.2 分别用灭菌吸管吸取1mL样品液放入作了适宜标志的平皿内。每个稀释度的样品液用两个平皿。如果某一样品液在取出供试部分前的放置时间超过3 min,应按4.1.2.2条所述方法再振摇该样品液。4.3.3 分别加12~15mL平板计数琼脂(已放45+1℃的水浴中恒温)到各平皿内。立即将平皿内的样品液和琼脂培养基充分混合。混合方法是将平皿倾斜和旋转。要防止把混合物溅到平皿壁和盖上。同时将平板计数琼脂倾入加有1 mL稀释剂的另一灭菌平皿作空白对照。将样品液加入平皿后应立即倾注琼脂培养基,每个样品从开始稀释到倾注最后一个平皿所用的时间不得超过20min。4.4 培养 待琼脂凝固后将平皿翻转,立即放进36±1℃的恒温培养箱内培养48±2h。培养箱应 保持一定的湿度,经48h培养的琼脂培养基的失重不得超过15%。4.5 菌落计数和记录4.5.1 培养后,立即计数每个平板上的菌落数。25~250个菌落为合适范围。如果不能立即计数,应将平板存放于0~4℃,但不得超过24 h。 4.5.2 如只有一个稀释度的两个平板上的菌落在合适范围内, 先计算两个平板的平均值,再将平均值乘以相应稀释倍数,作为每克(毫升)样品中平板菌落数(下表,样品1)。4.5.3 如有两个稀释度在合适范围内,先计算每个稀释度两个平板的平均值,再计算两个稀释度的平均值,然后计算每克(毫升)样品中平板菌落数(下表,样品2)。4.5.4 当最低稀释度的两个平板上都少于25个菌落时,计数这一稀释度两个平板上的实际菌落数,计算两个平板上的平均菌落数,将平均菌落数乘以稀释倍数,得到估计的平板菌落数。给这个数注上星号(*), 表明该数系从菌落数在25~250这一范围之外的平板估计所得(下表,样品3)。4.5.5 当所有平板上的菌落都超过250时,则应将最高稀释度的两个平板的平均菌落数乘以稀释倍数,得到估计的平板菌落数。给这个数注上星号(*) (意义同4.5.4)(下表,样 品4)。4.5.6 如果所有稀释度的平板都没有菌落,则以小于1乘以最低稀释倍数报告平板菌落数。给这个数注上星号(*) (意义同4.5.4条) (下表,样品5)。4.5.7 同一稀释度的两个平板中,一个有25~250个菌落,另一个的菌落多于250个,两个平板都要计数。计算方法同4.5.2条(下表,样品6)。4.5.8 两个连续稀释度中的每个稀释度都有一个平板的菌落数在25~250个范围内,而另一个的菌落数高于250或低于25,四个平板都要计数。计算方法参照4.5.2条和4.5.3条(下表,样品7)。 4.5.9 某稀释度的两个平板都有25~250个菌落,而另一稀释度的两个平板中只有一个平板的菌落数在 25~250范围内。四个平板都要计数,计算方法参照4.5.2条和4.5.3条 (下表,样品8、9)。4.5.10 蔓延生长菌落 通常有三种不同类型的蔓延生长菌落。第一种类型是链状菌落,菌落之间没有明显界线,这些菌落是当琼脂和试验物混合时,一个细菌块被分散所致;第二种类型是在琼脂和 平皿底之间形成的水膜样菌落;第三种是在平皿边缘或琼脂表面形成的水膜样菌落。如果所选择的平板出现过量的蔓延菌落生长,以致a.被蔓延菌落盖住的地方,包括由于蔓延菌落造成的抑制生长区面积超过平板面积的50%,或b.由于蔓延菌落造成的抑制生长区面积超过平板面积的25%,这样的平板报告为“蔓延菌落”,不予计数。计数其他平板上的菌落数,将这些数值的算术平均值报告为平板菌落数(下表,样品10)。 当有必要计数除以上a.和b.外的蔓延生长菌落时,将三种不同类型的蔓延菌落分别计数。对于第一种类型,如果仅有一条链,将它作为一个菌落计。如果有来源不同的几条链, 将每条链作为一个菌落计,不要把链上生长的各个菌落分开来数。第二种和第三种类型的蔓延生长形成易于鉴别的菌落,即按一般菌落计数,把计数的蔓延生长菌落数同一般菌落数加在一起,计算平板菌落数。4.5.11 操作者对同一平板复核自己的计数结果,其差异应在5%之内,而其他人对这一平板重复计数,其差异应在10%之内。否则,应找出原因,加以校正。 4.6 计算和记录数字 适宜稀释度的两个平板的菌落数平均值或两个稀释度的平板菌落数平均值乘以相应稀释倍数计算出每克(毫升)样品中平板菌落数。 记录时,只有在换算到每克(毫升)样品中平板菌落数时,才能定下两位有效数字,第三位数字采用四舍五入的方法记录。也可将样品的平板菌落数记录为10的指数形式(见下表中的例子)。5 结果报告 报告每克(毫升)样品中平板菌落数或估计的平板菌落数。 平板菌落数计算 样品号 菌 落 数 平板菌落数/g(mL) 1:100 1:1000 1:10000 1 多不可计 175 16 多不可计 208 17 190000(1.9×10**5) 2 多不可计 224 25 多不可计 245 30 250000(2.5×10**5)* 3 18 2 014 0 0 1600(1.6×10**3)* 4 多不可计 多不可计 523多不可计 多不可计 487 5100000(5.1×10**6)* 5 0 0 00 0 0 <100 (<1.0×10**2)* 6 多不可计 245 23 多不可计 278 20 260000(2.6×10**5) 7 多不可计 225 21多不可计 255 40 270000(2.7×10**5) 8 多不可计 210 18多不可计 240 28 230000(2.3×10**5) 9 多不可计 260 30 多不可计 230 28 270000(2.7×10**5) 10 多不可计 245 35多不可计 230 蔓延菌落 290000(2.9×10**5) 注:带星号*者为估计数。附 录 A 培养基制备 (补充件) A1 平板计数琼脂 胰蛋白胨 5.0g 酵母浸膏 2.5g 葡萄糖 1.0g 琼 脂 15.0g 蒸馏水 1000mL 将各成分加于蒸馏水中,煮沸溶解。分装试管或烧瓶,121℃高压灭菌15min。最终pH7.0±0.1。A2 磷酸盐缓冲稀释液 贮存液: 磷酸二氢钾(KH2PO4) 34.0g 蒸馏水 500mL 用大约175 mL的1mol/L氢氧化钠溶液调节pH至7.2,用蒸馏水稀释至1000 mL后贮存于冰箱。 稀释液:用蒸馏水稀释1.25mL贮存液至1000mL,分装于合适容器,121℃高压灭菌15min。附加说明: 本标准由中华人民共和国国家进出口商品检验局提出。 本标准由中华人民共和国河南进出口商品检验局、湖南进出口商品检验局负责起草 本标准主要起草人李志培、邓明义。 本标准主要参考美国食品和药物管理局(FDA)《细菌学分析手册》第6版第4章(1984年)。 中华人民共和国国家进出口商品检验局1992-12-28批准 1993-05-01实施
出口食品平板菌落计数 中华人民共和国进出口商品检验行业标准 SN 0168-92代替 ZB X09 001-86 Plate count for bacterial colonies in food for export 1 主题内容与适用范围 本标准规定了出口食品平板菌落计数的方法。 本标准适用于各种出口食品及其原料,有专门规定检验方法的除外。2 设备和材料2.1 工作台:超净工作台或放于清洁、光线充足的实验室里的水平工作台。琼脂平板在工作台上暴露15 min,每平板不得超过15个菌落。2.2 恒温培养箱:36±1℃。2.3 恒温水浴箱:45±1℃。2.4 均质器。 2.5 振荡器。2.6 吸管:1、10和25mL,具0.1mL刻度。2.7 平皿:直径为90 mm。2.8 稀释瓶:广口瓶或三角烧瓶,容量为200 mL和500 mL。2.9 玻璃珠:直径为5mm左右。 2.10 天平:感量0.1g。3 培养基和试剂 3.1 平板计数琼脂。3.2 75%乙醇。3.3 稀释剂:磷酸盐缓冲稀释液。4 操作程序 4.1 样品制备 4.1.1 以无菌操作取有代表性的样品盛于灭菌容器内,如有包装,则用75%乙醇在包装开口处擦拭后取样。4.1.2 制备样品匀液4.1.2.1 固体或半固体食品:以无菌操作取25 g样品,放入装有225mL稀释剂的灭菌均质杯内,于8000r/min均质1~2min,制成1:10的样品匀液。如样品均质时间超过2min,应在均质杯外加冰水冷却。4.1.2.2 干燥或干粉食品:以无菌操作取25 g样品,放入装有225mL稀释剂和适量玻璃珠的500 mL稀释瓶中。迅速振摇,将样品混匀,制成1 : 10的样品匀液。振摇时,幅度为30cm,7s内振摇25次,也可用机械振荡器振荡15s代替手摇。4.1.2.3 液体食品: 用灭菌吸管吸取25mL样品, 放入装有225mL稀释剂的500mL稀释瓶中,按4.1.2.2条中所述方法迅速振摇,制成1:10的样品匀液。吸取样品时,吸管插入液面下不要超过2.5cm。吸管内液体要在2~4s内完全排入稀释剂中。不要在稀释剂中吹洗吸管。4.2 稀释样品匀液 4.2.1 用10 mL灭菌吸管准确吸取1:10的样品匀液10 mL,放入装有90 mL稀释剂的200mL, 稀释瓶中。按4.1.2.2条中所述的方法,迅速振摇。制成1:100的样品液。从容器中吸取样品匀液和以后的稀释操作中,吸管尖不要碰着瓶口。吸入的液体应先高于所要求的刻度,然后提起吸管使其尖端离开液面并贴在容器内壁将液体调至所要求的刻度。4.2.2 分别用10mL灭菌吸管按4.2.1条所述方法将样品匀液制成10倍递增稀释的样品液,如10**-3、10**-4、10**-5……。4.3 平板接种4.3.1 对于每一个样品,选用合适的三个连续稀释度的样品液进行平板计数。 4.3.2 分别用灭菌吸管吸取1mL样品液放入作了适宜标志的平皿内。每个稀释度的样品液用两个平皿。如果某一样品液在取出供试部分前的放置时间超过3 min,应按4.1.2.2条所述方法再振摇该样品液。4.3.3 分别加12~15mL平板计数琼脂(已放45+1℃的水浴中恒温)到各平皿内。立即将平皿内的样品液和琼脂培养基充分混合。混合方法是将平皿倾斜和旋转。要防止把混合物溅到平皿壁和盖上。同时将平板计数琼脂倾入加有1 mL稀释剂的另一灭菌平皿作空白对照。将样品液加入平皿后应立即倾注琼脂培养基,每个样品从开始稀释到倾注最后一个平皿所用的时间不得超过20min。4.4 培养 待琼脂凝固后将平皿翻转,立即放进36±1℃的恒温培养箱内培养48±2h。培养箱应 保持一定的湿度,经48h培养的琼脂培养基的失重不得超过15%。4.5 菌落计数和记录4.5.1 培养后,立即计数每个平板上的菌落数。25~250个菌落为合适范围。如果不能立即计数,应将平板存放于0~4℃,但不得超过24 h。 4.5.2 如只有一个稀释度的两个平板上的菌落在合适范围内, 先计算两个平板的平均值,再将平均值乘以相应稀释倍数,作为每克(毫升)样品中平板菌落数(下表,样品1)。4.5.3 如有两个稀释度在合适范围内,先计算每个稀释度两个平板的平均值,再计算两个稀释度的平均值,然后计算每克(毫升)样品中平板菌落数(下表,样品2)。4.5.4 当最低稀释度的两个平板上都少于25个菌落时,计数这一稀释度两个平板上的实际菌落数,计算两个平板上的平均菌落数,将平均菌落数乘以稀释倍数,得到估计的平板菌落数。给这个数注上星号(*), 表明该数系从菌落数在25~250这一范围之外的平板估计所得(下表,样品3)。4.5.5 当所有平板上的菌落都超过250时,则应将最高稀释度的两个平板的平均菌落数乘以稀释倍数,得到估计的平板菌落数。给这个数注上星号(*) (意义同4.5.4)(下表,样 品4)。4.5.6 如果所有稀释度的平板都没有菌落,则以小于1乘以最低稀释倍数报告平板菌落数。给这个数注上星号(*) (意义同4.5.4条) (下表,样品5)。4.5.7 同一稀释度的两个平板中,一个有25~250个菌落,另一个的菌落多于250个,两个平板都要计数。计算方法同4.5.2条(下表,样品6)。4.5.8 两个连续稀释度中的每个稀释度都有一个平板的菌落数在25~250个范围内,而另一个的菌落数高于250或低于25,四个平板都要计数。计算方法参照4.5.2条和4.5.3条(下表,样品7)。 4.5.9 某稀释度的两个平板都有25~250个菌落,而另一稀释度的两个平板中只有一个平板的菌落数在 25~250范围内。四个平板都要计数,计算方法参照4.5.2条和4.5.3条 (下表,样品8、9)。4.5.10 蔓延生长菌落 通常有三种不同类型的蔓延生长菌落。第一种类型是链状菌落,菌落之间没有明显界线,这些菌落是当琼脂和试验物混合时,一个细菌块被分散所致;第二种类型是在琼脂和 平皿底之间形成的水膜样菌落;第三种是在平皿边缘或琼脂表面形成的水膜样菌落。如果所选择的平板出现过量的蔓延菌落生长,以致a.被蔓延菌落盖住的地方,包括由于蔓延菌落造成的抑制生长区面积超过平板面积的50%,或b.由于蔓延菌落造成的抑制生长区面积超过平板面积的25%,这样的平板报告为“蔓延菌落”,不予计数。计数其他平板上的菌落数,将这些数值的算术平均值报告为平板菌落数(下表,样品10)。 当有必要计数除以上a.和b.外的蔓延生长菌落时,将三种不同类型的蔓延菌落分别计数。对于第一种类型,如果仅有一条链,将它作为一个菌落计。如果有来源不同的几条链, 将每条链作为一个菌落计,不要把链上生长的各个菌落分开来数。第二种和第三种类型的蔓延生长形成易于鉴别的菌落,即按一般菌落计数,把计数的蔓延生长菌落数同一般菌落数加在一起,计算平板菌落数。4.5.11 操作者对同一平板复核自己的计数结果,其差异应在5%之内,而其他人对这一平板重复计数,其差异应在10%之内。否则,应找出原因,加以校正。 4.6 计算和记录数字 适宜稀释度的两个平板的菌落数平均值或两个稀释度的平板菌落数平均值乘以相应稀释倍数计算出每克(毫升)样品中平板菌落数。 记录时,只有在换算到每克(毫升)样品中平板菌落数时,才能定下两位有效数字,第三位数字采用四舍五入的方法记录。也可将样品的平板菌落数记录为10的指数形式(见下表中的例子)。5 结果报告 报告每克(毫升)样品中平板菌落数或估计的平板菌落数。 平板菌落数计算 样品号 菌 落 数 平板菌落数/g(mL) 1:100 1:1000 1:10000 1 多不可计 175 16 多不可计 208 17 190000(1.9×10**5) 2 多不可计 224 25 多不可计 245 30 250000(2.5×10**5)* 3 18 2 014 0 0 1600(1.6×10**3)* 4 多不可计 多不可计 523多不可计 多不可计 487 5100000(5.1×10**6)* 5 0 0 00 0 0 <100 (<1.0×10**2)* 6 多不可计 245 23 多不可计 278 20 260000(2.6×10**5) 7 多不可计 225 21多不可计 255 40 270000(2.7×10**5) 8 多不可计 210 18多不可计 240 28 230000(2.3×10**5) 9 多不可计 260 30 多不可计 230 28 270000(2.7×10**5) 10 多不可计 245 35多不可计 230 蔓延菌落 290000(2.9×10**5) 注:带星号*者为估计数。附 录 A 培养基制备 (补充件) A1 平板计数琼脂 胰蛋白胨 5.0g 酵母浸膏 2.5g 葡萄糖 1.0g 琼 脂 15.0g 蒸馏水 1000mL 将各成分加于蒸馏水中,煮沸溶解。分装试管或烧瓶,121℃高压灭菌15min。最终pH7.0±0.1。A2 磷酸盐缓冲稀释液 贮存液: 磷酸二氢钾(KH2PO4) 34.0g 蒸馏水 500mL 用大约175 mL的1mol/L氢氧化钠溶液调节pH至7.2,用蒸馏水稀释至1000 mL后贮存于冰箱。 稀释液:用蒸馏水稀释1.25mL贮存液至1000mL,分装于合适容器,121℃高压灭菌15min。附加说明: 本标准由中华人民共和国国家进出口商品检验局提出。 本标准由中华人民共和国河南进出口商品检验局、湖南进出口商品检验局负责起草 本标准主要起草人李志培、邓明义。 本标准主要参考美国食品和药物管理局(FDA)《细菌学分析手册》第6版第4章(1984年)。 中华人民共和国国家进出口商品检验局1992-12-28批准 1993-05-01实施
如题,采用平板计数琼脂 菌落总数中到底包不包括酵母菌与霉菌?谢谢
[font=system-ui, -apple-system, &][size=16px][color=#333333](1)菌落长在一起有三种情况:[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]①平板上存在杂菌,杂菌污染造成菌落集中在一起;[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]②配制培养基时没有将样品混匀,使营养物质分布不均匀,导致菌落长在一块;[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]③稀释涂布平板法:在稀释涂布时,未能均匀涂布;平板划线法:划线太重,接种针的原菌种未能分散开来。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333](2)菌落和菌苔有什么区别?[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]①菌落:是由单个细菌细胞或一堆同种细胞在适宜固体培养基表面或内部生长繁殖到一定程度,形成肉眼可见的子细胞群落。菌落形态包括菌落的大小、形状、边缘、光泽、质地、颜色和透明程度等。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]②菌苔:是细菌在固体培养基接种线上由母细胞繁殖长成的一片密集的、具有一定形态结构特征的细菌群落,一般为大批菌落聚集而成。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]③菌落与菌台的区别:[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]菌落:圆形边缘整齐,表面光滑,半透明,小凸起;在伊红美蓝琼脂平板上:深紫黑色、光滑、湿润、带有金属光泽的圆形菌落。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]菌苔:边缘光滑整齐;表面较透明;显出鲜艳的颜色;显得湿润,易被接种环挑起。[/color][/size][/font]
一、实验原理稀释平板测数是根据微生物在高度稀释条件下固体培养基上所形成的单个菌落是由一个单细胞繁殖而成这一培养特征设计的计数方法,即一个菌落代表一个单细胞。计数时,首先将待测样品制成均匀的繁殖稀释液,尽量使样品中的微生物细胞分散开,使其成单个细胞存在,否则一个菌落就不只是代表一个细胞,再取一定稀释度、一定量的稀释液接种到平板中,使其均匀分布于平板中的培养基内。经培养后,由单个细胞生长繁殖形成菌落,统计菌落数目,即可计算出样品中的含菌数。此记数方法所计算的菌数是培养基上长出来的菌落数,故又称活菌计数。一般用于某些产品检定,如根瘤菌剂等产品检定,生物制品检验,土壤含菌量测定及食品、水源的污染程度的检验。自然条件下,微生物常以群落状态存在,这种群落往往是不同种类微生物的混合体。为了研究某种微生物的特性或者要大量培养和使用某种微生物,必须从这些混杂的微生物群落中获得纯培养,这种获得纯培养的方法称为微生物的分离与纯化。在自然界中,土壤是微生物生活的良好环境,其中生活的微生物数量和种类都是极其丰富的,因此土壤是人类开发利用微生物资源的重要基地。土壤中的微生物数量、种类与土壤肥力有关,肥沃的土壤中多,贫瘠土壤中少。其生理类群则与土壤的其它理化性质,如通气、pH有关,例如在通气良好的菜园土中,好气性微生物占有绝对优势。本实验以菜园土为材料分离土壤中的好气性细菌,并进行数量测定。分离微生物时,一般是根据该微生物对营养、pH、氧气等要求的不同,供给它们适宜的生活条件,或加入某种抑制剂造成只利于该菌种生长,不利于其它菌种生长的环境,从而淘汰不需要的菌种。分离微生物常用的方法有稀释平板分离法和划线分离法,根据不同的材料,可以采用不同方法,其最终目的是要在培养基上出现欲分离微生物的单个菌落,必要时再对单个菌落进一步分离纯化。在用稀释平板分离微生物时,还可以同时测定待分离的微生物的数量。放线菌与细菌同属原核微生物,是重要的抗生素产生菌,在土壤中的数量仅次于细菌,尤其是在有机质丰富、透气性好的中性到微碱性土壤中的数量较多。本实验采用高氏一号琼脂培养基分离和计数菜园土中的放线菌。真菌在土壤中的数量次于细菌和放线菌,主要在有机质丰富、透气性好的偏酸性土壤中较多。分离土壤中的真菌并不难,但由于其菌落大,容易扩展,计数准确性较低。本实验采用加有氯霉素或庆大霉素和孟加拉红的马丁氏培养基分离及计数菜园土中的真菌。按一般资料介绍为链霉素,但此种抗生素要先配成一定浓度的溶液,且应于倒平板前才加入培养基中。在此培养基上,放线菌和细菌被氯霉素或庆大霉素和孟加拉红所抑制,但大多数真菌能够生存,且其菌落受孟加拉红的抑制而较小,从而避免了某些真菌的扩散蔓延而带来的数量上的误差。
[size=4][font=黑体]我们都知道:菌落总数是指在被检样品的单位重量(g)、容积(m1)或表面积(clni)内,所含能于某种固体培养基上,在一定条件下培养后所生成的细菌集落的总数。但在水质与食品检验中当细菌培养在平板无菌落生长时,为什么菌落总数报告方式不同?水质:若所有稀释度的平板上均无菌落生长,则以(未检出)报告之。食品:若所有稀释度均无菌落生长,则以小于l(1)乘以最低稀释倍数(l×10或lO)报告之。请各位朋友发表自己的看法或见解![/font][/size]
SN 0168-92 出口食品平板菌落计数[URL=http://blog.xunlei.com/web/category.html?uin=arlen888&category_id=1475]http://blog.xunlei.com/web/category.html?uin=arlen888&category_id=1475[/URL]
一、菌落总数介绍: 菌落是指细菌在固体培养基上生长繁殖而形成的能被肉眼识别的生长物,它是由数以万计相同的细菌集合而成。当样品被稀释到一定程度,与培养基混合,在一定培养条件下,每个能够生长繁殖的细菌细胞都可以在平板上形成一个可见的菌落。 菌落总数就是指在一定条件下(如需氧情况、营养条件、pH、培养温度和时间等)每克(每毫升)检样所生长出来的细菌菌落总数。按国家标准方法规定,即在需氧情况下,37℃培养48h,能在普通营养琼脂平板上生长的细菌菌落总数,所以厌氧或微需氧菌、有特殊营养要求的以及非嗜中温的细菌,由于现有条件不能满足其生理需求,故难以繁殖生长。因此菌落总数并不表示实际中的所有细菌总数,菌落总数并不能区分其中细菌的种类,所以有时被称为杂菌数,需氧菌数等。 菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。菌落总数的多少在一定程度上标志着食品卫生质量的优劣。二、检验方法 菌落总数的测定,一般将被检样品制成几个不同的10倍递增稀释液,然后从每个稀释液中分别取出1mL置于灭菌平皿中与营养琼脂培养基混合,在一定温度下,培养一定时间后(一般为48小时),记录每个平皿中形成的菌落数量,依据稀释倍数,计算出每克(或每ml)原始样品中所含细菌菌落总数。 基本操作一般包括:样品的稀释--倾注平皿--培养48小时--计数报告。 国内外菌落总数测定方法基本一致,从检样处理、稀释、倾注平皿到计数报告无何明显不同,只是在某些具体要求方面稍有差别,如有的国家在样品稀释和倾注培养进,对吸管内液体的流速,稀释液的振荡幅度、时间和次数以及放置时间等均作了比较具体的规定。 检验方法参见: GB4789.2-94 《中华人民共和国国家标准 食品卫生微生物学检验 菌落总数测定》 SN0168-92 《中华人民共和国进出口商品检验行业标准 出口食品菌落计数》三、说明(一)样品的处理和稀释: 1.操作方法:以无菌操作取检样25g(或25ml),放于225mL灭菌生理盐水或其他稀释液的灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠)或灭菌乳钵内,经充分振要或研磨制成1:10的均匀稀释液。 固体检样在加入稀释液后,最好置灭菌均质器中以8000~10000r/min的速度处理1min,制成1:10的均匀稀释液。 用1ml灭菌吸管吸取1:10稀释液1ml,沿管壁徐徐注入含有9ml灭菌生理盐水或其他稀释液的试管内,振摇试管混合均匀,制成1:100的稀释液。 另取1ml灭菌吸管,按上项操作顺序,制10倍递增稀释液,如此每递增稀释一次即换用1支1ml灭菌吸管。 2.无菌操作:操作中必须有“无菌操作”的概念,所用玻璃器皿必须是完全灭菌的,不得残留有细菌或抑菌物质。所用剪刀、镊子等器具也必须进行消毒处理。样品如果有包装,应用75%乙醇在包装开口处擦拭后取样。 操作应当在超净工作台或经过消毒处理的无菌室进行。琼脂平板在工作台暴露15分钟,每个平板不得超过15个菌落。 3.采样的代表性:如系固体样品,取样时不应集中一点,宜多采几个部位。固体样品必须经过均质或研磨,液体样品须经过振摇,以获得均匀稀释液。 4.样品稀释误差:为减少样品稀释误差,在连续递次稀释时,每一稀释液应充分振摇,使其均匀,同时每一稀释度应更换一支吸管。 在进行连续稀释时,应将吸管内液体沿管壁流入,勿使吸管尖端伸入稀释液内,以免吸管外部粘附的检液溶于其内。 为减少稀释误差,SN标准采用取10mL稀释液,注入90mL缓冲液中。 5.稀释液:样品稀释液主要是灭菌生理盐水,有的采用磷酸盐缓冲液(或0.1%蛋白胨水),后者对食品已受损伤的细菌细胞有一定的保护作用。如对含盐量较高的食品(如酱油)进行稀释,可以采用灭菌蒸馏水。(二)倾注培养 1.操作方法:根据标准要求或对污染情况的估计,选择2~3个适宜稀释度,分别在制10倍递增稀释的同时,以吸取该稀释度的吸管移取1ml稀释液于灭菌平皿中,每个稀释度做两个平皿。 将凉至46℃营养琼脂培养基注入平皿约15ml,并转动平皿,混合均匀。同时将营养琼脂培养基倾入加有1ml稀释液(不含样品)的灭菌平皿内作空白对照。 待琼脂凝固后,翻转平板,置36±1℃温箱内培养48±2h,取出计算平板内菌落数目,乘以稀释倍数,即得每克(每毫升)样品所含菌落总数。 2.倾注用培养基应在46℃水浴内保温,温度过高会影响细菌生长,过低琼脂易于凝因而不能与菌液充分混匀。如无水浴,应以皮肤感受较热而不烫为宜。 倾注培养基的量规定不一,从12~20ml不等,一般以15ml较为适宜,平板过厚可影响观察,太薄又易于干裂。倾注时,培基底部如有沉淀物,应将底部弃去,以免与菌落混淆而影响计数观察。 3.为使菌落能在平板上均匀分布,检液加入平皿后,应尽快倾注培养基并旋转混匀,可正反两个方向旋转,检样从开始稀释到倾注最后一个平皿所用时间不宜超过[
一固体样品作菌落总数测定,其中10-1平板菌落数多不可计,10-2平板菌落数为271,10-3平板菌落数为60,则该样品菌落总数( )个/g。 A、27000 B、27100 C、60000 D、43550
1.菌落总数的测定:是以检样中的细菌细胞和营养琼脂混合后,每个细菌细胞都能形成一个可见的单独菌落的假定为基础的。由于检验中采用37℃于有氧条件下培养(空气中含氧约20%),因而并不能测出每g或mL检样中实际的总活菌数,厌氧菌、微嗜氧菌和冷营菌在此条件下不生长,有特殊营养要求的一些细菌也受到了限制,因此所得结果,只包括一群能在普通营养琼脂中发育、嗜中温的、需氧和兼性厌氧的细菌菌落的总数。2.鉴于食品检样中的细菌细胞是以单个,成双、链状、葡萄状或成堆的形式存在,因而在营养琼脂平板上出现的菌落可以来源于细胞块,也可以来源于单个细胞,因此平板上所得需氧和兼性厌氧菌菌落的数字不应报告活菌数,而应以单位重量、容量或表面积内的菌落数或菌落形成单位数(colony forming units,CFU)报告之。3.每种细菌都有它一定的生理特性,培养时,应用不同的营养条件及其他生理条件(如温度、培养时间、pH、需氧性质等)去满足其要求,才能分别将各种细菌都培养出来。因此,要得到较全面的细菌菌落总数,应将检样接种到几种不同的非选择性培养基上,并培养在不同条件下,如温度,氧气供应等。但国家颁发的食品卫生标准对不同食品的菌落总数的规定,都是根据用普通营养琼脂进行需氧培养所得的结果确定的,因此在食品的一般卫生学评价中并不要用几种不同的非选择性培养基培养。
在营养琼脂平板上如何区分细菌,放线菌,酵母菌和霉菌的菌落?
各位大侠,有谁知道“菌落计数”的标准呀!我这里有国内的几种标准,有需要的和我联系!如果有国外标准的兄弟姐妹,也能否拿出来与大家共赏!
本课内容:菌落总数测定的一些要点根据食品卫生标准要求和对样品污染情况的估计,选择2~3个稀释度。加入样品时要注意外来的污染。培养基倾注的温度与厚度是实验正确与否的关键。(倾注的温度:一般35~45℃,温度过高会造成已受损伤的菌细胞死亡。厚度:直径9cm的平皿一般要求15~20mL培养基,若培养基太薄,在培养过程中可能因水分蒸发而影响细菌的生长)。为防止细菌增殖及产生片状菌落,在加入样液后,应在15min内倾注培养基。检样与培养基混匀时,可先向一个方向旋转,然后再向相反方向旋转。旋转中应防止混合物溅到皿边的上方。l培养基凝固后,应在尽快将平皿翻转培养,保持琼脂表面干燥,尽量避免菌落蔓延生长,影响计数。l为控制污染,在实验过程中,应在工作台上打开一块琼脂平板,其暴露时间应与检样从制备、稀释到加入平皿时所暴露的最长时间相当,然后与检样一同培养,以了解检样在操作过程中有无受到来自外界的污染。培养温度:每种不同样品中的细菌都有一定的生理特性,培养时应用不同的营养条件及生理条件可能得出不同的结果,因而应根据检测标准的要求选择适当的培养温度和培养时间。l食品:36±1℃,48±2h 。l饮用水:36±1℃,48h 。l水产品:30±1℃,72±3h。(36℃培养和30℃培养结果差别较大,同样水产品48h结果和72h也有差别。对照试验:l检样的稀释液中往往带有食品颗粒,在这种情况下,为避免与细菌菌落混淆,可作一检样对照,不经培养,置4℃环境放置,在计数时用于对照。l或可选用TTC营养琼脂作培养基。菌落计数:l如果高稀释度平板上的菌落数比低稀释度平板上的菌落数高,则说明检验过程中可能出现差错或样品中含抑菌物质,这样的结果不可用于结果报告。l如果平板上出现链状菌落,菌落间没有明显的界限,这可能是琼脂与检样混匀时,一个细菌块被分散所造成的。一条链作为一个菌落计。若培养过程中遭遇昆虫侵入,在昆虫爬行过的地方也会出现链状菌落,也不应分开计数。l如果平板上菌落太多,不能计数时,不能用多不可计作报告。应在最高稀释度平板上任意选取2个1cm2的面积,计算菌落数,除2求出每cm2面积内平均菌落数,乘以63.6(皿底面积cm2数)。l如果检样是微生物类制剂(酸牛奶、酵母制酸性饮料等),在进行菌落计数时应将有关微生物(乳酸菌、酵母菌)排除,不可并入检样的菌落总数内作报告。每个样品从开始稀释到倾注最后一个平板的时间不得超过15min,目的是为了使菌落能在平板上均匀分布,否则,时间放长了,样液可能由于干燥而贴在平板上,倾注琼脂后不易摇开,容易产生片状菌落,影响菌落计数。另外,琼脂凝固后不要在室温长时间放置,应及时将平皿倒置培养,可避免菌落的蔓延生长。检验过程中应用稀释液做空白对照,用以判定稀释液、培养基、平皿或吸管可能存在的污染。同时,检验过程中应在工作台上打开一块空白的平板计数琼脂,其暴露时间应与检验时间相当,以了解检样在检验过程中有无受到来自空气的污染。检样稀释液有时带有食品颗粒,为避免与细菌发生混淆,可以作一检样稀释液与平板计数琼脂混合的平皿,不经培养,于4℃冰箱放置,以便在计数时用作对照。另外也可以在已熔化而保温在45℃水浴内的平板计数琼脂中,按100ml加1ml0.5%氯化三苯四氮唑(TTC)水溶液,培养后食品颗粒不变色,细菌为红色。
[align=center][font=宋体]菌落总数的检验讨论[/font][/align][align=center][font=宋体] [/font][/align][font=宋体][font=宋体]概念理解[/font] [/font][font=宋体]1、菌落总数英译实为需氧菌平板计数,并不表示实际样品中的所有细菌总数。由于倾注平板法的局限,会有一部分细菌在该实验条件下不生长,故计数结果要比实际值低。 [/font][font=宋体]2、菌落总数并不能区分其中细菌的种类。实际上是把检样中的致病菌、非致病菌、酵母 菌、霉菌都计算在内的微生物杂菌总数。 [/font][font=宋体]3、菌落总数的卫生学意义:用于判定样品受污染的程度、微生物生长存活动态,对样品进行综合卫生评价。反映食品被细菌污染的程度 预测食品耐放程度和时间 估测食品腐败 状况。[/font][font=宋体]菌落:[/font][i][font=宋体]Colony[/font][/i][font=宋体][font=宋体],单个微生物在适固体培养基表面或内部生长繁殖到一定程度;形成肉眼可见有一定细菌群落。[/font] [font=宋体]CFU: [/font][/font][i][font=宋体]Colony Forming Units[/font][/i][font=宋体][font=宋体],菌落形成单位[/font] [/font][font=宋体][font=宋体]鉴于食品的细菌细胞是以单个、成双、链状、葡萄状或成堆的形式存在,因而在平板上出现的菌落可以来源于细胞块,也可以来源于单个细胞,因而平板上所得菌落的数字不应报告活菌数,而应以单位重量、容积或表面积内的菌落数或菌落形成单位([/font][font=宋体]colony forming units,CFU)报告。 [/font][/font][font=宋体] [/font][font=宋体]4.检验步骤直接上图[/font][img=,690,443]https://ng1.17img.cn/bbsfiles/images/2023/08/202308011004578351_4999_6113937_3.png!w690x443.jpg[/img][font=宋体] [/font][font=宋体]5.培养温度: [/font][font=宋体]? 一般食品:36℃±1℃,培养48h ±2h [/font][font=宋体]? 水产品: 30℃±1℃,培养72h ±3h[/font][font=宋体][font=宋体]注意呀:未加工水产品受到海洋和陆地细菌的污染,[/font] [font=宋体]水产品的培养温度,由于其生活环境水温较低,检验时应采用[/font][font=宋体]30℃±1℃。水产品定义见GB 2760或GB2762 [/font][/font][font=宋体]此处并非指水产制品[/font][font=宋体] [/font][font=宋体]6.[/font][font=宋体]操作注意事项:[/font][font=宋体][font=宋体]每个样品从开始稀释到倾注平皿所用的时间不得超过[/font][font=宋体]15min,主要为 [/font][/font][font=宋体][font=宋体]防止细菌增殖和产生片状菌落。(因肠杆菌科繁殖一代所需的时间为[/font] [/font][font=宋体]20min,故选择在15min内) [/font][font=宋体]? 样液与琼脂应充分混合,避免将混合物溅到平皿壁和皿盖上。平皿内 [/font][font=宋体][font=宋体]琼脂凝固后,不要长时间放置,然后倒置培养,可避免菌落蔓延生长。[/font] [/font][font=宋体]? 检样过程中应用稀释剂做空白对照,用以判定稀释液、培养基、平皿或吸管可能存在的污染。应为吸取1mL空白稀释液加入到两个无菌平皿内,可表示为空白对照平皿结果0/0。[/font][font=宋体][color=#000090] [/color][/font][font=宋体][font=宋体]选取菌落数在[/font][font=宋体]30~300CFU之间,无蔓延生长的平板计数 [/font][/font][font=宋体][font=宋体]低于[/font][font=宋体]30的记录具体菌落数,大于300的 可记录为多不可计,每个稀释度采用两个平行的均数。 [/font][/font][font=宋体][font=宋体]有较大片状菌落生长者不宜采用,若片状小于平板一半时且余部均匀分布,则以半个平板菌落数[/font][font=宋体]2倍报告 [/font][/font][font=宋体][font=宋体]无明显界限链状菌落每条单链视为一个菌落[/font] [font=宋体](可采用覆盖方式减少菌落蔓延,如对水产、蜂蜜样品时)[/font][/font][font=宋体] [/font]
做菌落总数测定的时候,所有培养基都多覆盖了一层培养基,空白组没长菌,12个平板但是大部分接种的培养基菌落表面还是长了菌,很多几乎是全部覆盖了,但是也有2个表面没长弥漫性菌落的 是怎么回事

说说这个菌落http://ng1.17img.cn/bbsfiles/images/2014/06/201406271647_503368_2433088_3.jpg
猜猜这是什么菌? 巧克力平板http://ng1.17img.cn/bbsfiles/images/2014/06/201406271648_503369_2433088_3.jpg
想请问大家,在做产品菌落总数检验时有没有遇到过高稀释度平板上的菌落数反而比低稀释度平板上的菌落数多的情况?如果遇到这种情况,大家是怎么报告结果的?
一般我们做液体样品的菌落总数检测,菌落在平板上都很细小,有时一眼看上去根本没有,非常仔细看才能看到很小的小点点在培养够48h的情况下,这样的算不算到有效菌落的统计里?如果要计数的话,很难判断是菌落还是别的什么,而且即使用菌落计数器数也很伤眼睛如果不计数的话,多培养几天后有些菌落会长大一点点,感觉的确是菌落那这些细小的点点算不算到菌落总数里呢
一、填空(1)菌落总数是指水样在营养琼脂上有氧条件下37℃培养(48)小时后,所得(1)mL水样所含菌落的总数。(2)若所有稀释度的平板上均无菌落生长,则以(未检出)报告之。第二题,大家是报告0还是未检出?
[font=SimSun, STSong, &]请问一下,做商业无菌中的染色镜检可以看到个别菌落,但做菌落总数后平板并不长菌,这是为啥[/font]
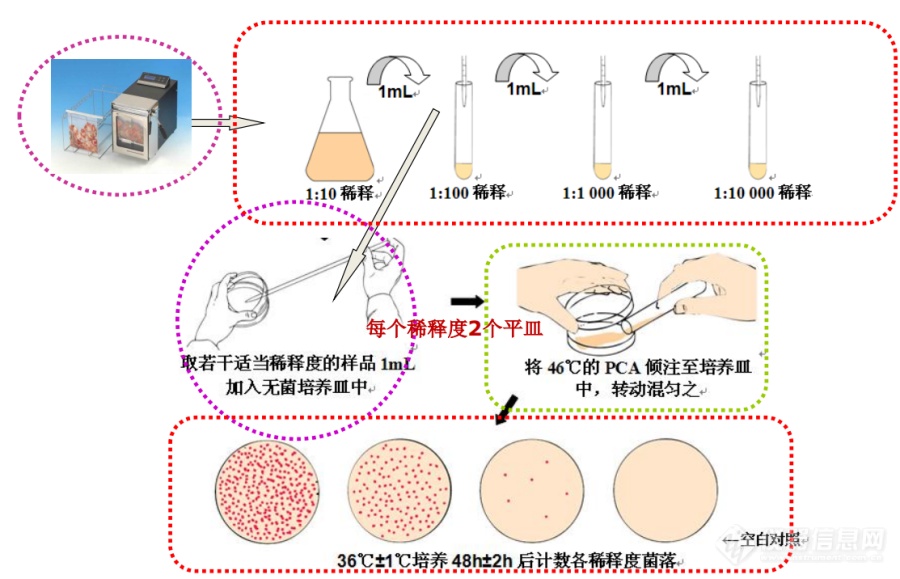
[b]菌落计数的计数和培养步骤[/b] [align=center] [/align][b][font=宋体][size=16px][color=#535053]样品的稀释[/color][/size][/font][font=宋体][size=16px][color=#535053][/color][/size][/font] [font=宋体][size=16px][color=#535053]固体和半固体样品[/color][/size][/font][/b] [font=宋体][size=16px]称取25 g置盛有225 mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min均质1min~2 min,或放入盛有225 mL稀释液的无菌均质袋中,用[color=var(--weui-LINK)]拍击式均质器[i][/i][/color]拍打1min~2 min,制成1:10的样品匀液。[/size][/font] [align=center][b][font=宋体][size=16px][color=#535053]液体样品[/color][/size][/font][/b][/align] [font=宋体][size=16px]以[/size][/font][font=宋体][size=16px]无菌吸管[i][/i][/size][/font][font=宋体][size=16px]吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。[/size][/font] [img=图片]https://mmbiz.qpic.cn/mmbiz_jpg/fKutukicS8AY5sOWJb7yIaHibr1icWrdc7T0zUghd7XcjY8WtDUAqo0jItIA55dbqMiccNRa9L1ibwcMiaFnO3AIr57g/640?wx_fmt=other&wxfrom=5&wx_lazy=1&wx_co=1&tp=wxpic[/img] [font=宋体][size=16px]上步完成后,用1mL无菌吸管或微量[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。[/size][/font] [font=宋体][size=16px]移液过程使用的器具,都应避免微生物污染。使用耐高压[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url],核查洗耳球无菌程度,避免[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]触及[color=var(--weui-LINK)]均质袋[i][/i][/color]或试管内壁……[/size][/font] [font=宋体][size=16px]样品匀液完成后,可按相同操作,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管或吸头。[/size][/font] [font=宋体][size=16px]根据对样品污染状况的估计,选择2个~3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1 mL样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取1 mL空白稀释液加入两个无菌平皿内作空白对照。[/size][/font] [font=宋体][size=16px]之后,及时将15 mL~20 mL冷却至46℃的平板计数琼脂培养基(可放置于46 ℃±1 ℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。[/size][/font] [b][font=宋体][size=16px]培养和计数[/size][/font][/b] [font=宋体][size=16px]样品稀释完成后,就要进行培养和菌落计数了[/size][/font] [font=宋体][size=16px]待琼脂凝固后,将平板翻转,36℃±1℃培养48h±2h。水产品30℃±1℃培养72h±3h。[/size][/font] [font=宋体][size=16px]如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层琼脂培养[/size][/font][font=宋体][size=16px]基 (约4mL),凝固后翻转平板,按相同条件进行培养。[/size][/font] [font=宋体][size=16px]培养完成后,就要进行菌落计数了,计数可用肉眼观察,必要时用放大镜或菌落计数器,记录[color=var(--weui-LINK)]稀释倍数[i][/i][/color]和相应的菌落数量。菌落计数以菌落形成单位(colony-forming units, CFU)表示。[/size][/font] [font=宋体][size=16px][back=url(&]选取菌落数在30 CFU~300 CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30 CFU的平板记录具体菌落数,大于300 CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。[/back][/size][/font] [font=宋体][size=16px]大片菌落[/size][/font] [font=宋体][size=16px]其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。[/size][/font] [font=宋体][size=16px]链状生长[/size][/font] [font=宋体][size=16px]当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。 [/size][/font] [align=center][b][font=宋体][size=16px]结果与报告[/size][/font][/b][/align] [font=宋体][size=16px]为了生成结果和报告,需要根据计数结果和公式计算出菌落总数。需要注意的是,对于菌落数量不同的培养皿,[color=var(--weui-LINK)]计数原则[i][/i][/color]有所不同。 [/size][/font] [font=宋体][size=16px][back=url(&]若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。若空白对照上有菌落生长,则此次检测结果无效。[/back][/size][/font]
在GB/T 5750.12-2006生活饮用水检验标准中说“对于生活饮用水在做菌落总数时只做一个稀释度,即直接从取1ml水样加入平板中”,那如果培养后平板上的菌落为“多不可计”该怎么报结果啊?
大家有没有遇到这种情况?食品中菌落总数未检出,致病菌的平板检出2个菌?这种情况合理吗?
我做微生物时间不是很长,这一次实验发现了这么一个问题。我做了两个稀释级1:10和1:100的供试液,各自进行营养琼脂平板的培养。观察结果的时候,我发现,1:10稀释级的两个平板都没有菌落生长,但是1:100稀释级的两个平板各有1个和2个菌落生长,而且菌落的形态也不像平常黄白实心的圆点,而是呈絮状的,有点像霉点一样的。像这种情况的话,是样品本身含有的菌还是样品被污染了呢?结果是要按1:100的稀释级来计数吗?

茶叶中菌落总数检测结果的测量不确定度评估1. 概述1.1测量依据:GB4789.2 食品安全国家标准食品微生物学检验菌落总数测定。1.2环境条件:温度(20±4℃),相对湿度≤85% 。1.3测量标准:无。1.4测量对象:晒青毛茶、半成品茶、成品茶等。1.5测量过程:茶叶中菌落总数的测量过程见图1。http://ng1.17img.cn/bbsfiles/images/2015/07/201507011440_552715_2275853_3.png1.6评定结果的使用:在符合上述规定条件下的测量结果,若在测量仪器和人员等实验条件稳定的情况下,可直接使用本不确定度的评定结果。2. 评估模型2.1菌落总数测量的计算茶样经过处理,在恒温培养箱温度为36±1℃的条件下培养48±2h后,所得每g(mL)茶样中形成的微生物菌落总数。假设菌落总数测量时,选定2个测定平行,则茶样单位体积的菌落总数y可由下式算出:y = F·(N1+N2)/(V1+V2)……①式①中:y—茶样单位体积的菌落总数; F—茶样稀释倍数(10的若干指数倍);N1、N2—培养基平板的菌落计算结果; V1、V2—吸取的茶样液体体积,均为1。2.2菌落总数测量的数学评估模型建立在2.1中,式①为理论公式,而在实际测量过程中,1)茶样稀释、2)菌落总数在培养基平板上出现的随机误差、3)人员查计菌落总数的误差、4)培养基的菌落生长率、5)计数平板上菌落的重叠、6)茶样的不稳定、7)同一样品多次平行测量重复性等均会对检测结果有显著影响,即引入了测量不确定度。测量模型表示被测量(y)与各影响因子(x)之间的函数关系,一般通式为y = f(x1,x2, …, xn)。因此,根据GB 4789.2建立茶叶中菌落总数测量的数学评估模型为:y = f (R1,R2, R3, R4, R5, R6, R7) ……②在式②中,R1—茶样稀释过程引入的不确定度;R2—菌落总数在培养基平板上的随机误差引入的不确定度;R3—人员查计菌落总数引入的不确定度;R4—培养基菌落生长率引入的不确定度;R5—计数平板上菌落重叠引入的不确定度;R6—茶样不稳定引入的不确定度;R7—多次平行测量重复性引入的不确定度。3. 鱼骨图由菌落总数测量的数学评估模型的建立,绘制出茶叶中菌落总数测量的鱼骨图,见下图2。其中T表示温度,Temperature;C表示校准,Calibration;其他符号或字母代表的含义见2.2中的解释说明。http://ng1.17img.cn/bbsfiles/images/2015/07/201507011441_552716_2275853_3.png4. 茶叶中菌落总数测量的相对标准不确定度分量的计算由2.2可知菌落总数测量的的数学评估模型中7个不确定度分量相互独立,为方便不确定度运算,下面均以相对标准不确定度来表示各相应的不确定度。4.1茶样稀释过程引入的相对标准不确定度urel(R1)对于菌落总数的测量,在茶样的稀释过程中,茶汤的逐级稀释(将1mL的茶汤原液稀释为10mL)对测量结果的影响最为显著,而在此步骤,以移液器吸取1mL茶汤对菌落总数测量结果的影响更大。其中,影响移液器移取茶汤的不确定度分量有两个,一个是环境温度T,另一个是移液器自身校准的不确定度C。现对不确定度分量u (T)和u (C)分析如下:4.1.1环境温度引入的不确定度分量u(T)根据供应商提供的资料,茶样稀释使用的移液器在20℃下校准。实验室的环境温度控制在20±4℃,而茶样的稀释溶剂为实验室用水,经查阅实验室用水的体积膨胀系数为2.08×10-4(1/℃),依据溶剂的体积膨胀效应,茶样稀释产生的体积变化为±(1×4×2.08×10-4)mL=±8.32×10-4mL,故a=±8.32×10-4mL,假设其服从三角分布,u(T)=±3.40×10-4mL。4.1.2校准引入的不确定度分量u(C)茶样稀释时使用的移液器量程为1mL,根据供应商提供的移液器校准证书,1mL移液器在20℃的体积(1±0.027)mL,故a=±2.7×10-2mL,假设其服从三角分布,有u(C)=±1.10×10-2mL。由不确定度分量u (T)和u (C),利用其不确定度的合成,可计算出茶样稀释过程引入的相对标准不确定度urel(R1)= 1.10×10-2。4.2菌落总数在培养基平板上的随机误差引入的相对标准不确定度urel(R2)培养基计数平板上所查计的菌落总数均值是2个1mL所加茶样(茶样稀释匀液)中细菌经过分别培养出来的菌落总数均值。在一系列充分混匀的等量的粒子悬液(1mL茶样稀释均匀液)中粒子(细菌)数的随机性服从泊松分布(Poisson scatter),所以菌落总数(均值)在培养基平板上的随机误差的不确定度可用泊松分布来表示,其相对标准不确定度urel(R2)为均值的倒数。实验室茶样的2个测定平行,茶样单位体积的培养基平板菌落计算结果为N1=47,N2=33,即可算出urel(R2)= 2.25×10-2。4.3人员查计菌落总数引入的相对标准不确定度urel(R3)测定(检测)人员在查计培养基平板上的菌落时,因经验和计数平板上菌落的复杂培养结果等而出现误差,该误差通过对同一个培养基平板的菌落进行多次计数后统计得出,采用贝塞尔公示urel(R3)=计算,试验数据详细见下表1。urel(R3)= 8.717×10-3。表1同一个培养基平板的菌落进行多次计数 平板计数 // 次 1 2 3 4 5 [a
做菌落总数时,平板上有些很小的点看起来不是圆形的,算不算一个细菌?
做产品的微生物检测,做的是细菌,霉菌和酵母菌试验,做了三个梯度的样品液,在胰酪大豆胨琼脂平板上(第一个梯度)长了菌落,培养的是细菌,但是看着不像细菌,请教各位帮忙看一下长的什么菌,图片是这样的,菌落两面颜色不一样
比如稀释10倍的平板,一个没长,一个长了一个菌落那么按照4789的要求,小于100CFU“按照四舍五入”在取整数 结果是5CFU<10CFU也不行,因为其中也规定了要所有稀释度中均无菌落生长。我这还长了一个所以遇到这种情况是还计为5CFU还是10CFU
[font=SimSun, STSong, &]菌落总数测定时,培养基是卵磷脂、吐温80-营养琼脂,200ml培养基加了0.5%TTC 2ml, 平板上细菌围着平板长了一圈,是什么原因?麻烦各位大神帮忙解答下。[/font]