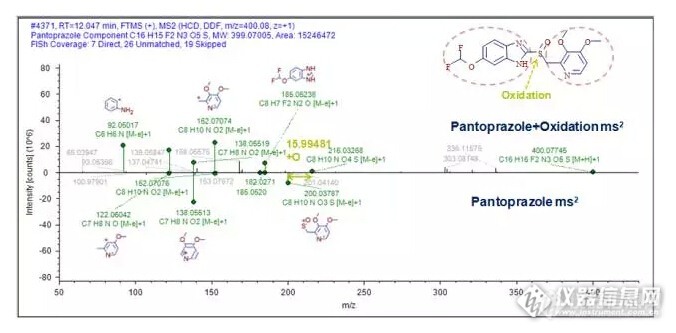
药物杂质是药物活性成分(原料药)或药物制剂中不希望存在的化学成分,会对用药的安全性和有效性带来隐患,因此杂质的检测是保证药物质量至关重要的部分,FDA、EMEA、PMDA、CFDA等各国药品监管部门制定了相应的指导原则对其进行严格管控。http://ng1.17img.cn/bbsfiles/images/2015/12/201512141737_577892_3005330_3.jpg 独有的四极杆静电场轨道阱Q Exactive™ Focus高分辨液质联用技术,凭其高灵敏度、高专属性和高准确性的分析能力,可对样品中药物杂质进行全面的信息采集。结合新一代的智能小分子化合物鉴定软件Compound Discoverer™,以高度灵活的自定义方式制定分析工作流程,对数据中的目标和非目标杂质进行提取、比对及鉴定,工作流程如下:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141737_577893_3005330_3.jpg 通过软件对样品数据的分析和提取,在Compound Discoverer中可以直观、便捷的查看和筛选预期和未知的杂质分析结果,从结果界面中可获得不同条件下样品杂质的变化情况,获得所有杂质保留时间、一级质谱、同位素和二级质谱等丰富信息:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141738_577894_3005330_3.jpg 在获得母药和杂质的一级和二级质谱信息后,软件将调用碎裂数据库(Fragmentation Library)快速的对泮托拉唑的碎片结构进行归属,该数据库几乎涵盖了所有已发表的文献,保证了碎片解析的准确性。在此研究结果之上,通过软件对杂质与母药二级质谱信息之间的比对,可进一步对杂质变化位点进行推测。在本例中,通过152、185等共有碎片和200、216等特征差异碎片的比对,推测出该杂质为泮托拉唑砜:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141738_577895_3005330_3.jpg 基于新一代四极杆-静电场轨道阱质谱Q Exactive Focus和新一代小分子化合物分析软件Compound Discoverer,建立了药物杂质鉴定的新流程。无论是优质数据的有效获取,还是获取后对已知和未知杂质的分析鉴定,该工作流程都可以完美的实现。在本例中,共鉴定到泮托拉唑杂质15个,其中可能的降解杂质9个,可能的工艺杂质6个,为药物杂质的质量控制、安全性评估提供了富有价值的信息。(分享)
药物杂质研究的基本思路及案例分析
药物杂质中有三甲胺、溴代十六烷和溴代十八烷(沸点超过300度)。其中三甲胺标准品的溶剂为甲醇,浓度为100mg/L。做药物杂质的含量分析时,如用DB-5ms柱,进样口温度为310度,则柱温25度甲醇峰掩盖三甲胺的峰;溴代十六烷和溴代十八烷在220度保持20分钟会出峰。如用DB-wax柱,进样口温度为240度,溶剂为乙醚。如何证明溴代十六烷和溴代十八烷在进样口中完全气化。

药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[b]仪器信息网[/b]与[b]天津市分析测试协会[/b]拟于[b][color=#ff0000]2021年7月27日[/color][/b]联合举办[color=#ff0000][b][url=https://insevent.instrument.com.cn/t/Kk]“化学药物杂质研究及检测技术”主题网络研讨会[/url][/b][/color],旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231500576930_1336_2507958_3.png!w690x483.jpg[/img][/url][url=https://insevent.instrument.com.cn/t/Kk][size=18px][color=#ff0000][b]点击报名:https://insevent.instrument.com.cn/t/Kk[/b][/color][/size][/url]
大家好,本人刚工作不久,在一家制药公司,以后主要做关于药物杂质方面的研究,仪器也正在采购,是安捷伦的q-tof,刚开始接触这一行不是很懂,想请教各位大神分享一下经验,感激不尽。
随着公众对药物安全性的日益关注,控制药物中杂质已成为控制药品质量的关键因素之一,也是困扰着广大药物分析工作者的难题之一。由于药物杂质的来源广泛,已知的杂质可以通过现有的分析手段进行定性定量,未知的杂质则成为分析的难题,因此对于药品的杂质控制首要解决的问题就是将所有杂质进行完全分离。为了让广大药物分析工作者能实现有效地药品杂质控制,全国医药技术市场协会于2012年4月10日-13日在上海市举办“2012药物研究分析中新技术、新方法应用及杂质控制研讨会”。 制药企业和新药研究机构的研发人员,各级药品检验所(院)和口岸药品检验所人员,药品生产企业研发技术与质量管理负责人,新药研发CRO实验室人员及高管,各高等院校、科研院所等相关专业人员100多人参加了此次会议。 在此次会议上,多位行业知名专家钟大放(中科院药物研究所),王洪允(协和医院临床药理中心),胡昌勤(中国食品药品检定研究院),周立春(北京市药检所),王玉(江苏省检品检验所),张尊建(中国药科大学分析测试中心)分别讲解了当前药物分析领域中各种新技术、新方法,探讨分析新技术在药品研发及药品质量控制中的应用,特别是用于生物标志物、活性成份、药物代谢等高通量、定性、定量的各种分析技术,以及新版药典对药物分析方法新要求与国外药典比较等内容。 作为全球色谱消耗品领先的制造商,迪马科技一直致力于为食品、药品检测行业提供完善的技术服务,除与参会专家进行技术交流外,迪马科技技术应用工程师还与广大与会者共同分享了《Dikma 高效液相色谱柱技术应用于药品杂质控制分析》技术报告。 对于药品中杂质控制分析,首先要借助色谱柱进行良好的分离,迪马科技在此次技术报告中重点讲解了在杂质控制中色谱柱的分离性能所起关键作用及迪马科技多款液相色谱柱:Ø Diamonsil(钻石)—通用型反相色谱柱,超高的分离性能特别适合分析复杂的样品及杂质;Ø Spursil(思博尔)—通用型极性改性反相色谱柱,耐受100%水相-100%有机相,特别适用于强碱性化合物和极性化合物的分析;Ø Endeavorsil(奋进)—1.8 μm UHPLC专用色谱柱,超高的柱效满足您UHPLC分离杂质的需求;Ø Leapsil(飞跃)—2.7μm兼容UHPLC/HPLC色谱柱,低柱压设计,高选择性可在HPLC上拥有UHPLC色谱柱的分离能力;[font=Wing
[B][center]药物中杂质的来源及杂质限量检查[/center] [/B]药物只有合格品与不合格品;一般化学试剂分为4个等级(基准试剂、优级纯、分析纯、化学纯) [B]药物中一般杂质检查 [/B][B]氯化物为一指示性杂质。[/B] 通过对氯化物的控制,可同时控制与氯化物结合的一些阳离子以及某些同时生成的副产物。可从氯化物检查结果显示药物的纯度,间接考核生产、贮藏过程是否正常。 1. 原理 药物中微量的氯化物在硝酸酸性条件下与硝酸银反应,生成氯化银的胶体微粒而显白色浑浊,与一定量的标准氯化钠溶液在相同条件下产生的氯化银浑浊程度比较,判定供试品中氯化物是否符合限量规定。 Ag+ + Cl- → AgCl ↓ [B]硫酸盐检查法 [/B] 1. 原理 药物中微量的硫酸盐在稀盐酸酸性条件下与氯化钡反应,生成硫酸钡的微粒而显白色浑浊,与一定量的标准硫酸钾溶液在相同条件下产生的硫酸钡浑浊程度比较,判定供试品中硫酸盐是否符合限量规定。 [B]铁盐检查法 [/B]硫氰酸盐法 巯基醋酸法 砷盐检查法 1. 古蔡氏法 1. 原理 金属锌与酸作用产生新生态的氢,与药物中微量砷盐反应生成具挥发性的砷化氢,遇溴化汞试纸产生黄色至棕色的砷斑,与同条件下一定量标准砷溶液所生成的砷比较斑,判断砷盐的含量。 [B]硒、氟及硫化物检查法 [/B]1. 氧瓶燃烧法 适用于以共价键结合的卤素、硫、硒的有机药物。 本法系将有机药物防入充满氧气的密闭燃烧瓶中进行燃烧,将燃烧所产生的欲测组分吸收于适当的吸收液中,然后根据欲测组分的性质,选用合适的分析方法进行鉴别、检查或含量测定。 [B]注意事项及讨论 [/B]1. 根据被燃烧分解的样品量选用适宜大小的燃烧瓶。 2. 测定氟化物时应改用石英燃烧瓶。 1. 硒检查法 (1). 操作方法 样品与对照品液,调节Ph2.0±0.2,加盐酸羟胺,二氨基萘,比色。 [B]硫化物检查法 [/B] 方法同砷盐检查第一法,不装醋酸铅棉花,以醋酸铅试纸代替溴化汞试纸。 标准液取1ml 5/ml [B]澄清度检查法 [/B]将一定浓度的供试品溶液与浊度标准液分别置于配对的比浊用玻璃管,同置黑色背景上,在漫射光下观察。浊度标准液 硫酸肼与乌洛托品溶液混合分五个等级,未超过0.5等级即为澄清。BP98规定未超过1等级即为澄清。 [B]溶液颜色检查法 [/B]CHP2000 [B]1. 比色法[/B] 色调标准贮备液 黄色液 重铬酸钾液(BP98用氯化铁) 红色液 氯化钴液 蓝色液 硫酸铜液 配成各种色调色号标准比色液共50种。 [B]2. 分光光度法 [/B] [B]易碳化物检查法 [/B]检查药物中含有的遇硫酸易碳化或易氧化而呈色的有机杂质。 对照品液 样品液 加硫酸5后,加供试品。 [B]炽灼残渣检查法[/B] 取供试品1.0~2.0g或个药品项下规定的重量,置已炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完全碳化,放冷至室温;除另有规定外,加硫酸使湿润,低温加热至硫酸蒸气除尽后,在700~800炽灼使完全灰化,移至干燥器内,放冷至室温,精密称定,再在700~800炽灼至恒重,即得。残渣限量一般为0.1~0.2% 一般应使炽灼残渣量为1~2mg 若需将炽灼残渣留作重金属检查时,炽灼温度必须控制在500~600。 [B]干燥失重测定 [/B]1. 常压恒温干燥法 2. 干燥剂干燥法 3. 减压干燥法 [B]水分测定法 [/B][B]费休氏法 [/B] 本法是根据碘和二氧化硫在吡啶和甲醇溶液中能与水起定量反应的原理以测定水分。 [B]甲苯法[/B] 在加热状态下,甲苯夹带着水分蒸出,收集蒸出的水分测定。 [B]药物中特殊杂质检查 [/B] [B]一、物理法 [/B] [B]二、化学反应法 [/B](一)容量分析法 (二)重量分析法 (三)比色法和比浊法 [B]三、色谱法 [/B]1.纸色谱法 薄层色谱法 TLC是药典中最常用的特殊杂质限量检查方法。 1.在一定供试品及检查条件下,不允许有杂质斑点存在 2.以待测杂质对照品检测 3.将供试品稀释到适当浓度作为杂质对照品溶液 4.选用质量符合规定的与供试品相同的药物作为杂质对照品 [B]高效液相色谱法 [/B] [B][url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法 [/B] 1.面积归一化法 2.主成分自身对照法 3.内标法测定 4.内标法加校正因子法 5.外标法 有机溶剂残留量测定法 [B]分光光度法 紫外分光光度法 比色法 [url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]分光光度法[/B]
药物(蛋白)的结构表征、理化、纯度及杂质分析都用哪些仪器和方法呀?
版友们,我是公司做化学药物分析的,请问到哪里查询化学药分析相关的文献资料,尤其关于药物分析方法开发验证的文献资料?我已经知道的有咱们的仪器信息网,还有什么其他专业性的网站、杂志?
[table=100%][tr][td]《药物分析杂志》继续被评为2010年度中国科协精品科技期刊示范项目 [/td][/tr][tr][td][/td][/tr][tr][td]摘自中国药品生物制品检定所网站[/td][/tr][tr][td][/td][/tr][tr][td][size=3][font=宋体]按照[/font][/size][size=3][font=宋体]《中国科协精品科技期刊工程项目管理办法(试行)》的有关规定,我所《药物分析杂志》参与了[/font][/size][size=3][font=宋体]2009[/font][/size][size=3][font=宋体]年度精品科技期刊示范项目和英文版期刊国际推广项目总结验收及2010年度精品科技期刊新增示范项目评审工作。根据中国科协学函[2010]59号文的评审结果,[/font][/size][size=3][font=宋体]《药物分析杂志》[/font][/size][size=3][font=宋体]继续成为2010年度精品科技期刊示范项目C类项目。在这次评选中,中国科协所属全国学会主办960余种科技期刊中,有92种期刊被列为2010年度精品科技期刊示范项目,其中A类项目7项、B类项目40项、C类项目45项,各类项目资助额度分别为每项25、15、5万元/年(具体[/font][/size][size=3][font=宋体]项目名单见下表)。中国科协从2006年开始评选精品期刊项目至今,我所《药物分析杂志》已连续5年被评为中国科学精品期刊示范项目(C类)。[/font][/size][size=3][font=宋体][/font][/size][/td][/tr][/table][back=#d40a00][size=4]土豆:是国内药学期刊里的泰山北斗啊,土豆一直望而兴叹啊。[/size][/back]
近几年频频出现药物制剂中检出基因毒性杂质残留而被召回的事件。何为基因毒性杂质呢?“基因毒性杂质”(又称遗传毒性杂质Genotoxic Impurity ,GTI),是指本身直接或间接损伤细胞DNA,产生基因突变或体内诱变,具有致癌可能或者倾向的化合物。其主要来源为原料药合成过程中的起始物料、中间体、试剂和反应副产物,此外,药物在合成、储存或者制剂过程中也可能因为降解而产生基因毒性杂质,因其特点为毒性极强,在很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤的发生,对用药的安全性产生了强烈的威胁。化学药品中的典型基因毒性杂质包括亚硝胺类杂质和磺酸酯类杂质,它们经过代谢激活后基因毒性非常强,是药物研发过程当中最易产生且需严格把控的基因毒性杂质。因此,各国的法规机构如ICH、FDA、EMA等都对基因毒性杂质提出了明确的要求,越来越多的药企在创新药和仿制药研发过程中也更加关注基因毒性杂质的控制和检测。2020 版《中国药典》四部通则中新增了《遗传毒性杂质控制指导原则》,本指导原则对基因毒性杂质的监管策略与ICH M7指导原则几乎保持一致。2020年5月国家药监局药审中心网站发布了《化学药物中亚硝胺类杂质研究技术指导原则》,该原则为注册申请上市以及已上市化学药品中亚硝胺类杂质的研究和控制提供了指导。在理论上,大部分药物都存在残留基因毒性杂质或被基因毒性杂质污染的风险,因此建立便捷、高效的分析方法是非常有必要的。
我也从网上偶然看到的,希望与大家分享[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=32416]药物分析相关国内外杂志[/url]
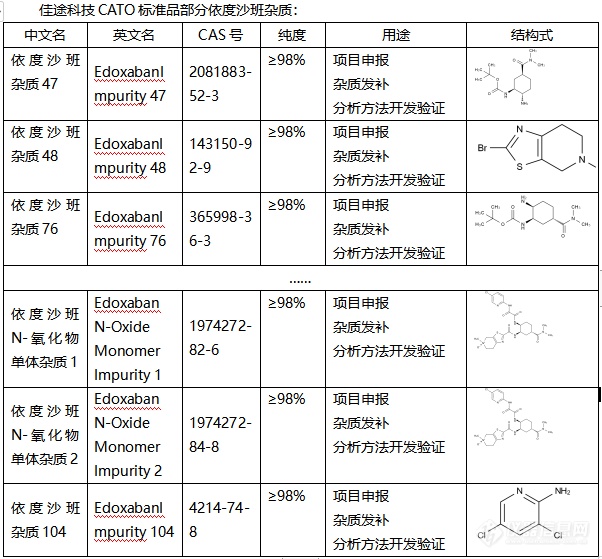
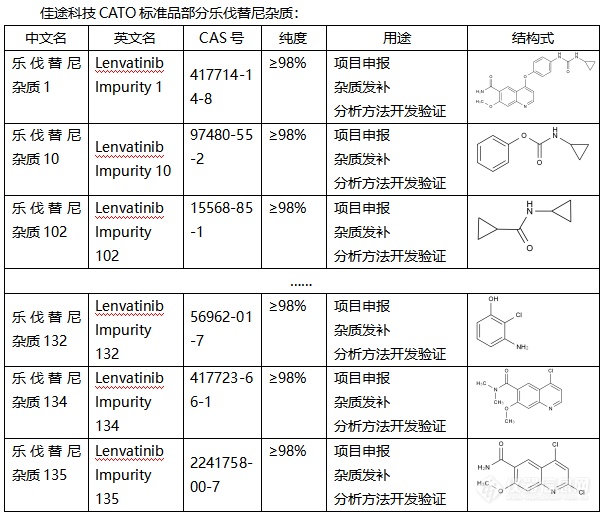
依度沙班,作为一种抗凝药物,被广泛应用于预防和治疗血栓形成。然而,与其他药物一样,依度沙班在生产过程中也可能产生杂质。这些杂质的存在可能会影响药物的安全性和有效性。为了确保依度沙班的质量,科学家们引入了CATO标准进行杂质分析。CATO标准是一种先进的分析方法,可以帮助研究人员准确地检测和衡量依度沙班中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这一标准的应用,不仅提高了依度沙班的生产质量,也为我们提供了一种有效的质量控制手段。在实际应用中,CATO标准品发挥着重要的作用。首先,它能够准确鉴定和量化依度沙班中的杂质,为药物的质量控制提供科学依据。其次,通过与标准品的比对分析,研究人员可以深入了解杂质的来源和性质,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。随着研究的深入,CATO标准在依度沙班杂质分析中的应用将不断优化和完善。通过科学的分析和严格的控制,我们能够确保依度沙班的安全性和有效性,为患者的健康提供更好的保障。同时,这也将推动药物生产的科技进步,造福更多患者。[img=,602,559]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021907159831_6894_6381568_3.png!w602x559.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,目前公司库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并且支持买家溯源。
请教一下各位:药物中杂质的来源主要有哪些?什么是一般杂质?什么是特殊杂质?
鄙人小硕一枚,在一小药厂干活。这两年突然兴起了杂质分析,搞得压力很是大。所以想请教各位前辈。1 公司仪器条件无法满足杂质分析的情况下,是否可以送到第三方检测公司?2 第三方检测公司的报告是否作为杂质确认的直接依据?3 第三方检测公司是否需要资质,对最终的杂质报告是否有影响?4 可否请以前大学的老师帮忙分析,如果可以,老师给的分析结果能够用作杂质报告中?非常感谢!
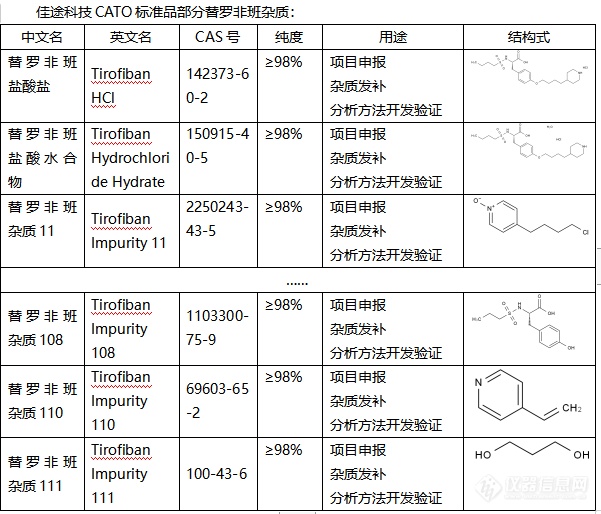
在当今的医疗领域,药物的质量控制至关重要,直接关系到患者的生命健康。替罗非班是一种广泛应用于心血管疾病治疗的药品,其质量控制尤为重要。而杂质分析作为药物质量控制的关键环节,能够准确评估药物的安全性和有效性。本文将重点探讨替罗非班杂质分析与CATO标准品应用研究的重要性。首先,杂质分析是确保药物质量的重要手段。在替罗非班的制备过程中,可能会产生一系列杂质,这些杂质的存在可能对药物的疗效和安全性产生不良影响。CATO标准品作为一种有效的分析工具,能够准确鉴定和量化替罗非班中的杂质,为药物的质量控制提供科学依据。其次,CATO标准品的应用有助于深入了解杂质的来源和性质。通过与标准品的比对分析,研究人员可以追溯杂质的产生途径,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。此外,CATO标准品在指导药物生产和改进方面也具有重要意义。通过对替罗非班中杂质的准确分析,生产商可以针对性地优化生产工艺、加强质量控制,从而提高药物的纯度和安全性。这不仅有助于保障患者的用药安全,还有助于提升企业的生产效益和市场竞争力。综上所述,替罗非班杂质分析与CATO标准品应用研究在药物质量控制中发挥着关键作用。通过深入研究替罗非班中的杂质,并借助CATO标准品这一强大工具,我们能够更好地了解杂质的来源、性质和影响,从而优化药物的生产工艺、提升药物的安全性和有效性。[img=,601,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021849065001_3752_6381568_3.png!w601x514.jpg[/img]欢迎有需要的各位联系

药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[b][color=#ff0000]仪器信息网[/color][/b]与[b][color=#ff0000]天津市分析测试协会[/color][/b]拟于[b][color=#ff0000]2021年7月27日[/color][/b]联合举办“[color=#ff0000]化学药物杂质研究及检测技术[/color]”主题网络研讨会,旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231627454035_7123_2507958_3.png!w690x483.jpg[/img][/url][b][size=18px][color=#ff0000][url=https://insevent.instrument.com.cn/t/Kk]点击参会:https://insevent.instrument.com.cn/t/Kk[/url][/color][/size][/b]
急!急!急!新手请教各位大侠,LC/MS/MS能进行药物杂质限度检查吗?如何确定一药物中某杂质是否超出限度?
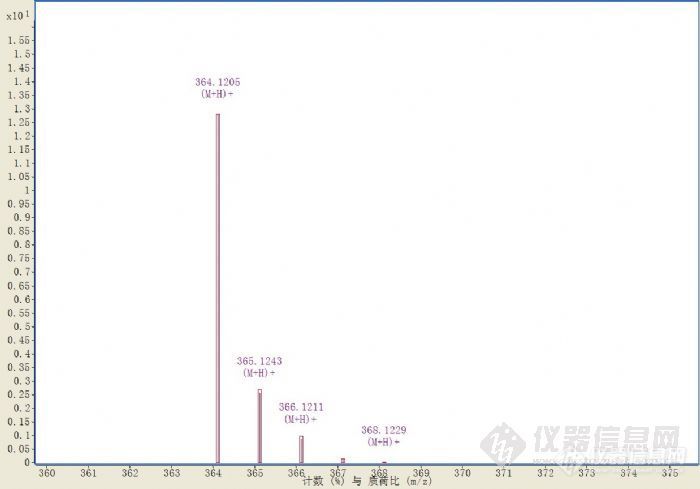
我们单位的ESI-QTOF应用目前还比较简单,主要是分析药物中的杂质,包括原料,中间体,降解产物,未知杂质等。下面我就举两个简单的例子说一说我做样大概的流程吧,希望能抛砖引玉,更多的老师和朋友能讲讲自己在从事的工作。第一个例子是这样的,某天有个同事拿来一个样品,告诉我此样品液相中出4个峰,想让我帮他看看。我进了一针,紫外中确实是4个峰。http://ng1.17img.cn/bbsfiles/images/2011/08/201108312042_313378_1898167_3.jpg但是MS里出来的离子流图却显示出样品中有非常多的物质,远不止4种。http://ng1.17img.cn/bbsfiles/images/2011/08/201108312043_313379_1898167_3.jpg由于紫外检测器和质谱的原理不同,所以液相中认为比较纯的样品不一定就是纯品,常常很尖锐的主峰中都会包含有其他物质。所以配台质谱还是很有必要的哈,我觉得以后做药品申报,会慢慢对这方面有要求的,现在的DAD看纯度太不靠谱了,只要是紫外吸收行为相似的,是看不出来的。第二个例子讲一下我分析样品简单的流程吧。首先进一针只做TOF的UV图http://ng1.17img.cn/bbsfiles/images/2011/08/201108312051_313381_1898167_3.jpgTIC图http://ng1.17img.cn/bbsfiles/images/2011/08/201108312051_313380_1898167_3.jpg然后根据分子特征将TIC中的化合物提出来,下图中每种颜色代表一种化合物,可以看出大概的比例,另外可以明显看出,主峰中包含了两个杂质,红色的那个和主峰在色谱柱中的保留行为非常相似。http://ng1.17img.cn/bbsfiles/images/2011/08/201108312053_313383_1898167_3.jpg分子特征提取的优势是可以将离子流中同一个化合物的相关信息判断出来,例如下图就是系统自动判断出加钠加钾峰,且因为质量精确度高,所以准确度很高。这对于含有较多成分的样品来说,可以省下很多人力。http://ng1.17img.cn/bbsfiles/images/2011/09/201109011013_313511_1898167_3.jpg因为TOF是高分辨质谱,可以根据分子量推测出分子式,当然会给出很多个可能性,要对每个可能的化合物进行同位素丰度和同位素间距等因素的匹配,再结合氮律啊,本身化合物的性质啊等等一些方法,选择出合适的分子式。http://ng1.17img.cn/bbsfiles/images/2011/09/201109011022_313514_1898167_3.jpg各组分分子式的结果http://ng1.17img.cn/bbsfiles/images/2011/08/201108312056_313388_1898167_3.jpg因为我们对主峰后的那个紫色的杂质比较感兴趣,M/Z为364.1207,为了进一步分析其结构,做二级http://ng1.17img.cn/bbsfiles/images/2011/08/201108312100_313389_1898167_3.jpg二级MShttp://ng1.17img.cn/bbsfiles/images/2011/08/201108312106_313393_1898167_3.jpgm/zm/z (计算值)分子式峰高百分数差 (ppm)丢失质量丢失分子式234.0216234.0219C11 H8 N O3 S4.741.28130.0994C7 H14 O2262.0166262.0169C12 H8 N O4 S74.350.83102.1045C6 H14 O308.0585308.0587C14 H14 N O5 S20.910.7756.0626C4 H8364.121 23.09 [/fo
化学药物杂质研究的技术指导原则、化学药物残留溶剂研究的技术指导原则,从国家食品药品监督管理局下载,希望有用。[img]http://simg.instrument.com.cn/bbs/images/default/em09511.gif[/img]
随着新版《药品注册管理办法》的实施,对药品注册的相关技术提出了新的要求,特别是抗生素类高风险产品,目的是全面提升注册上市药品的质量和品质。 杂质研究是药物质量控制研究的重要项目。对抗生素而言,由于其多为半发酵、半合成产品,所含的杂质种类与杂质含量都比普通合成化学药物复杂;同时由于国内抗生素使用范围较广,面临的安全性问题更为突出,因此,杂质研究和杂质控制更是抗生素质量控制研究的关键项目。 对于仿制国内外已上市抗生素的品种,根据仿制药的基本技术要求,应选择被仿药物进行系统的质量对比研究,以保证其质量的一致性。 在杂质研究方面,根据相关技术要求,结合我国抗生素生产和研发的历史以及现实情况,提出如下要求:
化学药物杂质研究技术指导原则(第二稿) [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=63144]化学药物杂质研究技术指导原则第二稿[/url]
[align=left][b]会议简介:[/b][/align][font='微软雅黑',sans-serif][color=#656565] [/color][/font][font='微软雅黑',sans-serif]因不同的对映体在人体内常常具有不同的生物活性,手性药物已成为当今国际新药研究和开发的方向之一。实际应用中,利用手性固定相实现手性色谱分离既直接又简单,已成为中手性药物杂质分析的首选。手性对映体几乎具有完全一样的性质,这使得手性分离更具挑战性,如何选择手性色谱柱、如何获得理想的手性分离是大家普遍关心的问题,本次讲座我们将围绕[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]手性柱的选择与分离优化与大家共同探讨。[/font][align=left][b][font='微软雅黑',sans-serif][color=#333333]主讲老师:[/color][/font][/b][/align][align=left][b][font='微软雅黑',sans-serif] 吴华[/font][/b][/align][align=left][font='微软雅黑',sans-serif] 2003[/font][font='微软雅黑',sans-serif]年加入安捷伦,长期从事实验室耗材特别是[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]耗材的技术支持,具有丰富的方法开发及应用经验。[/font][/align][align=left][font='微软雅黑',sans-serif][/font][/align][align=left][url=https://www.instrument.com.cn/webinar/meeting_18265.html]点击打开链接[/url][/align][align=left]欢迎大家参会交流![/align]

药物杂质即影响药物纯度的物质。药品在临床使用中产生的不良反应除了与药品本身的药理活性有关外,有时与药品中存在的杂质也有很大关系[b][color=#ff0000]。杂质直接关系到药品的质量可控性与安全性[/color][/b],在药物的研究、生产、供应和临床使用等方面,规范地进行杂质的研究,并将其控制在一个安全、合理的限度范围之内,才能保证药物的有效性和安全性。[color=#ff0000][b]因此杂质的研究及检测技术是药品研发的一项重要内容[/b][/color]。 [color=#3366ff][b]2018年8月30日[/b][/color],仪器信息网网络讲堂栏目将为您呈现“化学药物杂质研究及检测技术”主题网络研讨会。届时将邀请业内专家及技术人员为大家介绍化学药物杂质研究的最新进展及检测技术。 [b]如果你是一个对知识渴望的化学药物研究者或从业人员,想了解药物杂质的最新研究进展;又或者是不安于现状的检验检测机构工作者,想要提高检测技术水平,那就千万不要错过这个难得的沟通交流机会,保证会让你有意想不到的收获哦~欢迎大家踊跃报名[/b]([b][url=https://www.instrument.com.cn/webinar/meetings/icd/]点击即可传送至免费报名处[/url],[color=#ff0000]报名截止日期8月29日[/color][/b])![url=https://www.instrument.com.cn/webinar/meetings/icd/][img=,690,636]https://ng1.17img.cn/bbsfiles/images/2018/08/201808281042237666_6386_3429861_3.jpg!w690x636.jpg[/img][/url][url=https://www.instrument.com.cn/webinar/meetings/icd/][img=,690,724]https://ng1.17img.cn/bbsfiles/images/2018/08/201808281042363056_2579_3429861_3.png!w690x724.jpg[/img][/url]
[font=Calibri][font=宋体]仪器信息网于[/font]5[/font][font=Calibri][size=10.5pt][font=宋体]月[/font]22[font=宋体]日组织召开[/font][b] [size=18px][b]新药研发申报与质控专家论坛[/b][/size][/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=6560]龙志敏(SCIEX中国药物市场应用支持经理)[/url][/font][font=宋体],带来报告[b]《[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=6560]SCIEX [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]技术在杂质及基因毒性杂质分析中的解决方案[/url]》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][b][font='Times New Roman'][color=#0563c1][url]https://www.instrument.com.cn/webinar/meetings/SCIEX522/[/url][/color][/font][/b]
乐伐替尼,作为现代医学的瑰宝,广泛应用于肿瘤治疗领域。然而,就像其他药物一样,乐伐替尼在生产过程中也可能会产生杂质。这些微小的杂质,虽然量少,却可能对药物的疗效和安全性产生不可忽视的影响。为了确保乐伐替尼的纯净与安全,科学家们引入了CATO标准品进行杂质分析。CATO标准品,就像一把精准的尺子,能够帮助研究人员准确地检测和衡量乐伐替尼中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这项应用研究不仅提升了乐伐替尼的生产质量,更为患者的安全用药提供了有力保障。借助CATO标准品,我们能够及时发现并控制杂质,确保每一颗乐伐替尼都是纯净、有效的。未来,随着科学技术的不断进步,我们期待看到更多关于乐伐替尼杂质分析的研究成果,为患者带来更加安全、可靠的治疗方案。同时,也期待CATO标准品在更多药物杂质分析中发挥重要作用,守护人类的健康与安全。[img=,603,515]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021836237186_8744_6381568_3.png!w603x515.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,我们目前库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并支持溯源。我们公司已经通过了国内外双ISO 17034质量体系认证,欢迎广大客户选购。
[color=#333333]ICHQ3D元素杂质指导原则下的药物中24种元素杂质方法开发与验证[/color][color=#333333]第一部分:一套[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]方法精确稳定测试ICHQ3D元素杂质指导原则下的药物中24种元素杂质可行性[/color][color=#333333]对于[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]来说,几十种元素同时测定对于仪器来说理论上是可行的,但是存在很多挑战。以ICH Q3D元素杂质指导原则下的药物中24种元素杂质同时测定为例,从实践经验出发,做简要说明。[/color][color=#333333]首要问题是要考虑这些元素包括各自溶液里面含有的基体离子是否可以稳定共存。由于Ru,Pd,Au,Os,Pt等元素基体为盐酸,银离子这个氯离子会产生AgCl沉淀。很多有经验的人都说Ag可以用2%盐酸络和,可是AgCl2与AgCl肯定是存在沉淀溶解平衡的,简单说,我不认为可溶性银可以在含有氯离子的溶液里长时间稳定存在。但是,可以有个折中的办法,就是把Ag和其他含有盐酸基体的元素分开配成母液,等制备线性和加标样品溶液时再让他们混合在一起。《医药分析杂质》2020年的顾宵等人曾考察了葡萄糖酸钙注射液24种元素的溶液稳定性,无论是标准线性溶液还加标样品溶液的波动均在8%以内。[/color][color=#333333]第二个问题是,Hg,Au,Os等元素需要加2%左右的盐酸才能较好得稳定在待测溶液里,否则,会有严重的残留可能连元素线性都走不出来。问题就来了:仪器必须要有较强的消除干扰的能力。(如果仪器无法耐受ClO的质谱干扰,那至少要两套方法,V和Cr需要另外做了)。[/color][color=#333333]第三个问题:由于元素过多,可能会存在同量异位素,比如说Pd与Sn。通过软件推荐与个人判断选择没有重叠的质量数。可在参考前篇文献的基础上,再做微调即可。[/color][color=#333333]最后,随着进样系统的改进,稀释气成了主流[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]仪器的标配,但是因为含有Os,Au,Hg等元素,如果你没有加盐酸去增加溶液对这些元素的溶解性,稀释气不要开太大,不推荐超过0.2L/min。避免更严重的元素残留。[/color][color=#333333]其实,从分析可以看出来,即使做到一个方法里,对仪器与人员都要求较为严苛,付出的劳动肯定是加倍的。这种情况,不论是最终两套还是一套方法,理所当然得要更多的报价才符合实际。[/color][color=#333333]第二部分:谁是ICHQ3D元素杂质里最难测定的元素?[/color][color=#333333]前文说,在不考虑样品基体的情况下,存在24种ICH要求元素的一次测定的可能性。本篇文章以最近实验为例,做简要说明:实际项目里复杂基体做24种元素的复杂性。[/color][color=#333333]在不能抗ClO干扰的仪器上,Au就是YYDS。为了Hg的稳定性不得不加入了200μ/l的金元素,搞得Au深度残留。所谓深度残留就是说:在碰撞反应池前可能都有大量的残留,也就是说你把仪器的能换的东西都换一遍,也不能解决金元素的残留。在更换炬和锥的前提下,也需要冲洗很久,需要数个小时,才能将空白冲洗到亚ppb级别。显然,在第三方实验室是不可能给你这么用仪器的。现实往往就是需要我们在较高金元素背景的基础上去做实验。[/color][color=#333333]大家都知道可以Au的基体是盐酸,理论上来说,用盐酸会更好,也可以把金元素和含盐酸基体的元素一起做。但如果真的用盐酸体系去做实验会遇到很多坑。原因是:不同Cl的含量和Cl的化学形态会影响在仪器上Au脱附的程度(结论来自于实践经验,不作赘述)。所以,前文那个在葡萄糖酸钙注射液里同时测定24元素的文献是比较鸡贼的,挑了一个最简单的情况去做应用。[/color][color=#333333]曾遇到的比较反直觉的用盐酸基体做Au的案例:开发实验的样品金元素测得值基本平行,加标回收率虽然波动比较大,但也符合要求。但是过程空白RB偏高,按说强度应该和同等酸度的线性空白一致,你总不能说加热一下,就凭空出来很多金元素吧?所以,这时候我为了避免偶然性,读了一百次数据,如下图[/color][img]https://ng1.17img.cn/bbsfiles/images/2021/09/202109200126549456_7799_3426767_3.[/img][align=center][img=,690,517]https://ng1.17img.cn/bbsfiles/images/2021/09/202109231031398718_2301_3237657_3.jpg!w690x517.jpg[/img][/align][color=#333333]此时信号,经过四十多秒的上升期,以后信号相当稳定,但是有一点点下降趋势。分析如下:前面那40多秒的上升期:属于基体切换过程中的进样系统脱附的过程,后面的信号其实就是Au不断洗脱而检测下来的信号。重新走线性空白(含有和过程空白与样品溶液同等含量的盐酸)就信号变得很低,所以不可能是试剂里面的。真相就是:不同Cl的化学形态影响了仪器进样系统的金元素的洗脱效率,并且,这个过程较为稳定(洗脱Au的过程比较漫长),所以信号也比较稳定,只是略有下降趋势。图中绿色线为内标Bi,红色为Au元素信号。[/color][color=#333333]前文说的折中方案其实就是最终方案。实际的项目复杂性,不仅仅在于理论上的,更多时候是要考虑此时此地的资源。最后结论是:很多时候ICH的24个元素三套验证是可以保证的,两套要看实际情况,一套除非是特例,比如可以直接溶解,样品浓度比较小等情况时。关键性元素Ag,V,Cr一起,贵金属,Os等盐酸基体元素一组,Au理论上可以归到第二组,实际上,很多需要消解的例子,只能是单独拿出来用硝酸体系做,以避免Au的洗脱效率不同而造成数据异常。如果您的仪器用Au去做Hg的稳定剂,那么Au就是最难做的元素,没有之一,此时最后解决之道也变成了:索性让Au稳定在仪器上,往往避免加盐酸,而把金做到硝酸体系里去,但是硝酸溶解金的能力弱,所以溶液残留也比较严重。做实验的时候需要注意冲洗,算是一个折中的办法。如果想要扯彻底的解决Au难测定的问题,只有用额外加稀盐酸的方式去稳定Hg,此时实验室的解决方案才更有可能一套方法去测定24元素。[/color][color=#333333]第三部分:在深度残留Au的仪器上,且仪器可使用时间有限的情况下,做Au元素开发验证的要点。[/color][color=#333333]降低仪器本底还是必须要做的:用样品溶液冲洗仪器的Au残留20min,同时起到了老化锥口的作用。[/color][color=#333333]关闭稀释气体,稀释气会让气溶胶更干,从而让难溶解的Au更容易的残留,增大冲洗的难度。[/color][color=#333333]每针溶液之间用稀释剂(稀硝酸)冲洗,千万不要用盐酸冲洗,这会把残留的Au大量得冲洗下来,而完全冲洗下来又需要的时间太长,反而把事情搞得更复杂了。[/color][color=#333333]当进第一个样品基体时,要注意放置一段时间(比如:3分钟)再开始测试,避免切换样品溶液过程中冲洗下来比稀硝酸多几倍的金。当然,如果样品就是盐酸,我们可以尽可能得减小样品浓度,并且考虑基体匹配。[/color]
对于未收载于药典的药物制剂,其杂质限度应该如何制订?是否参照已上市的原研药制订?对于改剂型的品种,没有原研药可以参照的话,是否参照药典中原料药的杂质限度和制剂中原料药的含量而制订?比如原料药中杂质限度为0.1%,制剂每片中100mg,其中原料药50mg,辅料50mg,则制剂中该杂质的限度应为0.1%×(50/100)=0.05%?这是同事跟我说的,谁能告诉我出处?谢谢!按我的理解:药品中的杂质有两种:有关物质和其他杂质。(残留溶剂另外列出,不算在杂质内。)对于有关物质,因为是原料药的降解产物,辅料中不会有,所以参照药典中原料药的杂质限度和制剂中原料药的含量来制订标准是合理的;对于其它杂质就不知道了。有没有人在FDA法规或ICH指导原则上见过这样的说法?有的话请贴上来。
药物是预防、治疗、诊断疾病和帮助机体恢复正常机能的物质。药品质量的优劣直接影响到药品的安全性和有效性,关系到用药者的健康与生命安危。虽然药品也属于商品,但由于其特殊性,对它的质量控制远较其他商品严格。因此,必须运用各种有效手段,包括物理、化学、物理化学、生物学以及微生物学的方法,通过各个环节全面保证、控制与提高药品的质量。传统的药物分析,大多是应用化学方法分析药物分子,控制药品质量。在80年代以前,容量分析法在药物分析方法中一直占有主导和统治地位。然而,现代药物分析无论是分析领域,还是分析技术都已经大大拓展。从静态发展到动态分析,从体外发展到体内分析,从品质分析发展到生物活性分析,从单一技术发展到联用技术,从小样本分析发展到高通量分析,从人工分析发展到计算机辅助分析。可以说,哪里有药物,哪里就有药物分析。随着科学技术的发展,药物分析新技术在不断涌现,以求满足药物科学发展的需要。如手性色谱学、高效毛细管电泳、色谱与光谱联用、色谱与质谱联用(LC/MS)、色谱与核磁共振谱联用技术(LC/NMR)、近红外光谱以及计算机辅助药物分析,使药物分析方法向自动化、智能化和微量化发展。其中毛细管电泳法是一种将电泳技术与色谱技术相结合的新型分离分析方法,可以分离、分析从离子到中性分子,从小分子到大分子的各种化合物,具有分离效率高、速度快及分析仪器自动化程度高等特点。毛细管电泳法可用于多种药物分离、手性药物拆分和血药浓度测定等。药物分析联用技术如LC/MS,LC/NMR 等,将色谱的高分离性能与NMR、MS强大的结构确证能力相结合,具有快速、灵敏和高通量的特点。LC/MS 已成为药物分析、药物体内外代谢研究、药物及其代谢物的高通量分析、药物杂质和降解物的鉴别、手性杂质分析等方面,应用最广泛和最有价值的技术之一。LC/NMR也已用于药物杂质、反应混合物、降解产物、天然产物、体内体外代谢物的分离与结构分析。以上可以看出,我国药物分析方法虽然已有了长足的进步,但是与国外相比还有一定的差距。药物分析要发展,就必须重视新仪器、新技术、新方法的研究和开发,提高药物分析工作者的素质,以缩短与世界先进水平的差距。随着电子技术和计算机技术的发展,药品质量控制方法的种类不断推陈出新、数量日益增长,药物分析技术势必向微量、灵敏、准确、简便、快速、自动化的方向发展
第一章 概论 首先简述了药物分析的历史、任务和发展趋势,对药物分析常用的两种色谱分析方法,即高效液相色谱和毛细管电泳的原理、特点和检测器进行了简单的介绍。阐述了药物质量控制的必要性,介绍了药物杂质的来源和种类。对高效液相色谱在药物质量控制、特别是在杂质控制方面 毛细管电泳在药物质量控制和体内药物分析方面进行了全面的综述。介绍了HPLC法在多种临床用药等方面的应用 毛细管电泳-安培检测技术在药物质量控制、体内药物分析的应用等。本章共引用文献185篇。第二章 HPLC对左旋多巴甲酯水解速率常数的研究 左旋多巴甲酯盐酸盐是一种高水溶性前体药物,用于左旋多巴或者多羧酶抑制剂治疗无效时,治疗帕金森病。在新产品投放市场前,应在新药的分子水平上进行详细的动力学研究,提供反应速率常数的影响因素的量化数据,掌握温度,pH,溶剂对药物稳定性的影响,在药物制剂,贮存,以及分析过程中避免其降解起着重要的作用。本文首次研究了左旋多巴甲酯在37~75℃温度范围内,0.05-1.5mol/L的盐酸溶液中的水解动力学。采用等度高效液相分析方法同时检测左旋多巴甲酯及其水解产物左旋多巴,得到了一系列水解速率常数以及氢离子浓度...[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=31316]色谱技术在药物分析中的应用[/url]