HJ701-2014黄磷 [url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法 能不能用来做元素磷、单质磷的方法验证?HJ593-2010 单质磷 磷钼蓝分光光度法的标准物质用总磷还是磷酸盐还是水中磷?现在用总磷标准物质直接法可以。萃取法做不出曲线。

请教各位老师:1.《污水综合排放标准》 GB 8978-1996中的元素磷和《水质 单质磷的测定 磷钼蓝分光光度法(暂行)》HJ593-2010中的单质磷是不是一种物质?2.请问加标是否是使用的正己烷中的黄磷标准溶液?3.请问元素磷没有方法检出限,是否需要按照HJ168-2010中的规定验证方法检出限呢?如果需要,那么估计的方法检出限应该取多少呢?4.由于实验结果不理想,参考了相关方法改进的文献。但有一个地方不太明白,若选用酸性高锰酸钾体系作为氧化剂,由于其溶液显黑紫色,如何判断溶液在加入氢氧化钠之后显粉红色?(不知道论坛能否上传文献,截图如下)[img=文献改进方法,333,632]https://ng1.17img.cn/bbsfiles/images/2020/06/202006181447113110_4689_4141807_3.png!w333x632.jpg[/img]
石墨炉检测时,我遇到的问题。想知道某种单质元素的检测下限,该怎么进行计算。利用L=3SD/K 这个公式是否可行,如果可行这时我取的浓度到底是多少,是利用仪器合约CDL值。还是随便取浓度,例如锰1PPb浓度标准溶液,是用来测试岛津6300C仪器石墨炉检测限是否合格的,但是合约CDL值15. 而其引入计算的公式为L=2*3*s/A 这里我就不明白了,既然已经给出了检测限的CDL合约值为什么不用合约值引入计算而用 1 PPB的浓度呢。而且石墨炉测试的时候高密管和热解管的检测范围也不一样,例资料上介绍 热解管可以测到1ppb,那么他的这个1ppb是上限还是下限呢。如果是下限可以很好的理解因为他下面说它的定点检测为2 , 4 ,6ppb三点。高密度管可以测到100ppb。 可是他的定点检测确是20 40 60ppb。那这里的可“以测试”又代表什么意思呢?是“上限还是下限”,我觉得这里怎么前后矛盾?而原子吸收分光光度法分析手册第4册上石墨炉各元素的测定条件。银测试他的曲线范围为0 2 6 10 四点曲线,用的是高密石墨管。那这里又作何解释呢?而且线性是相当的TM的好 。头大!他的线性范围是如何规定的是否有计算公式呢。想弄白可以测到100 和可以测到1 PPB 到底是什么意思?
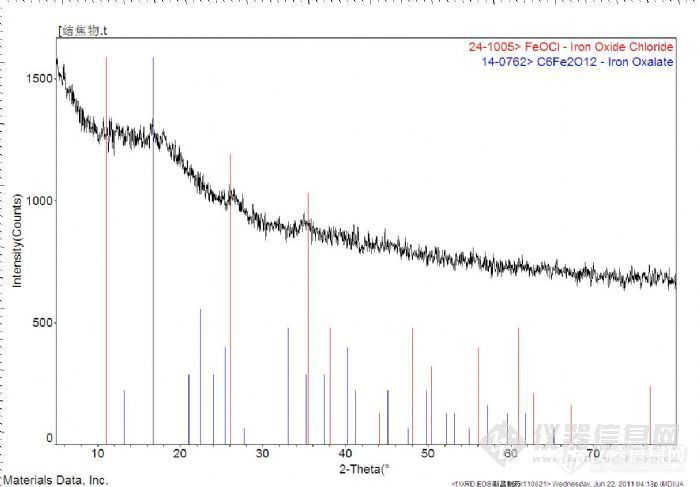
各位大侠,有一个未知物做了XRD元素分析,贴上附件,这个图谱我看不懂,请问一下这个图中的碳元素能判断它是单质碳还是有机物中的碳么?我对XRD谱图不明白,请各位兄弟姊妹帮我解析一下。http://ng1.17img.cn/bbsfiles/images/2011/07/201107101131_304096_1658897_3.jpg
GDMS的检测报告,里面元素我测出来只能是单质态的含量,氧化物含量需要换算一下,请问怎么换算呢?
1、与水反应最激烈的金属是K,非金属是F。2、原子半径最大的是K,最小的是H。3、单质硬度最大的,熔、沸点最高的,形成化合物品种最多的,正负化合价代数和为零且气态氢化物中含氢百分率最高的元素是C。4、气体密度最小的,原子核中只有质子没有中子的,原子序数、电子层数、最外层电子数三者均相等的是H。5、气态氢化物最稳定的,只有负价而没有正价的,无含氧酸的非金属元素是F。6、最高氧化物对应的水化物酸性最强的是CI,碱性最强的是K。7、空气中含量最多的,气态氢化物在水中的溶解度最大,其水溶液呈现碱性的是N。8、单质和最高价氧化物都是原子晶体的是Si。9、具有两性的元素是AI(Be)。10、最轻的金属是Li。
用xrf测量 有些元素用单质和化合物结果差别大不 我钡单质和氧化钡相差挺大的 求助啊 帕纳科的

[img]http://ng1.17img.cn/bbsfiles/images/2009/09/200909291735_173625_1610969_3.jpg[/img]碳目录碳元素简介 碳的同位素 单质碳的形式 碳元素的化合物 碳的发现史 [color=#DC143C]碳元素简介[/color] 碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的 [color=#00008B]元素周期性质[/color]“炭”字加石字旁构成,从“炭”字音。 碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。 碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳[1]元素。
22.某出土文物经化学分析仅含有两种元素,则该物质 (A )A.可能是混合物也可能是纯净物 B.一定是一种化合物C.可能是一种单质和一种化合物 D.一定是两种单质 为什么不选 C ?? [b]问题补充:[/b]题目中说 “一种单质和一种化合物”,化合物可以是两种元素啊!
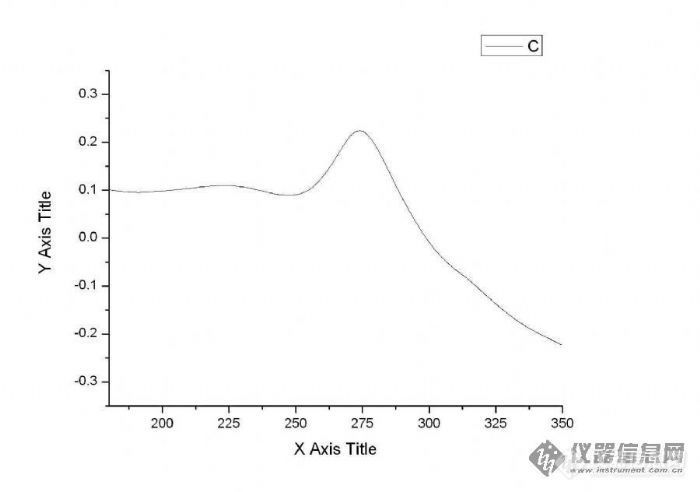
样品为三元合金,由XRD分析可能含有其中一种元素的单质,一个奇特的峰出现在融解峰之前,详见附图,右边再往后就是融化峰了,请问这个峰会是此单质结晶引起的吗?[img]http://ng1.17img.cn/bbsfiles/images/2006/03/200603211450_15360_1694167_3.jpg[/img]

[img]http://ng1.17img.cn/bbsfiles/images/2009/11/200911132348_184442_1610969_3.jpg[/img][color=#DC143C]元素性质[/color] 在古汉语中,“铬”的意思是“理发”。 元素名称:铬 [汉语拼音为 gè] 搞金属材料的人一般发音为【[color=#00008B]luo 四声[/color]】 元素符号:Cr 元素原子量:51.9961 元素类型:金属元素 原子体积:(立方厘米/摩尔) 7.23 元素在太阳中的含量:(ppm) 20 元素在海水中的含量:(ppm) 太平洋表面 0.00015 地壳中含量:(ppm)100 质子数:24 中子数:28 原子序数:24 所属周期:4所属族数:VIB 电子层分布:2-8-13-1 晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。 氧化态: Main Cr+3 Other Cr-2, Cr-1, Cr0, Cr+1, Cr+2, Cr+4, Cr+5, Cr+6 电负性: 1.66 外围电子排布: 3d5 4s1 核外电子排布: 2,8,13,1 同位素及放射线: Cr-49[42.3m] Cr-50 Cr-51[27.7d] *Cr-52 Cr-53 Cr-54 电子亲合和能: 0 KJmol-1 第一电离能: 653 KJmol-1 第二电离能: 1592 KJmol-1 第三电离能: 2987 KJmol-1 单质密度: 7.19 g/cm3 单质熔点: 1857.0 ℃ 单质沸点: 2672.0 ℃ 原子半径: 1.85 埃 离子半径: 0.62(+3) 埃 共价半径: 1.18 埃

一提到锂,我们首先想到的就是随处可见的锂离子电池。而在润滑脂应用行业,提到锂元素,首先想到的则是锂基润滑脂。锂元素除了制造电池、锂基脂外,在我们的生活中还有哪些其他用途呢?今天,信友带你了解一下锂元素的前世今生。[font='calibri'][size=13px]锂元素的发现[/size][/font]锂发现至今已有200多年。1800年,一位巴西人在瑞典的一个小岛上发现了透锂长石。1817年,瑞典化学家阿尔费特逊在对透锂长石进行研究时发现,硅氧化物和铝氧化物只能占到96%的重量,矿石中必然含有一种未被发现的碱金属元素。他的老师贝采利乌斯将这种新元素命名为lithium——锂,该词来源于希腊语的lithos,意为石头,表示它是从石头里发现的。但遗憾的是,阿尔费特逊未能分离出锂的单质。直到1821年,英国化学家布兰德使用电解法通过电解氧化锂获得了微量的锂单质。而大量的锂单质则要等到1855年,德国化学家本生和英国化学家马奇森电解氯化锂时才首次得到。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/07/202207291633422303_8716_5650439_3.jpeg[/img][/align][align=center]阿尔费特逊[/align][font='calibri'][size=13px]不安分的锂单质[/size][/font]锂单质是一种银白色的金属,和钠一样,它的质地很软,可以用刀切开。但是它的密度很小,只有0.534克/立方厘米。这使得它不可能像钠一样放在煤油或液体石蜡之类的液体油类里保存,因为锂单质会漂浮起来,因此它们被封在固体石蜡或凡士林中保存,或者封于惰性气体中。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/07/202207291633424950_7314_5650439_3.png[/img][/align][align=center]浮于油中的金属锂[/align]此外,锂单质的化学性质也非常活泼。它在空气中就能和氮气、氧气反应,形成氮化物和氧化物层把自己包裹起来。除此以外,它还可以与水、乙醇、氨气等常见物质发生较为剧烈的反应。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/07/202207291633427362_8213_5650439_3.jpeg[/img][/align][align=center]锂在空气中燃烧[/align][font='calibri'][size=13px]用途广泛的锂元素[/size][/font][font='calibri'][size=13px]锂电池[/size][/font]20世纪70年代末,锂电池问世。由于金属锂密度小,在电池容量相同的情况下所需的材料质量就少,电池就可以做得更轻、更小。但最早的锂电池是一次性的,不能充电再次使用。后来很快开发出了可充电的锂金属电池,它的循环寿命可达1000 次以上且循环衰减很小。这对当时方兴未艾的电子产品产业来说是个巨大的好消息,意味着电子产品从此可以拥有小巧便携、高能量储量、可循环使用的移动电源。[font='calibri'][size=13px]医疗[/size][/font]在医学中,碳酸锂可作为精神药物使用,用于治疗躁狂症、双相情感性精神障碍等。但该药的治疗量和中毒量较为接近,用药过量会导致锂中毒,因此对适应人群有一定限制,且需在医生指导下使用。[font='calibri'][size=13px]玻璃行业[/size][/font]锂精矿或锂化物在制造玻璃时有较大的助熔作用,添加到玻璃配料中能够降低玻璃熔化时的温度和熔体的粘度,简化生产流程,降低能耗,延长炉龄,增加产量,改善操作条件,减少污染。[font='calibri'][size=13px]其他[/size][/font]锂化合物也可用作陶瓷的添加剂,帮助改善材料性能。锂的同位素锂6也是重要的核工业原料。另外,锂及其化合物常当作高能燃料用于火箭、飞机或潜艇上。锂还能制造“锂盐肥料”,防治西红柿腐烂和小麦锈穗病。[font='calibri'][size=13px]锂元素用于润滑脂[/size][/font]锂基润滑脂是20世纪40年代至今发展最快、当前生产量最大、应用领域最广泛、最受各国润滑脂行业重视、而且仍然是21世纪最有发展前景的最重要的润滑脂品种之一。锂基润滑脂生产要求使用先进的生产设备和现代润滑脂生产工艺技术,因此,美国润滑脂协会将全世界润滑脂生产调查统计数据中各国家和地区锂基润脂产量的多少,作为衡量一个国家和地区润滑脂工业技术水平先进或落后的标志。[font='calibri'][size=13px]锂基酯的发展历程[/size][/font]锂基润滑脂的发展历程,可以追溯到20世纪40年代,美国率先开展了锂基润滑脂的研究和生产工作,并于40年代后期将锂材料引入西欧,开始生产满足航空工业所需要的高质量锂基润滑脂,并出现了锂基润滑脂规格DTD577和美国锂基润滑脂规格 Spec ANG3A。在20世纪50年代末,美国的锂基润滑脂迅速发展,成为润滑脂工业史上的里程碑。我国于20世纪60年代初期开始生产锂基润滑脂,到70年代后期,锂基润滑脂产量占润滑脂总产量的5%左右,80年代前5年,我国润滑脂产品品种结构发生了显著的变化,锂基润滑脂产量达到润滑脂总产量的13%以上,1990年的产量已达到21.5%,2007年我国润滑脂品种构成继续向着国际先进水平发展,锂基润滑脂产量的比例提高到81.81%。20世纪末虽然相继出现了性能良好、极具发展前景的聚脲润滑脂、复合钛基润滑脂和高碱性磺酸盐复合钙基润滑脂等新品种,但是在21世纪一个相当长的时期内,锂基润滑脂仍然是最具有良好的发展前景、产量最大、应用面最广的润滑脂品种。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2022/07/202207291633428857_8471_5650439_3.png[/img][/align]
我是新手,知道XRF可以测定元素种类和含量.我现在有一瓶样品,已知含银,我想测定里面的银是单质状态还是离子状态,如果单质和离子都有,那么浓度分别是多少.这样的检测用XRF可以测吗?
生命元素——氟- 【基本信息】元素名称:氟 元素符号:F 元素原子量:19.00 元素类型:非金属 原子体积:(立方厘米/摩尔)12.6 元素在太阳中的含量:(ppm) 0.5 元素在海水中的含量:(ppm) 太平洋表面 0.0001 地壳中含量:(ppm)950 质子数:9 中子数:10 原子序数:9 所属周期:2 所属族数:VIIA 氧化态:Main F-1 电子层分布:2-7 晶体结构:晶胞为简单立方晶胞。 化学键能: (kJ /mol) F-F 159 F-O 190 F-N 272 C-F 484 标准生成热 0.0kJ/mol 标准吉布斯自由能0.0kJ/mol 标准熵202.7 J/K*mol 电离能 (kJ/ mol) M - M+ 1681 M+ - M2+ 3374 M2+ - M3+ 6050 M3+ - M4+ 8408 M4+ - M5+ 11023 M5+ - M6+ 15164 M6+ - M7+ 17867 M7+ - M8+ 92036 M8+ - M9+ 106432 晶胞参数: a = 550 pm b = 328 pm c = 728 pm α = 90° β = 90° γ = 90° 热导率: W/(m·K) 27.7 发现人:莫瓦桑(H.Moissan) 发现年代:1886年 发现过程:1886年,法国的莫瓦桑在铂制U型管中,用铂铱合金作电极,电解干燥的氟氢化钾,制得氟。 元素描述 属于卤素的一价非金属元素,正常情况下氟气是一种浅黄绿色的、有强烈助燃性的、刺激性毒气,是已知的最强的氧化剂之一,元素符号F。氟气为苍黄色气体,密度1.69克/升,熔点-219.62℃,沸点-188.14℃,化合价-1,氟的电负性最高,电离能为17.422电子伏特,是非金属中最活泼的元素,氧化能力很强,能与大多数含氢的化合物如水、氨和除氦、氖、氩外一切无论液态、固态、或气态的化学物质起反应。氟气与水的反应很复杂,主要氟化氢和氧,以及较少量的过氧化氢,二氟化氧和臭氧产生,也可在化合物中置换其他非金属元素。可以同所有的非金属和金属元素起猛烈的反应,生成氟化物,并发生燃烧。有极强的腐蚀性和毒性,操作时应特别小心,切勿使它的液体或蒸气与皮肤和眼睛接触。 来源和用途 元素来源:可从电解熔融的氟化钾和无水氟化氢的混合物中制得。 元素用途:液态氟可作火箭燃料的氧化剂。含氟塑料和含氟橡胶有特别优良的性能。含氟塑料和含氟橡胶等高分子,具有优良的性能,用于氟氧吹管和制造各种氟化物。 元素辅助资料:正是经过19世纪初期的化学家发反复分析,肯定了盐酸的组成,确定了氯是一种元素之后,氟就因它和氯的相似性很快被确认是一种元素,相应的存在与氢氟酸中。虽然它的单质状态一直拖延到19世纪80年代才被分离出来。氟和氯一样,也是自然界中广泛分布的元素之一,在卤素中,它在地壳中的含量仅次于氯。早在16世纪前半叶,氟的天然化合物萤石(CaF2)就被记述于欧洲矿物学家的著作中,当时这种矿石被用作熔剂,把它添加在熔炼的矿石中,以降低熔点。因此氟的拉丁名称 fluorum从fluo(流动)而来。它的元素符号由此定为F。拉瓦锡在1789年的化学元素表中将氢氟酸基当作是一种元素。到1810年戴维确定了氯气是一种元素,同一年法国科学家安培根据氢氟酸和盐酸的相似性质和相似组成,大胆推断氢氟酸中存在一种新元素。他并建议参照氯的命名给这种元素命名为fluorine。但单质状态的氟却迟迟未能制得,直到1886年6月26日,才由法国化学家弗雷米的学生莫瓦桑制得。莫瓦桑因此获得1906年诺贝尔化学奖,他是由于在化学元素发现中作出贡献而获诺贝尔化学奖的第二人。比较一下氯和氟的发现史,是很有意义的。氯在它的单质被分离出来30多年后才被确认为是一种元素;而氟在没有被分离出单质状态以前就被确认为是一种元素了。这一史实说明在人们对客观事物的认识过程中,逐渐掌握了它们的一些规律后,就能更快、更清楚地认识它们。 主要性质和用途 熔点为-219.6 ℃,沸点为-188.1 ℃,密度为1.696 g/L(0 ℃)。淡黄色气体,是最活泼的非金属元素。用于制氟化试剂以及金属冶炼[
各位老师:你们好,我是一名XPS的新手,有很多的难点想向老师请教,希望老师帮忙解答。 分析XPS的价态时,元素的单质和元素的化合物的标准结合能该怎么取,因为很多资料上显示结合能都有很多种,这就给分析造成了很大的麻烦,如Al和Al2O3 的Al的结合能都有很多个,这样Al2O3相对于Al的化学位移就不好确定,价态就确定不了,请求各位老师帮忙解惑。谢谢。
化学元素的汉语名称的造字、读音一般都有其规律。在汉语里,化学元素的名称都是用一个汉字来表达的。有一些是沿用固有文字的,如,金、银、铜、铁、锡、铅等;有的是根据固有的字改变或增加偏旁而成为化学专用名称的,如碳、磷等;有的是从译音而创造的,如钠、锰、钨、钙等;有的是译意的,如轻气、养气、淡气等,后来又演变成氢、氧、氮,仍保持原字的读音。为了便于识别,现在我国通用的化学元素汉语名称里,凡金属元素除汞外均写作“钅”字旁,非金属元素则依其单质在通常状态下存在状态,分别加“气”、“氵”或“石”等偏旁。化学元素的读音,一般都是按偏旁字来发音的。例如镁读作“美”,氟读作“弗”(fú),碘读作“典”等等。但也有不少例外,如氧读作“养”,钠读作“纳”,溴读作“嗅”。有些元素名称常被读错,例如,铬应读作“各”,却常误读为“洛”;氯应读“绿”(lǜ);却常误读为“碌”(lù);氙本应读“仙”,却常误读为“山”。化学元素的外文名称,在命名时,往往都是有一定含义的。有的是根据元素的某些特性而命名的,例如氧的拉丁文名称是Oxygenium,意思是“成酸的元素”;氮的拉丁文名称是Nitrogenium,意思是“无益于生命”;其他如氯Chlorine(绿色,因为氯是黄绿色气体)、溴Bromine(原意是恶臭)、铯Caesium(天蓝色的意思,因为铯的光谱线中有一条天蓝色谱线)。有的元素名称往往表示它是从什么物质里分离出来的。例如钠从苏打中来,定名Sodium,而拉丁文是Natrium;钾从草木灰中来,定名Potassium,而拉丁文是Kalium。
有哪位兄弟姐妹知道,硒单元素溶液标准物质的配制方法?证书上面写的是以高纯硒、高纯盐酸三次纯化水为原料,在室温为20°C加减2°C的洁净室中采用重量法配制成的。硒单质不会和盐酸反应。它说的用重量法,是怎么配制出来的?谢谢了。
[color=#ff483f][size=5]金[/size][/color]基本信息 元素名称:金(Gold) 符号:Au 金属密度:19.3 g/cm3 比热容:0.13 kJ/(kgK) 原子序数:79 核电荷数:79 核外电子数:79 常见氧化数:+1、+3 原子半径:134 M+离子半径:137 M3+离子半径:85 M+(气)水合热:-644 升华热:385 原子体积:(立方厘米/摩尔):10.2 元素在太阳中的含量:(ppm):0.001 元素在海水中的含量:(ppm):0.00001 地壳中含量:(ppm):0.011 氧化态:Main Au+3 Other Au-1, Au0, Au+1, Au+2, Au+5, Au+7 氧化金 三价金的氧化物,分子式 Au2O3,水合物分子式为Au2O33H2O;分子量 495.98 ;含金量 77.0%;外观 棕色粉末;储存方法:常温干燥密封储存。化学特性: 加热时放出氧气,生成单质金。2Au2O3 = 4Au + 3O2↑ 制法: 高温加热氢氧化金可制得。2Au(OH)3 = Au2O3 + 3H2O
一、金属性与金属活动性 金属性是指气态金属原子失去电子(形成气态阳离子)能力的性质。我们常用电离能来表示原子失去电子的难易程度,一般说来,元素的电离能数值越大,它的金属性越弱。 金属活动性则指在水溶液中(非固相或[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]),金属原子失去电子(形成简单水合离子)能力的性质。它是以金属的标准电极电位为标准的,标准电极电位与原子的电离能、升华能、水合能等多种因素有关。可见“金属性”与“金属活动性”并非同一概念,一般来说,金属性强的元素,金属活动性越强,但两者有时也表现不一致。例如Cu和Zn、Na和Ca,金属性:CuZn,NaCa;金属活动性:ZnCu,CaNa。 二、金属性强弱的判断依据 1、依据金属活动顺序表(极少数除外)。位置越靠前,金属性越强。 2、常温下与水反应的难易程度。与水反应越容易,金属性越强。 3、常温下与酸反应的难易程度。与酸反应越容易,金属性越强。 4、金属与盐溶液间的置换反应。金属性强的金属能置换出金属性弱的金属。 5、金属阳离子的氧化性强弱(极少数除外)。阳离子的氧化性越强,对应金属的金属性越弱。 6、最高价氧化物对应水化物的碱性强弱。碱性越强,对应元素的金属性越强。 7、同周期中,从左向右,随核电荷数的增加,金属性减弱。同主族中,从上到下,随核电荷数的增加,金属性增强。 8、高温下与金属氧化物间的置换反应。金属性强的金属能置换出金属性弱的金属,如铝热反应。 三、非金属性 非金属性是指非金属原子得到电子(形成阴离子)能力的性质。我们常用电子亲合能来表示原子得到电子的难易程度,一般说来,元素的电子亲合能越大,它的非金属性越强。 四、非金属性强弱的判断依据 1、气态氢化物的稳定性。氢化物越稳定,则对应元素的非金属性越强。 2、与H2化合的条件,反应条件越容易。则对应元素的非金属性越强。 3、与盐溶液之间的置换反应。非金属性强的单质能置换出非金属性弱的单质。 4、最高价氧化物对应水化物的酸性强弱(F除外)。酸性越强,对应元素的非金属性越强。 5、同周期中,从左向右,随核电荷数的增加,非金属性增强。同主族中,从上到下,随核电荷数的增加,非金属性减弱。 6、非金属的简单阴离子还原性的强弱。阴离子还原性越强,对应非金属单质的氧化性越弱。 7、与同一可变价金属反应,生成物中金属元素价态的高低。金属元素在该产物中价态越高,则说明该非金属元素的非金属性越强。
重金属元素,一般是指在标准状况下单质密度大于4500kg/m3的金属元素,区别于轻金属元素(如铝、镁)。如铜、铅、锌、铁、钴、镍、锰、镉、汞、钨、钼、金、银等。尽管锰、铜、锌等重金属是生命活动所需要的微量元素,但是大部分重金属如汞、铅、镉等并非生命活动所必须,而且所有重金属超过一定浓度都对人体有毒。现将各元素汇总于此,方便版友们浏览,同时欢迎大家讨论重金属的危害以及检测方法等等。1.微量元素检测之钙 锌 铁http://bbs.instrument.com.cn/shtml/20110108/3071053/2.什么是有害元素?http://bbs.instrument.com.cn/shtml/20110210/3118298/3.重金属的概念http://bbs.instrument.com.cn/shtml/20110206/3115255/4.食品中重金属及有害元素的测定知识点之一:汞http://bbs.instrument.com.cn/shtml/20120612/4089332/5.食品中重金属及有害元素的测定知识点之一:砷http://bbs.instrument.com.cn/shtml/20120608/4082125/6.镉的危害及相关测试方法http://bbs.instrument.com.cn/shtml/20110215/3126702/7.Sb污染,你知多少?http://bbs.instrument.com.cn/shtml/20130509/4723336/8.重金属锑毒性及对人体危害http://bbs.instrument.com.cn/shtml/20130715/4852622/9.硒,有益还是有害?http://bbs.instrument.com.cn/shtml/20130910/4957809/10.关于铅中毒,你了解多少?http://bbs.instrument.com.cn/shtml/20130906/4951630/11.汞中毒的那点事http://bbs.instrument.com.cn/shtml/20130908/4953387/12.关于镉中毒-痛痛病http://bbs.instrument.com.cn/shtml/20130908/4953340/13.关于砷中毒,你必须了解http://bbs.instrument.com.cn/shtml/20130908/4953365/14.硒:重金属里的天然解毒剂http://bbs.instrument.com.cn/shtml/20130910/4957799/
也许人类天生就有将凌乱的知识材料整理、组织、系统化的渴求。元素周期律的发现史充分展现了人们追求真理时不倦的探索精神和坚韧不拔的毅力。十九世纪初,戴维用电解法和热还原法制得了钾、钠、镁、钙、锶、钡、硼和硅,并证明了那种黄绿色的气体是元素氯而不是所谓的“氧化盐酸”。戴维使元素的种类增加了九种。在这前后,法拉第的好友、曾与戴维竞选英国皇家学会主席的武拉斯顿制得了铑和钯;贝采里乌斯发现了铈、硒和钍;库特瓦用浓硫酸处理海藻灰母液,制得了单质碘;本生的老师斯特罗迈耶用烟怠还原氧化镉制得金属镉;首先合成并研究尿素的维勒用金属钾还原无水氯化铝,制得了纯净的金属铝;溴是用氯气氧化制得的。十九世纪上半叶,由于化学分析方法的丰富,人们还发现了钽、锇、铱、锂、钒、镧、铌、钌、铽、铒。及至本生和基尔霍夫创造光谱分析法,在1860年到1863年的四年间人们发现铯、铷、铊、铟四种元素,掀起了元素发现的又一个高潮。 到此,人们已经发现了63种元素。
[em09505]煤的元素组成 -------------------------------------------------------------------------------- 1.碳和氢 碳是煤中最重要的组成元素.碳含量(Cr)随煤化程度的升高而增加.泥炭的Cr为50~60%褐煤为60~77%烟煤为74~92%无烟煤为90~98%.在煤化程度相同的煤中,丝质组的Cr最高,镜质组次之,稳定组最低.氢中煤中第二个重要的组成元素.腐泥煤的氢含量(HR)比腐植煤高,一般在6%以上,有时达11%,这是由于形成腐泥煤的低等生物富含氢.在腐植煤中,稳定组的HR最高,镜质组次之,丝质组最低.随煤化程度升高,它们的HR均逐渐减少. 2.氮 煤中的氮,主要是由成煤植物中的蛋白质转化而来.人们认为煤中的氮通常都是有机氮,其中有一些是杂环形的. 煤中的NR通常约为0.8~1.8%,但也随煤公程度的升高而略有下降.我国弱粘结煤和不粘结烟煤的NR多低于1%,可能是在泥炭化阶段受到不同程度的氧化作用,成煤植物中的蛋白质氧化分解,故NR普遍较低. 3.氧 氧是煤中主要元素之一,氧在煤中存在的总量和形态直接影响着煤的性质煤的元素组成煤的组成以有机质为主体,构成有机高分子的主要是碳、氢、氧、氮等元素。煤中存在的元素有数十种之多,但通常所指的煤的元素组成主要是五种元素、即碳、氢、氧、氮和硫。在煤中含量很少,种类繁多的其他元素,一般不作为煤的元素组成,而只当作煤中伴生元素或微量元素。 一、煤中的碳 一般认为,煤是由带脂肪侧链的大芳环和稠环所组成的。这些稠环的骨架是由碳元素构成的。因此,碳元素是组成煤的有机高分子的最主要元素。同时,煤中还存在着少量的无机碳,主要来自碳酸盐类矿物,如石灰岩和方解石等。碳含量随煤化度的升高而增加。在我国泥炭中干燥无灰基碳含量为55~62%;成为褐煤以后碳含量就增加到60~76.5%;烟煤的碳含量为77~92.7%;一直到高变质的无烟煤,碳含量为88.98%。个别煤化度更高的无烟煤,其碳含量多在90%以上,如北京、四望峰等地的无烟煤,碳含量高达95~98%。因此,整个成煤过程,也可以说是增碳过程。 二、煤中的氢 氢是煤中第二个重要的组成元素。除有机氢外,在煤的矿物质中也含有少量的无机氢。它主要存在于矿物质的结晶水中,如高岭土(Al2032Si022H2O)、石膏(CaS042H20 )等都含有结晶水。在煤的整个变质过程中,随着煤化度的加深,氢含量逐渐减少,煤化度低的煤,氢含量大;煤化度高的煤,氢含量小。总的规律是氢含量随碳含量的增加而降低。尤其在无烟煤阶段就尤为明显。当碳含量由92%增至98%时,氢含量则由2.1%降到1%以下。通常是碳含量在80~86%之间时,氢含量最高。即在烟煤的气煤、气肥煤段,氢含量能高达6.5%。在碳含量为65~80%的褐煤和长焰煤段,氢含量多数小于6%。但变化趋势仍是随着碳含量的增大而氢含量减小。 三、煤中的氧 氧是煤中第三个重要的组成元素。它以有机和无机两种状态存在。有机氧主要存在于含氧官能团,如羧基(COOH),羟基(OH)和甲氧基(OCH3)等中;无机氧主要存在于煤中水分、硅酸盐、碳酸盐、硫酸盐和氧化物中等。煤中有机氧随煤化度的加深而减少,甚至趋于消失。褐煤在干燥无灰基碳含量小于70%时,其氧含量可高达20%以上。烟煤碳含量在85%附近时,氧含量几乎都小于10%。当无烟煤碳含量在92%以上时,其氧含量都降至5%以下。 四、煤中的氮 煤中的氮含量比较少,一般约为0.5~3.0%。氮是煤中唯一的完全以有机状态存在的元素。煤中有机氯化物被认为是比较稳定的杂环和复杂的非环结构的化合物,其原生物可能是动、植物脂肪。植物中的植物碱、叶绿素和其他组织的环状结构中都含有氮,而且相当稳定,在煤化过程中不发生变化,成为煤中保留的氮化物。以蛋白质形态存在的氮,仅在泥炭和褐煤中发现,在烟煤很少,几乎没有发现。煤中氮含量随煤的变质程度的加深而减少。它与氢含量的关系是,随氢含量的增高而增大。 五、煤中的硫 煤中的硫分是有害杂质,它能使钢铁热脆、设备腐蚀、燃烧时生成的二氧化硫(SO2)污染大气,危害动、植物生长及人类健康。所以,硫分含量是评价煤质的重要指标之一。煤中含硫量的多少,似与煤化度的深浅没有明显的关系,无论是变质程度高的煤或变质程度低的煤,都存在着有机硫或多或少的煤。 煤中硫分的多少与成煤时的古地理环境有密切的关系。在内陆环境或滨海三角训平原环境下形成的和在海陆相交替沉积的煤层或浅海相沉积的煤层,煤中的硫含量就比较高,且大部分为有机硫。 根据煤中硫的赋存形态,一般分为有机硫和无机硫两大类。各种形态的硫分的总和称为全硫分。所谓有机硫,是指与煤的有机结构相结合的硫。有机硫主要来自成煤植物中的蛋白质和微生物的蛋白质。煤中无机硫主要来自矿物质中各种含硫化合物,一般又分为硫化物硫和硫酸盐硫两种,有时也有微量的单质硫。硫化物硫主要以黄铁矿为主,其次为白铁矿、磁铁矿((Fe7S8)、闪锌矿(ZnS)、方铅矿(PbS)等。硫酸盐硫主要以石膏(CaSO42H20)为主,也有少量的绿矾 (FeSO47H 20 )等。
内容摘要:经典化学分析仪器是根据各种元素及其化合物的独特化学性质,利用与之有关的化学反应,对物质进行定性或定量分析。定量化学分析按最后的测定方法可分为重量分析法、滴定分析法和气体容量法。下面分别介绍方法的化学原理。(药检所标准物质) 五大元素是特指钢铁中的碳、硫、硅、磷、锰五种元素。元素分析是用来鉴定被测物质由哪些元素(或离子)所组成,这类方法称为定性分析法;用于测定各组分间(各种化学成分)量的关系(通常以百分比表示),称为定量分析法。物质的五大元素分析所采用的化学分析方法可分为经典化学分析和仪器分析两类。前者基本上采用化学方法来达到分析的目的,后者主要采用化学和物理方法(特别是最后的测定阶段常应用物理方法)来获取结果,这类分析方法中有的要应用较为复杂的特定仪器。发展迅速,且各种分析工作绝大部分是应用仪器分析法来完成的,但是经典的化学分析方法仍有其重要意义。有些大型精密仪器测得的结果是相对值,而五大元素分析仪器的校正和校对所需要的标准参考物质一般是用准确的经典化学分析方法测定的。因此,仪器分析法与化学分析法是相辅相成的,很难以一种方法来完全取代另一种。 经典化学分析仪器是根据各种元素及其化合物的独特化学性质,利用与之有关的化学反应,对物质进行定性或定量分析。定量化学分析按最后的测定方法可分为重量分析法、滴定分析法和气体容量法。下面分别介绍方法的化学原理。 一、重量分析法:使被测组分转化为化学组成一定的化合物或单质与试样中的其他组分分离,然后用称重方法测定该组分的含量。 二、滴定分析法:将已知准确浓度的试剂溶液(标准溶液)滴加到被测物质的溶液中,直到所加的试剂与被测物质按化学计量定量反应完为止,化学分析仪器根据所用试剂溶液的体积和浓度计算被测物质的含量。(标准物质网站) 三、气体容量法:通过测量待测气体(或者将待测物质转化成气体形式)被吸收(或发生)的容积来计算待测物质的量。这种方法应用天平滴定管和量气管等作为最终的测量手段。用这种方法测定钢铁等金属物质中总碳量时,应将试样置于高温炉中加热并通氧燃烧,使碳和氧结合成二氧化碳,所得二氧化碳与氧的混合气体收集于量气管中,然后用氢氧化钾吸收其中的二氧化碳,吸收前后体积之差即为二氧化碳的体积,碳硫联测仪由此计量碳的含量。
我家中有塑料瓶包装的碘单质,包装破损然后本人出差19个月,期间室内门窗关闭现室内碘气味太浓,通风已经一个月,环境依然恶劣。请问如何治理?谢谢了!!!!
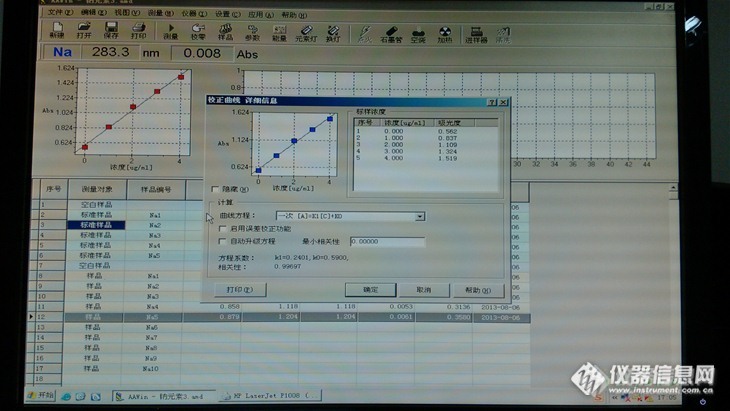
【生活中的仪器分析】活动原创作品:食品安全——月饼卫生大检测月饼中钠元素检测 钠是人体中一种重要无机元素,一般情况下,成人体内钠含量大约为3200(女)~4170(男)mmol,约占体重的0.15%。1、钠是细胞外液中带正电的主要离子,参于水的代谢,保证体内水的平衡,调节体内水分与渗透压。2、维持体内酸和碱的平衡。3、是胰液、胆汁、汗和泪水的组成成分。4、钠对ATP的生产和利用、肌肉运动、心血管功能、能量代谢都有关系,此外,糖代谢、氧的利用也需有钠的参与。5、维持血压正常。6、增强神经肌肉兴奋性。 人体内钠在一般情况下不易缺乏、但在某些情况下,如禁食、少食,膳食钠限制过严而摄入非常低时,或在高温、重体力劳动、过量出汗、肠胃疾病、反复呕吐、腹泻使钠过量排出而丢失时,或某些疾病,如艾迪生病引起肾不能有效保留钠时,胃肠外营养缺钠或低钠时,利尿剂的使用而抑制[size=1
微量元素——铜古人言:“食能排邪而安脏腑,悦神爽志以资气血。”随着社会的快速发展,人们对健康的关注也越来越多。“营养”、“养生”、“保健”等也慢慢成为人们讨论的话题。为此,我们就来认识认识微量元素——铜。 铜在人体内的含量仅次于铁和锌,在人体中具有重要的生理功能,是一种非常重要的生命元素。铜主要有哪些生理功能呢?铜的摄入量是多少才健康呢?各类食品中的铜含量又是多少呢?下面一一为大家解答。 铜的生理功能主要有:(1)参与酶的组成和活化;铜参与30多种酶的组成和活化,如:酪胺酸氧化酶、组胺酸氧化酶、超氧化物歧化酶、细胞色素C氧化酶及某些血浆和结缔组织的单胺氧化酶等。(2)直接参与体内代谢;铜以酶的辅助因子形式参与氧化磷酸化、自由基解毒、黑色素合成、儿茶酚胺代谢和尿酸代谢登代谢过程。(3)参与造血及铁的代谢;铜可促进无机铁变为有机铁,由三价铁变为二价状态,并能促使铁由贮存场所进入骨髓,加速血红蛋白和卟啉合成。(4)参与骨骼形成;铜是氨氧化酶和赖氨酰氧化酶的辅基,这两种酶参与骨基质胶原纤维的合成。(5)参与能量代谢;机体的生物转化、电子传递、氧化还原、组织呼吸都离不开铜。 既然铜有这么多的生理功能,我们是否应该多摄入些铜更有利于健康呢?答案是否定的,物极必反。根据健康人体的正常生理需要,国际卫生组织建议成年人的铜摄入量每日应为0.03mg/千克体重。过量摄入铜不仅不会给我们带来健康,反而会给我们的健康带来威胁。过量摄入铜带来的危害主要有:(1)血红蛋白变性,发生溶血性贫血。(2)胆汁排泄铜的功能紊乱。(3)过多的铜存留在肝脏内,会对肝造成损害,出现慢性、活动性肝炎。(4)过多的铜沉积在脑组织,会引起神经组织病变,出现小脑运动失常和帕金氏综合症。 由于铜在许多食品中的含量普遍较高,日常生活饮食中存在铜摄入过量的风险,因此更应该关注各类食品中铜的含量,常见食品中铜的含量见表1。
1引言由于***的土壤特性含有较高的稀土元素,以及茶叶管理施用肥料,这都茶叶生长带来富集稀土元素的可能。因此,有些茶叶稀土超标是不可避免的。那么超标的茶叶稀土元素测过人们的泡茶,被人们饮用的茶汤又含有多少稀土元素呢?徐清在《浸泡法测茶叶中稀土氧化物的溶出量》一文研究认为从茶叶浸泡温度、时间曲线和浸泡次数曲线,得出稀土氧化物含量随温度的升高、浸泡时间的延长呈上升趋势。茶叶浸泡液中稀土含量远小于茶叶中的稀土总含量,一般都小于总量的20%。石元值等人研究表明采用3次冲泡的总浸出率以乌龙茶粉最高,约为60%;其次是乌龙整茶,约为50%;针形绿茶的稀土浸出率最低,仅为5%。鉴于人们饮用的是茶汤,而从前人的研究来看,茶叶中被人们饮用的稀土总量只是一小部分,本实验旨来通过***岩茶的稀土总量采用水浸泡分析茶汤中稀土总量,并且研究茶叶稀土总量溶出率及16种单质稀土元素的溶出性,为人们茶叶饮用安全提供科学依据,及食品安全研究提供基础数据。据中华全国供销合作总社杭州茶叶研究院副院长杨秀芳介绍,茶叶稀土标准自发布实施以来,就引起很大争议,许多学者和茶叶企业持不同见解。2mg/kg的限量指标是将茶叶与稻谷、玉米、小麦等粮食等量齐观,但茶叶不同于其他植物性食品。茶叶通常被人们用来冲泡饮用,稀土较难溶于水,冲泡的茶汤中只有不到1/4的稀土氧化物会浸出,对人体的安全风险很小,这与粮食直接吃到肚子里是完全不同的。2实验材料与方法2.1实验材料选择***地区的岩茶,先通过茶叶稀土元素含量的测试,然后进行实验茶叶的选择。把茶叶稀土元素氧化物总量超过国家标准限量值2.0mg/kg作为实验材料,数量为10个。2.2主要仪器及试剂Agilent 7700x ICP-MS 电感耦合等离子体质谱仪; ETHOS ONE微波消解仪(Milestone公司产);Al204电子分析天平;粉碎制样机;高纯氩:99.999%;16种稀土元素单标标准物质溶液100ug/mL;测定时将其配制成(0、5、10、15、20、30)ng/mL
求问有谁做过水中单质磷的标曲,空白一般测得吸光度多大,最高点吸光度多少?
单质磷的测定。根据分析步骤加完试剂后,50ml比色管中分成水相与有机相,请问这是怎么了?
判断打磨下来的铁锈中,是否含有单质铁,怎么测定单质铁的含量?