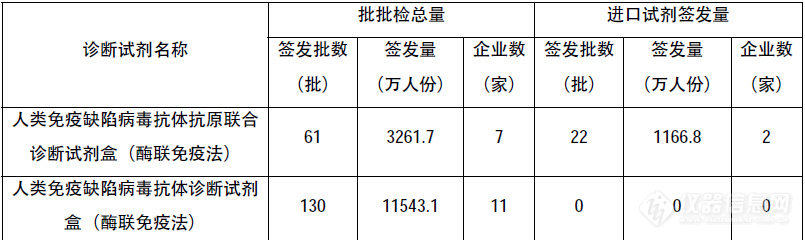
重视产前与新生儿筛查市场,强化诊断力量——访PerkinElmer人类健康高级副总裁Jim Corbett
p 面 span style=" font-family: times new roman " 对日渐兴盛的生命科学领域,PerkinElmer通过收购等战略快速拓展到不同的细分领域中。发展中国市场是PerkinElmer人类健康领域开拓业务的重要战略,在2009年和2012年,PerkinElmer连续在中国收购了一家医学诊断技术供应商和一家分子诊断筛查技术公司,并于2014年在中国开设了首家独立医学实验室。PerkinElmer收购的两家中国诊断公司目前情况如何? 独立医学实验室的运营情况和未来市场是怎样的?针对中国的政策和环境,PerkinElmer还有哪些举措? 仪器信息网编辑就以上问题于美国波士顿的霍普金顿采访了PerkinElmer人类健康高级副总裁Jim Corbett。 /span /p p style=" text-align: center " span style=" font-family: times new roman " strong img title=" sss.jpg" src=" http://img1.17img.cn/17img/images/201604/insimg/7766a76e-a813-4ab5-9c3f-25e0ebaebb84.jpg" / /strong /span /p p style=" text-align: center " span style=" font-family: times new roman " strong PerkinElmer人类健康高级副总裁Jim Corbett /strong /span /p p span style=" font-family: times new roman " span style=" font-family: times new roman font-size: 20px " strong span style=" color: rgb(112, 48, 160) font-family: times new roman " 收购中国两家诊断公司旨在“帮助满足用户的高端和中低端需求” /span /strong /span /span /p p span style=" font-family: times new roman " 细胞遗传、新生儿筛查、产前筛查等一直是PerkinElmer人类健康部门重点投入和发展的领域。中国新波生物(SYM-BIO Lifescience)是向中国各大医院,特别是与传染病相关的领域提供诊断设备的主要供应商,产品主要用于乙肝早期诊断和定量检测。2009年PerkinElmer收购了中国新波生物。三年后PerkinElmer又收购了为血库和临床试验室提供传染性疾病分子诊断筛查技术的中国上海浩源公司(Haoyuan Biotech Co., Ltd.),从而增长了进入血液核酸检测筛查市场的竞争力。 /span /p p span style=" font-family: times new roman " 在问到为何连续收购两家中国诊断公司时,Jim说:“我们希望能够帮助到满足中国客户的高、中、低端需求。中国人口众多,一些地区对医疗的接受程度还在提高中。如果价格过于昂贵的话,并不是每个人都有能力购买。所以我们连续收购了中国本土的两家公司,其技术、合理的价格以及本地化生产的优势,使得PerkinElmer在中国获得了更高的市场占有率。”据了解,PerkinElmer仍然继续将这两家公司的研发中心设在中国,他们认为,只有更了解当地需求才能真正实现服务的专业性。Jim还告诉我们,“中国已经有近400家血库,在当今中国血液筛查市场我们已经占有约35%市场份额。”目前,这两家公司的产品和技术只为中国用户服务。但在今后,很有可能会面对全球市场。 /span /p p span style=" font-family: times new roman " /span span style=" font-size: 20px " strong span style=" color: rgb(112, 48, 160) font-family: times new roman " 新生儿数量庞大,产前和新生儿筛查意识有待提高 /span /strong /span /p p span style=" font-family: times new roman " 继收购了中国的新波生物和上海浩源之后,2016年1月PerkinElmer又收购了瑞典分子诊断公司Vanadis Diagnostics。PerkinElmer希望通过收购引入更多的优良技术和扩展更多市场渠道。Jim表示,如果有合适的机会也将继续收购相关领域的企业。在具有良好增长空间的市场中,如果某公司的技术被PerkinElmer看好,并拥有与PerkinElmer原有业务相关联的新领域,那么它很可能就是PerkinElmer的下一个收购对象。 /span /p p span style=" font-family: times new roman " 此次收购的Vanadis Diagnostics公司正在开发基于游离DNA数据分析的非侵入式产前诊断平台。PerkinElmer将继续拓展其相关的产前和新生儿筛查新技术在中国市场的应用,这也是为中国刚刚开放的二胎政策做准备。Jim说:“中国十三五规划中的二孩计划的确给PerkinElmer带来了更为广阔的市场,同时我们也感到有责任为提高中国和全球新生儿健康质量提供更多的技术力量。” /span /p p span style=" font-family: times new roman " 全球每年新生儿约有1.3亿,中国的新生儿约占到1700万。据PerkinElmer提供的数据,中国平均新生儿检测项目数仅为6项,而在美国这个数字大于30项。Jim说,发展中国家由于医疗方面的限制新生儿缺陷率比较高。在中国的部分地区民众对产前筛查和新生儿筛查的认识还不够,其实这些医学检查非常重要。一些疾病如果提前被检出是可以治疗和治愈的,积极干预对新生儿健康非常有帮助。 /span /p p span style=" font-family: times new roman " 2014年,PerkinElmer与中国国家卫生和计划生育委员会签订了在中国600个乡村推广新生儿筛查的合作。据Jim介绍,这项合作进展的非常顺利,为中国乡村地区新筛检测提供了方便。在项目进行中PerkinElmer还培训了一批优秀的新筛实验室技术人员及医护人员。从样本采集和筛选、验证测试、临床诊断到确诊后治疗、数据监测与管理,这些工作都将在当地的医院中进行,一般从采样到出报告约1-2天的时间,阳性样本会进一步复查和确诊。 /span /p p span style=" font-family: times new roman " /span span style=" font-family: times new roman " span style=" font-family: times new roman font-size: 20px " strong span style=" color: rgb(112, 48, 160) font-family: times new roman font-size: 20px " 中国医学测试将逐渐分担到独立医学实验室 /span /strong /span /span /p p span style=" font-family: times new roman " 在诊断技术方面,PerkinElmer还在中国苏州建立了独立医学实验室,能够为医院和普通患者提供包括新生儿缺陷检测和预防、传染病检测和预防、重大疾病预防等医学检验服务。 /span /p p span style=" font-family: times new roman " Jim说, “该实验室刚刚开设一年多的时间,但已经拥有120个用户,其样品量仍在不断增长,尤其是胎儿宫内检测项目。”据PerkinElmer的数据,目前中国市场98%-99%的医学检验在医院中进行。医院要进行门诊诊断、治疗等工作,为了让更多的人能得到这项服务,有关医学检测的工作非常适合放在医院之外的专业检测实验室中进行。Jim预言,在接下来几年,中国的很多医学测试将逐渐分担到独立医学实验室中。 /span /p p span style=" font-family: times new roman " 在讨论竞争优势时,Jim说:“虽然有些医院会由于检测量太多把常规检测项目交给独立医学实验室,但是我们并不准备争这杯羹。”PerkinElmer的战略是做医院不能做的、专业化、复杂化和个体化的医学检验,如传染病、生殖疾病和孕产妇、胎儿检测。“我们会弥补医院检测项目的不足,更好的让患者受益。” /span /p p style=" text-align: center " img title=" Hopkinton_副本.jpg" src=" http://img1.17img.cn/17img/images/201604/insimg/bca6b12c-95f3-4c55-b808-f1e664e6d9ec.jpg" / /p p style=" text-align: center " strong span style=" font-family: times new roman " 采访地外景照 /span /strong /p p span style=" font-family: times new roman " 在过去的2015年,PerkinElmer人类健康部门给公司带来了60%的营业额 未来,这个数字或将继续增长。“虽然我们在以上谈到的医疗诊断业务增长势头很猛,但对于中国广阔的市场增长程度还是太小了”。Jim表示,现在中国政府和人民越来越重视健康质量,“我们还将继续发展孕产检验、新生儿筛查和传染病预防等技术,并为中国的人民健康提供帮助。” /span /p p style=" text-align: right " 采访编辑:郭浩楠 /p