中国科技网讯 受光子放大和光子在室内被物体和墙壁反弹现象的启发,美国麻省理工学院、哈佛大学、威斯康星大学和莱斯大学的科学家利用先进的光学系统追踪反弹的光子,从而能够“看到”隐藏在屋内拐角处无法直接看到的物体。该技术在未来有望成为减灾和无损生物医学成像的无价之宝。 麻省理工大学研究生奥特克莱斯特·古普塔表示,当光子从墙上反弹并射在室内拐角处暗藏物体上被反射回来时,利用光子环绕和反弹的时间数据,他们能够获取有关物体几何形状的信息。 先进光学系统主要由超快激光器和两维超快扫描照相机组成,它们的工作频率可达每秒万亿次。科学家用它们能在1秒钟内拍摄数10亿张图像,通过分析反弹光子的运动状况“看到”室内拐角处的物体。 超快扫描照相机与其他照相机不同,它是根据光子进入照相机的时间来成像。古普塔说,这样的成像方式为人们提供了了解光子需要多长时间被反弹回来的良好途径。如果在拐角处存在某种物体的话,光子返回得越快则进入超快扫描照相机的时间就越早。他们用超快扫描照相机捕捉和计算光子数,每张图像上有3个或更少的光子。通过快速大量的成像来生产扫描图像,帮助他们决定光子传输的距离(以厘米计算)。当数据收集完成后,他们便能了解拐角处暗藏物体的基本几何形状和3维成像。 新的成像技术具有众多潜在的应用,其中包括在救灾方面的应用。古普塔认为,如果有房屋倒塌,新技术能够帮助救灾人员知道废墟内是否有人存在。事实上,新技术几乎适用于各种各样的灾害现场,特别是需要了解内部具体情况以及角落处是否有人的火灾,火灾的危险程度以及有害环境,由此人们不会冒险派人进入燃烧的房屋内,新技术可以极大地减少救灾人员可能面对的威胁。 此外,新技术十分有望被用作无损或非侵害生物医学成像,帮助医生掌握病人皮下组织的情况。这是科学家目前要着手研究的课题。古普塔表示,根据典型的时间表,研发展示到产品推出,新技术商业化需要5年至10年的时间。(驻美国记者 毛黎) 《科技日报》(2012-08-17 二版)
[back=transparent]质谱成像是以质谱技术为基础的可视化方法,通过质谱离子源直接扫描生物样本,可以在一张组织切片上同时分析数百种分子的空间分布特征,已成为精确解析药物分子及其代谢产物组织空间分布的关键技术之一,[back=transparent]质谱成像[/back]应用于药物ADME的研究。[/back]一般在生活中肾脏是药物排泄的主要器官。但是药物排泄过程的正常与否关系到药效强度、药效维持时间以及毒副作用。所以,这是我们必须要借助一些科学例如高分辨质谱技术来助力药物。近年来,高分辨质谱成像技术的诞生为定位药物组织分布研究提供了全新的技术和思路。本文将主要介绍TransMIT AP-SMALDI 10高分辨率质谱成像系统如何一步步揭秘伊马替尼在小鼠肾脏组织中的空间分布特征。TransMIT AP-SMALDI 10质谱成像系统是目前少有的集高空间分辨率和高质量精度于一体的质谱成像系统。该系统采用常压基质辅助激光解吸电离技术,通过先进的准直光束聚焦实现了5μm的成像分辨率;质谱端搭载Thermo Scientific? Q Exactive?系列质谱仪,保证了离子分析的高质量分辨率和高质量精度。综上所述,研究成功的揭示了伊马替尼在重要排泄器官肾脏中的组织分布特征,同时也获取了组织中各种内源性化合物的空间分布信息,为研究药物分子的累积和排泄机制提供了可靠的科学依据。TransMIT AP-SMALDI 10质谱成像系统集高空间分辨率、高质量分辨率和高质量精度于一身,不仅成为了药代动力学研究的利器,也应用于肿瘤标志物研究、植物次生代谢物研究、药用植物药效成分研究、微生物和单细胞研究等。未来,期待TransMIT AP-SMALDI 10质谱成像系统为我国药物研发人员和各领域科研工作者带来更多的惊喜,加快研究进程,加速成果转化。
《自然》审稿人:“该领域迄今质量最高的顶级工作”2013年06月06日 来源: 科技日报 作者: 吴长锋 最新发现与创新 http://www.stdaily.com/stdaily/pic/attachement/jpg/site2/20130606/011370453619890_change_hzp3622_b.jpg 在绿色入射激光的激发下,处于STM纳腔中的卟啉分子受到高度局域且增强的等离激元光的强烈影响,使得分子的振动指纹信息可以通过拉曼散射光进行高分辨成像。 科技日报合肥6月5日电 (记者吴长锋)记者从中国科学技术大学了解到,该校的科学家们在国际上首次实现亚纳米分辨的单分子光学拉曼成像,将具有化学识别能力的空间成像分辨率提高到前所未有的0.5纳米。国际权威学术期刊《自然》杂志于6月6日在线发表了这项成果。世界著名纳米光子学专家Atkin教授和Raschke教授在同期杂志的《新闻与观点》栏目以《光学光谱探测挺进分子内部》为题撰文评述了这一研究成果。《自然》三位审稿人盛赞这项工作“打破了所有的纪录,是该领域创建以来的最大进展”,“是该领域迄今质量最高的顶级工作,开辟了该领域的一片新天地”,“是一项设计精妙的实验观测与理论模拟相结合的意义重大的工作”。 这一成果是由该校微尺度物质科学国家实验室侯建国院士领衔的单分子科学团队董振超研究小组完成的,博士生张瑞、张尧为论文共同第一作者。 光的频率在散射后会发生变化,而频率的变化情况取决于散射物质的特性,这是物理学上获得诺贝尔奖的著名的“拉曼散射”。“拉曼散射光中包含了丰富的分子振动结构的信息,不同分子的拉曼光谱的谱形特征各不相同,因此,正如通过人的指纹可以识别人的身份一样,拉曼光谱的谱形也就成为科技工作者识别不同分子的‘指纹’光谱。”论文通讯作者之一的董振超教授介绍说,拉曼光谱已经成为物理、化学、材料、生物等领域研究分子结构的重要手段。 上世纪70年代以来,随着表面增强拉曼散射技术,特别是针尖增强拉曼散射(TERS)技术的发展,光谱探测的灵敏度以及拉曼成像的分辨率都有了极大提高。“迄今,科学家们已将TERS测量的最佳空间成像分辨率发展到几个纳米的水平,但这显然还不适合于对单个分子进行化学识别成像。”董振超说。 微尺度实验室单分子科学团队多年来一直致力于自主研制科研装备,发展了将高分辨扫描隧道显微技术与高灵敏光学检测技术融为一体的联用系统。他们利用针尖与衬底之间形成的纳腔等离激元“天线”的宽频、局域与增强特性,通过与入射光激发和分子拉曼光子发射发生双重共振的频谱匹配调控,实现了亚纳米分辨的单个卟啉分子的拉曼光谱成像,使化学识别的分辨率达到前所未有的0.5纳米,可识别分子内部的结构和分子在表面上的吸附构型。 “可以说,在任何需要在分子尺度上对材料的成分和结构进行识别的领域,该项研究成果都有很大的用途。”董振超说,这项研究对了解微观世界,特别是微观催化反应机制、分子纳米器件的微观构造和包括DNA测序在内的高分辨生物分子成像,具有极其重要的科学意义和实用价值,也为研究单分子非线性光学和光化学过程开辟了新的途径。 《科技日报》(2013-06-06 二版)

讲座名称:共聚焦光片成像技术——让荧光成像速度更快,光毒性更低,光操作更容易 主讲老师:易海英 徕卡显微系统生命科学产品应用专家,2014年毕业于华中科技大学生命科学与技术学院,研究生期间的主要研究方向为力学微环境对肿瘤干细胞及其转移的影响,以及力学信号对胚胎干细胞分化及发育的影响,在激光共聚焦和超高分辨率成像领域积累了丰富经验,参与的文章发表在Nature Communications等杂志期刊上。 主要内容:2014年,光片荧光显微技术(light-sheet fluorescence microscopy)被《Nature Methods》评选为年度技术(Method of the Year 2014)。光片(light sheet)技术简单来说即使用一薄层光束从侧面激发荧光样品,随后从样本的上部或下部检测所产生的荧光信号,即检测方向与照射方向相垂直。该技术能够以很高的三维分辨率对不同大小的固定样品或活样品进行三维成像,快速地捕捉细胞或亚细胞水平上的动态变化。其高速、低毒性、低漂白等优势使得光片技术在生命科学领域开始流行起来。光片荧光显微技术的概念其实早在一百多年前就已经被提出来了,但此后很长时间都没有什么进展,直到近年来才活跃起来,其中徕卡创造性地以其成熟的激光扫描共聚焦系统为平台,直接搭载上光片系统,得到既可以实现光片成像,又可以进行常规单光子成像,还可以将光片与单光子、多光子联合使用以实现和开创更为丰富多样的可能性的系统——Leica TCS SP8 DLS!光片荧光显微技术在细胞生物学、发育生物学、微生物学、植物学等多个领域都有广泛的应用,本次Webinar将着重介绍徕卡共聚焦光片系统DLS在生物学研究领域的应用。 举行时间:2016-11-17 14:00 报名链接:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2178http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_669464_2507958_3.jpg手机扫描二维码,报名参会http://exmail.qq.com/cgi-bin/viewfile?type=signature&picid=ZX0717-9QlCeoL%7EVb5UZDdhPeiRO6f&uin=1407973628

讲座名称:共聚焦光片成像技术——让荧光成像速度更快,光毒性更低,光操作更容易 主讲老师:易海英 徕卡显微系统生命科学产品应用专家,2014年毕业于华中科技大学生命科学与技术学院,研究生期间的主要研究方向为力学微环境对肿瘤干细胞及其转移的影响,以及力学信号对胚胎干细胞分化及发育的影响,在激光共聚焦和超高分辨率成像领域积累了丰富经验,参与的文章发表在Nature Communications等杂志期刊上。 主要内容:2014年,光片荧光显微技术(light-sheet fluorescence microscopy)被《Nature Methods》评选为年度技术(Method of the Year 2014)。光片(light sheet)技术简单来说即使用一薄层光束从侧面激发荧光样品,随后从样本的上部或下部检测所产生的荧光信号,即检测方向与照射方向相垂直。该技术能够以很高的三维分辨率对不同大小的固定样品或活样品进行三维成像,快速地捕捉细胞或亚细胞水平上的动态变化。其高速、低毒性、低漂白等优势使得光片技术在生命科学领域开始流行起来。光片荧光显微技术的概念其实早在一百多年前就已经被提出来了,但此后很长时间都没有什么进展,直到近年来才活跃起来,其中徕卡创造性地以其成熟的激光扫描共聚焦系统为平台,直接搭载上光片系统,得到既可以实现光片成像,又可以进行常规单光子成像,还可以将光片与单光子、多光子联合使用以实现和开创更为丰富多样的可能性的系统——Leica TCS SP8 DLS!光片荧光显微技术在细胞生物学、发育生物学、微生物学、植物学等多个领域都有广泛的应用,本次Webinar将着重介绍徕卡共聚焦光片系统DLS在生物学研究领域的应用。 举行时间:2016-11-17 14:00 报名链接:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2178http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_669468_2507958_3.jpg手机扫描二维码,报名参会http://exmail.qq.com/cgi-bin/viewfile?type=signature&picid=ZX0717-9QlCeoL%7EVb5UZDdhPeiRO6f&uin=1407973628

讲座名称:共聚焦光片成像技术——让荧光成像速度更快,光毒性更低,光操作更容易 主讲老师:易海英 徕卡显微系统生命科学产品应用专家,2014年毕业于华中科技大学生命科学与技术学院,研究生期间的主要研究方向为力学微环境对肿瘤干细胞及其转移的影响,以及力学信号对胚胎干细胞分化及发育的影响,在激光共聚焦和超高分辨率成像领域积累了丰富经验,参与的文章发表在Nature Communications等杂志期刊上。 主要内容:2014年,光片荧光显微技术(light-sheet fluorescence microscopy)被《Nature Methods》评选为年度技术(Method of the Year 2014)。光片(light sheet)技术简单来说即使用一薄层光束从侧面激发荧光样品,随后从样本的上部或下部检测所产生的荧光信号,即检测方向与照射方向相垂直。该技术能够以很高的三维分辨率对不同大小的固定样品或活样品进行三维成像,快速地捕捉细胞或亚细胞水平上的动态变化。其高速、低毒性、低漂白等优势使得光片技术在生命科学领域开始流行起来。光片荧光显微技术的概念其实早在一百多年前就已经被提出来了,但此后很长时间都没有什么进展,直到近年来才活跃起来,其中徕卡创造性地以其成熟的激光扫描共聚焦系统为平台,直接搭载上光片系统,得到既可以实现光片成像,又可以进行常规单光子成像,还可以将光片与单光子、多光子联合使用以实现和开创更为丰富多样的可能性的系统——Leica TCS SP8 DLS!光片荧光显微技术在细胞生物学、发育生物学、微生物学、植物学等多个领域都有广泛的应用,本次Webinar将着重介绍徕卡共聚焦光片系统DLS在生物学研究领域的应用。 举行时间:2016-11-17 14:00 报名链接:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2178http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_669462_2507958_3.jpg手机扫描二维码,报名参会http://exmail.qq.com/cgi-bin/viewfile?type=signature&picid=ZX0717-9QlCeoL%7EVb5UZDdhPeiRO6f&uin=1407973628

讲座名称:共聚焦光片成像技术——让荧光成像速度更快,光毒性更低,光操作更容易 主讲老师:易海英 徕卡显微系统生命科学产品应用专家,2014年毕业于华中科技大学生命科学与技术学院,研究生期间的主要研究方向为力学微环境对肿瘤干细胞及其转移的影响,以及力学信号对胚胎干细胞分化及发育的影响,在激光共聚焦和超高分辨率成像领域积累了丰富经验,参与的文章发表在Nature Communications等杂志期刊上。 主要内容:2014年,光片荧光显微技术(light-sheet fluorescence microscopy)被《Nature Methods》评选为年度技术(Method of the Year 2014)。光片(light sheet)技术简单来说即使用一薄层光束从侧面激发荧光样品,随后从样本的上部或下部检测所产生的荧光信号,即检测方向与照射方向相垂直。该技术能够以很高的三维分辨率对不同大小的固定样品或活样品进行三维成像,快速地捕捉细胞或亚细胞水平上的动态变化。其高速、低毒性、低漂白等优势使得光片技术在生命科学领域开始流行起来。光片荧光显微技术的概念其实早在一百多年前就已经被提出来了,但此后很长时间都没有什么进展,直到近年来才活跃起来,其中徕卡创造性地以其成熟的激光扫描共聚焦系统为平台,直接搭载上光片系统,得到既可以实现光片成像,又可以进行常规单光子成像,还可以将光片与单光子、多光子联合使用以实现和开创更为丰富多样的可能性的系统——Leica TCS SP8 DLS!光片荧光显微技术在细胞生物学、发育生物学、微生物学、植物学等多个领域都有广泛的应用,本次Webinar将着重介绍徕卡共聚焦光片系统DLS在生物学研究领域的应用。 举行时间:2016-11-17 14:00 报名链接:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/2178http://ng1.17img.cn/bbsfiles/images/2016/10/201610281713_615330_0_3.jpg手机扫描二维码,报名参会http://exmail.qq.com/cgi-bin/viewfile?type=signature&picid=ZX0717-9QlCeoL%7EVb5UZDdhPeiRO6f&uin=1407973628
欲购买凝胶成像系统、核酸蛋白仪全自动定氮仪,请各位使用者及代理商广泛给予建议,谢谢!
作为实验室里最为常用的仪器之一,成像设备直接为您的论文提供影像。而这些影像质量的好坏,有时候甚至决定着您的论文能否发表。当然,拥有一台好的、运行稳定的设备也是老板和技术主管的心愿。那么,如何从纷繁的市场上选择到一款好的成像设备呢?很多号称“王牌”的设备是否真的能够打满分呢?下面的文章就向您介绍选择成像系统的“四项基本原则”。有了这些原则,您在选择成像仪时自然成竹在胸,无往不胜。原则一:“只选对的,不选贵的”市场上各品牌、各型号的成像仪林林种种,但是从成像原理上可以分成两大类,分别是拍照成像和扫描成像。拍照成像简单说就是样品和相机的相对位置不动,可以进行单次成像或多次成像;而扫描成像则是相机对样品进行局部成像,然后通过样品或相机的移动对整个样品进行成像。拍照成像目前主要采用CCD相机成像,由于可以设置不同的曝光时间,常被用来进行微弱的化学发光及生物发光的成像。而扫描成像则由于精度高、重复性好被广泛用于大型样品以及多通道成像中。可以说,对于大型样品或多通道应用,能选择扫描成像的,尽量不要选择拍照成像。原理搞清楚了,选择起来就简单了。不同的原理导致了不同应用的最佳选择,所以千万不要相信什么“全能王”之类的鬼话,没有任何一款机器可以通吃所有应用领域。下面就实验室最常见的一些应用简单的说明选择的依据:核酸电泳凝胶:一般此类凝胶都采用EB染色、紫外激发,而且凝胶较小。推荐采用一般的凝胶成像设备即可完成。蛋白电泳凝胶:一般此类凝胶采用考染或银染,白光透射成像。对于小型凝胶您可以选择一般的凝胶成像设备,但是对于大型凝胶,特别是双向电泳凝胶,由于CCD拍照成像会有几何扭曲,而且透镜效应也会导致不同区域的信号强度差异,另外CCD拍照也无法保证不同凝胶的成像参数保持一致,因此扫描成像是最好选择。转印膜:这个稍微有些复杂。一般转印膜有比色法显色、同位素、化学发光和荧光等不同检测手段。比色法显色就是产生有颜色的条带或斑点,一般采用普通的凝胶成像设备即可;同位素可以采用压胶片曝光的方法,但是费时、费力而且容易过饱和,比较通用的方法是由FujiFilm在1981年发明的磷屏成像技术,获得信号潜影的磷屏通过激光扫描就可以获取同位素的信号。而化学发光是目前最常用的蛋白印迹的检测手段,无疑,冷CCD拍照成像对这种微弱的光信号是最合适的。荧光是所有这些检测手段中最令人赞叹的和最有前景的。这不仅仅是因为荧光染料具有最宽的动态范围,而且还在于它能够为我们提供多通路的检测途径(同样适用于凝胶,通用电气公司的2D DIGE技术就是采用三种荧光染料标记蛋白而形成多通路检测的)。当然,您可以使用单一荧光检测,这时您对凝胶成像设备的要求就包括了新的激光光源和相应的滤光片。如果您是一个完美主义者,或者您需要对邻近或重叠的目标分子进行成像,那么多通道荧光检测是您的不二之选。这时扫描成像绝对是最佳选择,这样选择不仅仅是因为扫描成像能够带来更高的灵敏度和分辨率,更重要的是,不同通道之间没有几何扭曲,拟合性好。微孔板及其他特殊需求:对于拍照成像而言,由于几何扭曲的问题,对微孔板成像就变得比较复杂了,一般必须一个专用的校正装置才可完成。当然,如果采用扫描成像一般不需要任何额外附件。很多实验室现在都对小动物成像非常感兴趣,然而对小动物进行真的不是一件简单的事,一方面小动物需要进行麻醉和固定;另一方面还需要对信号位置进行三维定位。因此,能同时提供功能、代谢和解剖图像的PET/CT是进行这类成像的最有力的工具。限于篇幅,这部分将不做更多介绍。原则二:实践是检验真理的唯一标准这可不是在上政治课,每个厂家都对自己的产品是“王婆卖瓜,自卖自夸”,经常给您上两个小时课中间还不用休息,什么“专利技术”、“人性化设计”、“生命科学产业大奖”。只有您想不到的,没有他做不到的。可是,这些东西对用户到底有什么意义?就没有几个人说得清了。好用才是硬道理。任凭你说得天花乱坠,拿来我试试,不就什么都清楚了。现在多数厂商都提供Demo机服务,还有技术人员现场答疑解惑,那就请各位上场,真刀真枪的拼一下,谁的性能好,价格优,那我就要谁的。当然,我们的实际测试结果仅仅是针对我们自己的样品和现场demo的机器而已。我们不能据此对相关品牌和相关型号做太多评判。由于具体应用的限制、操作技巧的差异以及可能的仪器状态的区别,我们有可能没有给出公允的评价。但无论如何,这些讯息对我们采购者和使用者来说都是非常重要的。
原标题:英开发出质谱成像技术运用新方法 推动癌组织分析进入数字时代 在癌症研究领域,质谱成像(MSI)是一种非常有前途的技术,但目前该技术的运用还受原始数据预处理、图像精确度及图像识别能力等问题限制。英国帝国理工学院近日发布新闻公报称,该校研究人员开发出一种新方法,可有效解决上述问题。新方法将改变病体组织的检测方式,从而推动癌症组织分析进入数字时代。相关研究成果刊发在最新一期《美国国家科学院院刊》上。 质谱成像技术主要是利用质谱直接扫描生物样品,分析化学成分在细胞或组织中的结构、空间与时间分布信息。这种成像方法不局限于特异的一种或几种蛋白质分子,可在生物组织样本中找到每一种蛋白质分子,并提供它们在组织中空间分布的精确信息。早在几年前,就有科学家提出利用该技术来确定生物组织类型的构想,但却一直没有设计出实用有效的方法。 新方法利用解吸电喷雾电离技术来优化数据预处理,提高图像精确度,并通过提取生物组织特定的分子印记来强化不同生物组织类型的生化特性,以增强图像识别能力。研究人员称,利用新开发的集成生物学信息平台,可将质谱成像技术获得的大量人体组织的具体信息数据,用于构建各种类型的组织数据库。通过多样本分析,并与传统的组织学分析结果进行比较,计算机就可以学习识别不同类型的组织,从而使癌变组织的解析变得相对简单高效。他们将自己设计的工作流程用于直肠结肠癌组织的检测,效果良好。 与标准组织学动辄几周才会得出完整结果的检测手段相比,利用质谱成像技术进行单一检测,仅需几小时即可获得更详尽的信息,不仅会显示组织是否发生癌变,还会显示癌症是哪一种类型和亚型。这些信息对于医生选择最有效的治疗方法十分重要。 研究人员指出,自19世纪后期染色技术用于显示组织结构以来,对组织病理学样本的分析方法鲜有变化。直到今天,染色法依然是医院组织学分析的主流手段,并且变得越来越复杂,耗费也越来越高。而质谱成像技术可能改变组织学的基本范式,科学家将不再根据组织的结构,而是根据它们的化学成分来定义组织类型。将来的检测不再依靠专家的眼睛,而是以海量数据为基础,仅一个检测所得到的信息就远比多个传统组织学检测所得到的更多。他们表示,新研究克服了一些质谱成像技术实际应用所遇到的障碍,将成为创建下一代完全自动化的组织学分析手段的第一步。 总编辑圈点 这是用互联网思维改造传统检测方法的一种尝试,它首先选取了质谱成像方法中最容易快速成像的解吸电喷雾电离技术,实现了数据快速采集;其次,通过将质谱成像得到的结果数字化,建立样本库,提高了数据规模,保证了分析精度;最后,与大数据、云计算等结合,可不断提高检测的准确性,为可靠应用提供保证。新思维已经提高了单个样本的检测精度,我们对它在群体和地区性疾病的检测预防方面也应有所期待。
以下转自科学网:http://paper.sciencenet.cn/htmlpaper/201333013373163128569.shtm?id=28569 单分子成像技术揭示毛细管电泳机理中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室汪海林课题组在高灵敏分析的基础研究方面取得重要进展。他们利用先进的单分子成像技术研究并揭示了独特的等速电泳聚焦和分离的机理,其有关“DNA单分子不连续运动成像揭示场强变化的等速电泳动力学”的研究发表在国际著名化学期刊《美国化学会志》(J. Am. Chem. Soc. 2013, 135, 4644 - 4647)上。带电组分在均一和非均一电场中的运动是电泳应用于化学、物理学、生命科学以及新兴的纳米科技领域的基础。目前,人们对带电组分在均一电场中的运动已经有了充分的认识,而对其在非均一电场中运动的了解却有限。事实上,通过巧妙设计非均一电场,可实现其它技术难以分离的超大DNA分子(80 kb) 的分离和多种分析物的高倍浓缩(可达百万倍)。因而,认识非均一电场中带电组分的运动机制对发展高灵敏的生物分子分析技术和方法具有特殊意义。尽管非均一电场的使用已有百年历史,但对于其形成机理的认识由于存在技术瓶颈而踯躅不前。为了解决这一学科难题,汪海林课题组通过改造全内反射荧光显微成像仪器,首先实现了毛细管电泳-单分子荧光成像分析。在此基础上,以毛细管等速电泳(cITP)作为非均一电场模型,对流经毛细管检测窗口处单个DNA分子实时成像。由于每一幅像记录了单个DNA分子在50 毫秒内的运动轨迹,因此可以计算出每一时间点DNA单分子的运动速度。而DNA运动速度的大小直接与电场强度相关,从而可获得毛细管中电场强度的动态分布信息。通过研究电场强度的实时变化,揭示了电渗流存在下等速电泳的动力学,并首次提出了三区带模型,突破了传统二区带模型的局限。利用这一研究成果,他们发展一种新颖的DNA单分子聚焦方法,实现对极低浓度下随机分布的、难以检测的单分子成像,可检测出4´10-17mol/L DNA分子。在这项研究工作中,汪海林课题组创造性地利用单分子成像技术测定电场强度的分布,提供了一种全新的非均一电场研究方法,这对发展基于电泳分离的高灵敏生物分析技术和方法具有重要意义。该工作得到了国家杰出青年基金、国家973计划、重点实验室等的支持。(来源:中国科学院生态环境研究中心)
[font=&][size=14px]质谱成像(Imaging Mass Spectrometry, IMS)这种最新原位分析技术主要是利用质谱直接扫描生物样品,分析分子在细胞或组织中的“结构、空间与时间分布”信息。其基本流程(以质谱分析生物组织标记物为例)见下: [color=#333333] [/color][/size][/font][img]https://file.jgvogel.cn/134/upload/resources/image/406626.jpeg?x-oss-process=image/resize,w_700,h_700[/img][font=&][size=14px]简单而言,质谱成像技术就是借助于质谱的方法,再配套上专门的质谱成像软件控制下,使用一台通过测定质荷比来分析生物分子的标准分子量的质谱仪来完成的。但是随着这项技术的不断发展,也陆续出现了许多针对各种问题的新技术。[/size][/font][font=&][size=14px]最早的质谱成像技术是基质辅助激光解吸电离(MALDI,matrix assisted laser desorption ionization)质谱分子成像技术,由范德堡大学(Vanderbilt University)的Richard Caprioli等在1997年提出,他们通过将MALDI质谱离子扫描技术与专业图像处理软件结合,直接分析生物组织切片,产生任意指定质荷比(m/z)化合物的二维离子密度图,对组织中化合物的组成、相对丰度及分布情况进行高通量、全面、快速的分析,可通过所获得的潜在的生物标志物的空间分布以及目标组织中候选药物的分布信息,来进行生物标志物的发现和化合物的监控。[/size][/font][font=&][size=14px]正如数字图像包括三个通道:红,绿,蓝一样(单个亮度定义了每个像素的颜色),质谱成像也包含了数以千计的通道,每一个对应于一个特殊的光谱峰值,“你可以通过质谱方法从这些像素中获得任何信号,然后调整图像中所需分子像素的相对亮度,最后,得到一张分子特异性的成像图。”[/size][/font][font=&][size=14px]这种方法可用于小分子代谢物,药物化合物,脂质和蛋白,而且,质谱成像能相对快速的利用许多分子通道,完全无需特殊抗体,下面列出五种先进的质谱成像方法。[/size][/font][font=&][size=14px]1、MALDI质谱分子成像技术[/size][/font][font=&][size=14px]在对组织或生物体进行成像,分析小分子构成的时候,有一个“拦路虎”总是阻碍实验的进程,那就是多肽,这些多肽体积十分大,要想对它们进行分子成像几乎是不可能的,比如,想要研究肿瘤边缘的分子微环境,如果直接成像是不可能获得清晰图像的。[/size][/font][font=&][size=14px]来自范德堡大学的质谱方法专家Richard Caprioli博士因此发明了基质辅助激光解吸电离(MALDI)质谱分子成像技术,这项技术不局限于特异的一种或者几种蛋白质分子,它可在组织切片中找到每一种蛋白质分子,并提供这些蛋白质分子在组织中的空间分布的精确信息,而事先无需知道所检测蛋白的信息。同时,可对这些蛋白质分子含量进行相对定量。[/size][/font][font=&][size=14px]MALDI质谱分子成像是在专门的质谱成像软件控制下,使用一台通过测定质荷比来分析生物分子的标准分子量的质谱仪来完成的。被用来研究的组织首先经过冰冻切片来获得极薄的组织片,接着用基质封闭组织切片并将切片置入质谱仪的靶上。通过计算机屏幕观察样品,利用MALDI系统的质谱成像软件,选择拟成像部分,首先定义图像的尺寸,根据尺寸大小将图像均分为若干点组成的二维点阵,来确定激光点轰击的间距。激光束通过这个光栅图案照射到靶盘上的组织切片,软件控制开始采集质谱数据,在质谱仪中,激光束对组织切片进行连续的扫描,组织样品在激光束的激发下释放出的分子被质谱仪所鉴定从而获得样品上每个点的质荷比(m/z)信息,然后将各个点的分子量信息转化为照片上的像素点。在每个点上,所有质谱数据经平均化处理获得一幅代表该区域内化合物分布情况的完整质谱图。仪器逐步采集组织切片的质谱数据,最后得到具有空间信息的整套组织切片的质谱数据。这样就可以完成对组织样品的“分子成像”。设定m/z的范围,即可确定该组织区域所含生物分子的种类,并选定峰高或者峰面积来代表生物分子的相对丰度。图像中的彩色斑点代表化合物的定位,每个斑点颜色的深浅与激光在每一个点或像素上检测到的信号大小相关。[/size][/font][font=&][size=14px]通过增加单位面积上轰击的激光点数量和像素,研究人员可以获得更多的样品信息,例如,采用4000像素比200像素能够得到更好的样品图像。质谱分子成像技术是一种半定量或相对定量技术,图像上颜色深的部分表明有更多的生物分子聚集在组织的这个部分,然而,不可能据此确定生物分子在组织的不同部位的实际绝对含量。选择组织图像上的任意一个斑点,图像都能够给出一个质谱谱图或者离子谱图,代表在组织的该部位存在这种生物分子,然后,与做指纹图谱类似,像做指纹图谱那样,将样品的离子谱图与已知标准品进行对照,分析差异,从而进行生物标志物的发现和药物作用的监控。[/size][/font][font=&][size=14px]2、电喷雾电离技术[/size][/font][font=&][size=14px]一般质谱成像方法由于体积庞大,重量重,需要冗长的样品准备阶段,因此,并不适用于即时成像(bed side applications),比如,要帮助外科医生进行实时的肿瘤边界成像监控,那么就要寻找新的方法了。[/size][/font][font=&][size=14px]一种称为电喷雾电离技术(desorption electrospray ionization,DESI)的MS成像技术解决了这个问题。DESI技术于2004年首次提出,由于这一方法具有样品无需前处理就可以在常压条件下,从各种载物表面直接分析固相或凝固相样品等优势而得到了迅速的发展。[/size][/font][font=&][size=14px]这种方法的原理是带电液滴蒸发,液滴变小,液滴表面相斥的静电荷密度增大。当液滴蒸发到某一程度,液滴表面的库仑斥力使液滴爆炸。产生的小带电液滴继续此过程。随着液滴的水分子逐渐蒸发,就可获得自由徘徊的质子化和去质子化的蛋白分子DESI与另外一种离子源:SIMS(二次离子质谱)有些相似,只是前者能在大气压下游离化,发明这项技术的普渡大学Cooks博士认为DESI方法其实就是一种抽取方法,即利用快速带电可溶微粒(比如,水或者乙腈acetonitrile)进行离子化,然后冲击样品,获得分析物的方法。[/size][/font][font=&][size=14px]DESI系列产品最大的优势就在于无需样品处理,一般质谱和高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]分析,样品必须经过特殊的分离流程才能够进行分析检测,使得一次样品检测常常需要约一个小时,而DESI系列产品可将固体样品直接送入质谱,溶液被喷射到检测表面,促使样品离子均匀分布。采用这一手段的质谱分离过程,只需3分钟左右即可完成。[/size][/font][font=&][size=14px]3、APIR MALDI/LAESI技术[/size][/font][font=&][size=14px]了解细胞的内部成分是理解健康细胞不同于病变细胞的关键,但是,直到目前为止,唯一的方法是观察单个细胞的内部,然后将其从动物或植物中移除,或者改变细胞的生存环境。但是这么做的话,会使细胞发生变化。科学家还不是很清楚一个细胞在病变时与健康细胞的差别,或者当它们从一个环境移到另一个环境中产生的变化。[/size][/font][font=&][size=14px]来自华盛顿大学Akos Vertes教授希望能从另外一个方面来进行活细胞分析,在他的一项关于活叶样品中初级和次级代谢产物分布的研究中,研究人员发现叶片中积累基质很厚,常导致光谱末端低分子量部分模糊,而且基质辅助激光解析电离(MALDI)质谱分析需要在真空中进行,但是,活体样本在真空中无法存活。[/size][/font][font=&][size=14px]实际上,MALDI质谱分析的原理是将分析物分散在基质分子中并形成晶体,当用激光照射晶体时,由于,基质分子经辐射所吸收的能量,导致能量蓄积并迅速产热,从而使基质晶体升华,致使基质和分析物膨胀并进入[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]。而生物样品也可以直接吸收能量的,比如,2.94mm波长的光能激活水中氢氧键。[/size][/font][font=&][size=14px]因此,Vertes等人想到复合两种技术来解决这一问题。首先他们利用大气压红外线(an atmosphericpressure infrared,APIR)MALDI激光直接激活组织中的水分,使样品气化,就像是组织表面发生了细胞大小的核爆炸,从而获得了离子化微粒,进入质谱中进行分析。但是并不是所有的气化微粒都带电,大部分其实是不带电的,会被APIR MALDI遗漏。[/size][/font][font=&][size=14px]为了捕捉这些中性粒子,Vertes等人采用了第二种方法:[/size][/font][font=&][size=14px]LAESI(laser ablation electrospray ionization,激光烧蚀电喷雾电离),这种方法能捕捉大量带电微滴的微粒,然后重新电离化。通过对整个样品进行处理,复合这两种方法,就能覆盖更多的分子,分析质量更高。[/size][/font][font=&][size=14px]与一般质谱成像过程不同,Verte的方法还在成像中增加了高度,从而实现了3D代谢物成像。这项技术的分辨率是直径10mm,高度30mm,这与生物天然的立体像素相吻合,这样科学家们就可以获得天然构像。[/size][/font][font=&][size=14px]4、二次离子质谱技术[/size][/font][font=&][size=14px]质谱成像技术能将基质辅助激光解吸电离质谱的离子扫描与图像重建技术结合,直接分析生物组织切片,产生任意质荷比(m/z)化合物的二维或三维分布图。其中三维成像图是由获得的质谱数据,通过质谱数据分析处理软件自动标峰,并生成该切片的全部峰值列表文件,然后成像软件读取峰值列表文件,给出每个质荷比在全部质谱图中的命中次数,再根据峰值列表文件对应的点阵坐标绘出该峰的分布图。[/size][/font][font=&][size=14px]但是,一般的质谱成像技术不能对一些携带大分子碎片的化学成分进行成像,来自宾夕法尼亚州州立大学的NicholasWinograd教授改进了一种称为二次离子质谱(SIMS,secondary ion mass spectrometry)的方法,可以对样品进行完整扫描,三维成像。[/size][/font][font=&][size=14px]SIMS早在用于生物学研究之前就已经应用广泛了,比如,分析集成电路(integratedcircuits)中的化学成分,这种质谱技术是表面分析的有利工具,能检测出微小区域内的微量成分,具有能进行杂质深度剖析和各种元素在微区范围内同位素丰度比的测量能力。[/size][/font][font=&][size=14px]这种技术具有几个优点:[/size][/font][font=&][size=14px]速度快(-10,000 spectra per second),亚细胞构造分辨率(-100nm),以及不需要基质。但是另外一方面,不同于MALDI方法,SIMS方面不是一种“软”技术,这种方法只能对小分子成像,因此常常需要进行粉碎。[/size][/font][font=&][size=14px]Winograd教授改进了这一方法,他利用了一种新型SIMS光束(carbon-60磁性球),这种新光束比传统的SIMS光束对物体的化学损伤更小。C60同时撞击样品表面,类似于“一阵爆炸”,这样重复的轰击使得研究人员能深入样品,进行三维分子成像,Winograd教授称这个过程是“分子深度成像”(molecular depth profiling)。[/size][/font][font=&][size=14px]C60的能量与其它的离子束相当,却不到达样品表面以下,这样样品可以连续地被逐层剥离,研究人员就可以得到纵面图形,最终获得三维的分子影像。Winograd教授等人用含有肽的糖溶液将硅的薄片包裹起来并进行SIMS实验,随着薄膜逐渐被C60剥蚀,可以获得糖和肽的稳态信号。最终,薄膜完全剥离后就可以获得硅的信号。如果用其它的射线或原子离子代替C60,粒子束会快速穿过肽膜而无法提供有关生物分子的信息。因此,这种方法具有良好的空间分辨率,能够获得巨噬细胞和星型细胞的细胞特征和分析物的分布情况。[/size][/font][font=&][size=14px]这里还要说到一点,SIMS和上一技术(APIR MALDI/LAESI技术)都可以对三维成像,但两者也有差别,SIMS方法中,采用高能离子轰击样品,逐出分析物离子(二级离子),离子再进入质量分析器。MALDI方法则用激光辐射样品使之离子化,另外SIMS探针可以探测到100nm的深度,能提供纳米级的分辨率,而MALDI可以探测更深,但空间分辨率较低。[/size][/font][font=&][size=14px]5、纳米结构启动质谱技术[/size][/font][font=&][size=14px]质谱在检测生物分子方面有很大潜力,但现有方法仍存在一些缺陷,灵敏度不够高和需要基质分子促使分析对象发生离子化就是其中之二。比如说,需要溶解或者固定在基质上的方法检测代谢物,较易错判,因为这些代谢物与那些基质常常看上去都一样。另外基于固定物基质的系统也不允许研究人员精确的判断出样品中某一分子到底来自于哪儿。[/size][/font][font=&][size=14px]来自斯克利普斯研究院的Gary Siuzdak博士发明了一种称为纳米结构启动质谱(nanostructure-initiator mass spectrometry,NIMS)的新技术,这种技术能以极高的灵敏度分析非常小的区域,从而允许对肽阵列、血液、尿和单个细胞进行分析,而且还能用于组织成像。 [/size][/font][font=&][size=14px]NIMS利用了一种特制的表面,这种多孔硅表面上聚集了一种含氟聚合物,这些分子在受到激光或离子束照射时会猛烈爆发,这种爆发释放出离子化的分析物分子,它们被吸收到表面上,使其能够被检测到。这种方法利用激光或离子束来从纳米尺度的小囊中气化材料,从而克服了一般质谱方法缺少所需的灵敏度和需要基质分子促使分析对象发生离子化的缺陷。 [/size][/font][font=&][size=14px]通过这种方法可以分析很多类型的小分子,比如,脂质,糖类,以及类固醇,虽然每一种分析材料需要的含氟聚合物有少许差别,但是这是一种一步法的方法,比MALDI简单多了——后者需要固定组织,并添加基质。 [/size][/font][font=&][size=14px]由于,含氟聚合物不能很好的离子化,因此,会发生轻微的光谱干扰,而且由于离子化过程是“软性”的——就像MALDI,所以NIMS产生的生物分子是整块离子化,而不是片段离子化。不过这种技术对于完整蛋白的检测灵敏度没有MALDI高[/size][/font]
我们想买一台NMR谱仪,带微成像的.请大家推荐一下.
什么叫"成像无光谱,光谱不成像"简单说就是,,成像光谱仪比以前有么关键性的技术。。 [b]问题补充:[/b]成像光谱仪之前是什么仪??
[b][url=http://www.f-lab.cn/vivo-imaging/msot.html]小动物光声成像系统[/url][/b]MSOT是全球唯一能够提供[b][url=http://www.f-lab.cn/vivo-imaging/msot.html]小动物全身光声成像[/url][/b]能力的小动物实时光声成像系统,用于临床前小动物成像和临床前研究。小动物光声成像系统能够可帮助生物过程和药理物质作用在体内,在深部组织中高分辨率下实时观察。小动物光声成像系统是全球唯一混合光声超声成像技术,OPUS成像技术的同类仪器,也是世界上第一个交叉断层成像系统,提供非平行的用户独立的图像质量,并且具有实时性,可以获得整个动物的横截面影像。这套小动物光声成像系统包含组织形态基于血红蛋白信息产生的光声层析成像,反射式超声成像的集成(r-uct)能力添加互补的解剖信息,特别是低灌注结构。小动物光声成像系统可以调谐激发激光波长,采集光声信号,执行多个波长的光谱分解,这样内源性色基团以及外在探针可有效被区分。小动物光声成像系统工作MSOT探测器小动物置台可以利用各种手持探测器实现小动物的二维和三维自动成像。动物置台可作为内部图像和EIP MSOT成像系统的附件。主要特点包括:自动数据采集三维阶段控制加热的动物垫激光安全联锁装置动物监控摄像机接入导管或生命体征监测[img=小动物光声成像系统]http://www.f-lab.cn/Upload/MOST-invision-imaging.JPG[/img]小动物光声成像系统混合光声超声成像技术(OPUS成像)小动物光声成像系统是全球唯一混合光声超声成像技术,OPUS成像技术的同类仪器,也是世界上第一个交叉操作断层成像系统,提供非平行的用户独立的图像质量,并且具有实时性,可以获得整个动物的横截面影像。这套小动物光声成像系统包含组织形态基于血红蛋白信息产生的光声层析成像,反射式超声成像的集成(r-uct)能力添加互补的解剖信息,特别是低灌注结构。[img=小动物光声成像系统]http://www.f-lab.cn/Upload/Hybrid-OPUS-IMAGING.jpg[/img]初步实验表明,小动物光声成像系统t的升级版将应用在以下需要可视化的任何结构:肿瘤边缘转移胰腺膀胱小动物光声成像系统技术信息单波长的光声成像在10 Hz帧频高达5赫兹帧频的实时频谱分量可视化公司注册的反射式超声计算机断层扫描(r-uct)MSOT IN VISION 512-ECHO成像穿透深度2-4厘米,适合全身小动物成像。横截面的空间平面分辨率:150μM高功率/快速可调谐激光系统(100兆焦耳/ 10毫秒)具有64/128/256/512元件的断层超声探测器阵列全自动图像采集用于光谱和时间分析的数据后处理套件[b][/b]
原创与否转贴“人类天生就可以收集大量的视觉信息。”范德堡大学医学院斯坦福·摩尔生物化学主任与质谱研究中心主任Richard Caprioli表示,“我们喜欢图样、我们喜欢照片,我们通过一张简单的照片可以获得大量的信息。”在Caprioli看来,这一点解释了质谱成像技术(MSI)为什么越来越受欢迎。尤其是这项技术可以帮助组织学家获得原本需要数年才能掌握的专业知识。“它采用的不是颜色维度,而是分子维度。但这个事实并不是那么重要,只要分子维度有足够的信息量。”他说。质谱成像技术就像是免疫组织化学的高通量版本,只是没有抗体而已。质谱成像技术并没有为组织切片事先染上特殊标记,它使用质谱仪一次性挑选并绘制成百上千种分子的空间排列。研究者无需提前知道哪个分子比较重要,就可以利用该技术进行绘制挑选,而且速度很快。“我们的仪器有激光,每秒可以做5000个质谱。”Caprioli表示,这一速度足以在一个小时之内扫描包括数百个病患活组织在内的组织微阵列整体。但是,质谱成像技术的应用也存在明显的障碍。比方说,图像分辨率随着光点尺寸的减小而升高,但却降低了离子材料的产量。该技术并没有初步分离的步骤,因此可能会只抽取丰度最高的分子。而在计算方面,研究人员面临的挑战则是如何对数据进行分析,特别是如何能够真正理解这些数据。但是不管怎么说,研究人员正在使用质谱成像技术进行研究,无论是确定亚细胞分辨率下组织切片中的药物代谢产物,证实疾病的生物标记,还是鉴别肿瘤的边界等等。他们甚至正在将该技术引入临床,至少是接近于临床研究。质谱成像技术的策略那么,什么是质谱成像技术?就像是一张标准的数码照片,数字成像的色彩是通过红绿蓝3个颜色通道叠加而成的,屏幕上每个小像素的颜色都是由这三个颜色的密度所构成的。现在,想象一张拥有成千上万个颜色通道的图片。这就是质谱成像技术,Caprioli说,每个通道都是你想要展示的那个分子种类或质谱峰。研究人员将这些不同的通道互相覆盖,便可以产生一个针对组织分子构成和空间分布的彩色绘图,无论是对蛋白质、神经肽、代谢分子还是脂类等组织——显然脂类的需求正在增加。研究人员为质谱成像技术设计了几十套方案,但正如2012年的综述中所说的(J. Proteomics, 75:4883, 2012),只有三种是最常见的。Caprioli的基质辅助激光解析质谱成像技术(MALDI-MSI)通过紫外线激光光栅扫描一个基质包膜的组织切片来建立图像。该技术的像素大小一般近似于1到10个微米,意味着它可以达到亚细胞分辨率。但由于它需要使用MALDI基质和真空环境,所以MALDI-MSI不适用于活体样本。同时,基质是用来吸收激光能量并转移到样本上去,但是这种基质可能会很难在样本上操作并产生大量的小分子量的电离物,这会遮蔽生成光谱的代谢区域。宾夕法尼亚州立大学埃文·普名誉化学教授Nick Winograd采用了第二种方法——次级离子质谱法(SIMS)。这种方法通过在样品表面喷镀离子束让样品产生电离作用(比方说,英国Ionoptika公司的带电C60分子或氩团簇束),不使用激光。Winograd称,这种方法有两大优点,第一个是分辨率:SIMS得出的像素约有300纳米,而MALDI充其量只有1毫米。另一个是通过分子深度剖析,研究人员可以使用碰撞而成的坑痕去“深挖”这个样本,通过三维立体化绘制其分子组成物。第三种是电喷雾解析电离技术(DESI),这种(非真空的)电离技术通过喷射溶剂,将溶剂覆盖在未经处理的组织表面上,溶解表面的分子。然后再继续往上滴溶剂,以使溶解物溅到质谱仪上,进行电离和分析。(Prosolia公司对DESI技术进行商业化,该公司由该技术的发明者、普度大学化学家R. Graham Cooks共同创办。)DESI、MALDI、SIMS这三种技术以及他们的变体都采用阿姆斯特丹FOM研究所AMOLF学院Ron Heeren所谓的“微探针”模式,分辨率随着像素尺寸减小而升高。这里面的问题是如何从尽可能小的光点中最大化样品的电离作用。但是较小的光电也就意味着检测到的离子会更少,且不要说成像时间会更长了(因为里面的像素会变多)。Heeren更喜欢“显微”模式。这种模式可以用散焦像素更快成像,再加上像素检测器如CCD,可以有效地一次性捕获262144(512x512)个光谱。“这就像个相机。”Heeren解释道,“就是一点,我们制造的是分子闪光照片。”Heeren认为这个“质谱显微镜”的关键是Timepix探测器,这个探测器是CCD和飞行时间质谱分析器的结合。(Heeren共同创立的Omics2Image拥有Timepix探测器)。他解释,大多数质谱检测装置将探测器视为一个大的像素,将所有到达表面的离子碰撞整合为一个单一的信号。Timepix将这个信号分成262000个空间分辨的点,这样在探测到成像表面分子时,它们可以保持并记录自己的空间定位,成像速度非常快。有多快?Heeren说,MALDI-MSI仪器可以产生每秒钟一个像素,达到一微米的分辨率。因此在一个100x100毫米的区域中,要想生成1万个像素需要花费2.7个小时。但使用质量显微镜和Timepix探测器,“我们可以在一秒钟内得到这些信息。”显微镜上还有物理电子学TRIFT SIMS-TOF系统,上面还有一个MALDI技术,Heeren团队最近正在使用这一技术探索骨关节炎下的生理变化。“我们甚至可以证实,在蛋白质水平和脂代谢水平上的生理变化以及软骨矿化,会导致软骨机械强度的流失。”他说。常态MSI与MALDI和SIMS相比,DESI和激光烧蚀电喷雾技术(LAESI,由Protea Biosciences推出的激光技术)这些正常大气压下的电离技术拥有一些特殊的优势。最明显的优势是,他们不需要进行样品处理,在正常空气中操作即可,不需要真空。因此,他们可以用在活体样本上,甚至可以在患者身上进行操作。“我自己这辈子的追求就是:用未处理过的样品就可以进行质谱分析。”这是Cooks几十年来的目标。作为一个研究者,Cooks的工作是提取并测定植物生物碱的结构。很长的一段时间内,研究都非常艰辛,他只提取了一点“不纯的生物碱,而且也没有做出结构方面的进展”。直到他遇到了从斯坦福大学来演讲的Carl Djerassi。他说,Djerassi把他的材料样品带回了实验室,并收集它们的质谱,十天后又把结构发了回来。“这让我相信质谱分析法的强大。”Cooks说,“同时,我也发现提取方法学中存在的局限性。”从那以后,他开始从那些在生物上不怎么好操作的技术限制中脱出来,进行质谱分析,发展了正常气压下的电离技术,特别是DESI。2011年,由Cooks和哈佛医学院Nathalie Agar共同领导的团队,使用电喷雾解析电离质谱技术(DESI-MS)来存储脑肿瘤组织,使用脂类特征检测结果帮助电脑区分不同形式和组织病理学分级的神经胶质瘤(一种脑瘤)。对于这种分析来说,脂类是一个古怪的选择。的确,脂类对于MSI从业者来说就是无奈之举,但他们必须从中获取最大的价值。在标准的细胞分析中,研究人员可以分离细胞提取物,并去掉不想要的部分,这其中往往就包括脂类。但是在MSI及其他原位应用中,研究人员必须知道自己面前摆着的是什么。他们面前摆着的主要是脂类。但幸运的是,脂类不仅丰度高,非常容易电离,而且信息量也很大。“如果你只看脂类的话,它的组织特征比蛋白质要好得多。”伦敦帝国学院医疗质谱部门研究员Zoltán Takáts这样说。最近,Cooks和Agar将这一方法应用到5个正在进行治疗的脑癌病人的32个手术标本当中。该系统通过逐个像素报告了肿瘤的亚型、分级以及癌细胞的部分。Cooks说,这些数据可以让他们的团队在绘制肿瘤边界时找出不同组织病理学级别的各个区域,补充MRI数据。他还强调,他们使用的是“最便宜的”质谱分析仪器,Thermo Fisher公司的单级(与串联相对)低分辨率LTQ离子阱。但Agar也指出,这还是一个研究项目,团队不能实时将这些结果传递给外科医生,他们在波士顿收集样本,但真正成像却是在印第安纳州。自那以后,她的团队在布莱罕妇女医院的AMIGO手术室安装了Bruker公司利用DESI技术的amaZon Speed离子阱,用来进行脑瘤案例的测试。该手术室是医院的影像引导治疗国家中心。Agar说,很快他们会研制出乳腺癌测试,但是团队仍然不能指导外科医生真正操刀。这种方法首先必须经过验证,“这最终会需要经过临床试验进行验证。”简化数据分析最终,要想把MSI推向临床,就必须要跨越质谱仪专家,让真正需要使用它的人掌握这门技术。然而,没有几个临床医生能够掌握MSI技术、数据处理和信息学的精妙,而且更没有人愿意花时间学习了。在Cooks看来,如果这项技术“又娇贵,而且这项质谱技术需要博士才能掌握”的话,就很难进行推广,“它需要全自动,仪器也不能那么娇贵,必须要可靠而且相对简单。”对于典型的组织病理学应用来说,这不是什么问题,因为这个系统可以配置成智能盒子(turnkey boxes),只有通过特定的生物标记才能打开。全球的各大临床实验室已经在常规地使用非成像质谱仪,包括Bruker公司的MALDI BioTyper和Sequenom公司MassARRA
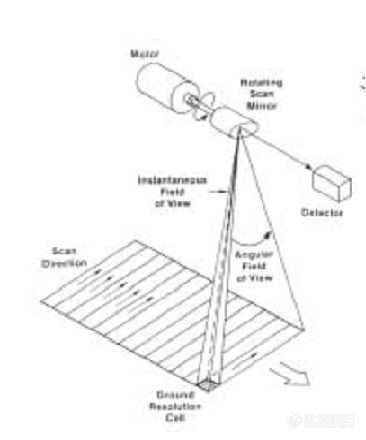
[img=,366,440]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301921039853_1828_5439362_3.png!w366x440.jpg[/img][img=,435,521]https://ng1.17img.cn/bbsfiles/images/2021/11/202111301921116395_6360_5439362_3.png!w435x521.jpg[/img]第一个是扫摆型成像光谱仪 第二个是推扫型成像光谱仪,请问有没有懂他们工作原理的大佬呢?
这款[url=http://www.f-lab.cn/vivo-imaging/micam05.html][b]高速荧光成像系统[/b]micam05[/url]是专业为神经成像,钙成像应用而设计的[b]高速神经成像系统[/b],能够长时间高速成像和记录存储高速图像.高速荧光成像系统micam05具有超低噪音,非常适合[b]染料成像[/b]和[b]钙成像[/b]应用,也可用于[b]荧光蛋白质电压[/b]/钙指示剂,如FRET成像和[b]GCaMP成像,血红蛋白成像[/b]或[b]黄素蛋白成像[/b]。[b]高速荧光成像系统micam05特点[/b]采用USB3.0接口高速数据传输技术,外部设备的兼容性好,适合实时像素输出和额外的模拟输入。用于多种类型科研CCD相机具有多种CMOS相机提供不同的空间/时间分辨率,这些机头可以很容易地切换或更换。(不可能同时使用不同类型的摄像机头)。直接数据存储和USB3.0高速数据传输的长期数据采集新的USB3.0接口允许更快的数据传输处理器的PC可以直接硬盘或SSD数据采集并行,无论内存容量,几分钟到几小时的长期记录都可以。(注意采样率、像素数量、使用的相机数量和PC规格将影响总记录时间)。多达四个摄像头可以很容易地连接和使用在一个完全同步多摄像机的系统中。最多两相机接口板可以连接到micam05处理器。每个接口板配备两个摄像头端口,因此,多达四个的同类型的摄像头可以随时连接。这允许从不同的角度多个荧光波长及三维同时成像。实时光强度监视器/输出可用作标准功能。高速荧光成像系统:[url]http://www.f-lab.cn/vivo-imaging/micam05.html[/url]
[url=http://www.f-lab.cn/vivo-imaging/nvista.html][b]小动物脑部活动神经成像仪[/b]nVista[/url]是美国inscopix公司新一代细胞级活体实时脑动态成像分析系统,具有细胞级分辨率和实时成像功能。小动物脑部活动神经成像仪采用微型显微镜设计,具有领先的钙动态单光子落射荧光成像技术,适合动态神经活动成像。小动物脑部活动神经成像仪nVista特点成千上万的神经元同时成像单细胞分辨率水平具有细胞类型特异性任何小动物脑区均可成像纵向时间达到数月之久针对于自由活动的动物和鸟类[b][img=小动物脑部活动神经成像仪]http://www.f-lab.cn/Upload/nVista-inscopix.JPG[/img][img=小动物脑部活动神经成像仪]http://www.f-lab.cn/Upload/nVista-calcium-imaging.JPG[/img][/b]小动物脑部活动神经成像仪:[url]http://www.f-lab.cn/vivo-imaging/nvista.html[/url][b][/b]
化学发光凝胶成像仪 http://cls.bnu.edu.cn/Portals/1/yqysb/images/凝胶成像/化学发光成像.jpghttp://cls.bnu.edu.cn/Portals/1/yqysb/images/凝胶成像/化学发光成像面板.jpg操作流程:1. 打开电脑;2. 打开成像仪器电源(左后侧)和CCD 电源(黑色),将样品放入工作台;3. 双击桌面上图标,打开Quantity One 软件,或从开始-程序-The Discovery Series/Quantity One进入;4. 从File 下拉菜单栏中选择ChemiDoc XRS…,打开图像采集窗口;5. Select Application 选择相关应用;aUV Transillumination 透射UV:针对DNA EB 胶或其他荧光,打开仪器面板上UV 按钮;bWhite Transillumination 透射白光:针对透光样品如蛋白凝胶,x-光片,把白光灯箱 放在UV工作台上,打开仪器面板上Trans-White;cWhite Epillumination 侧面白光:针对不透光样品或蛋白凝胶,打开仪器面板上Epi-White6. 单击Live/Focus 按钮,激活实时调节功能,此功能有三个上下键按钮:IRIS(光圈),ZOOM(缩放),FOCUS(聚焦),您可在软件上直接调节或在仪器面板上手工调节,调节步骤:a调节IRIS 至合适大小b点ZOOM,将胶适当放大c调节FOCUS,至图像最清晰7. 如果是DNA EB 胶或其他荧光或蛋白凝胶,单击Auto Expose,系统将自动选择曝光时间成像,如不满意,单击Manual Expose,并输入曝光时间(秒),图像满意后保存;8. 如是化学发光,在Select Application 下选择Chemiluminescence 或Chemi Hi Sensitivity(如样品强度较弱),先打开Epi-White 侧面白光,同第5 步调节清楚膜的聚焦状态(如膜上没有可对焦的标记,可用记号笔做个小记号)。然后关闭光源,不打开任何光源,将滤光片位置换到o 位(仪器上方右侧),将光圈Iris 开到最大,选择Auto Expose 自动曝光,或输入ManualExpose 时间,可对化学发光的弱信号进行长时间积累如30min,或单击Live Acquire 进行多桢图象实时采集,在对话框内定义曝光时间长短,采集几桢图象,在采集的多桢图象中选取满意的保存。 化学发光是特别弱的发光,所以曝光可以很长,记得做完化学发光后,把滤光片位置换到原先的位置(I 位)。
皮内光谱成像仪测量胶原蛋白、血红蛋白、黑色素,黑色素在表皮和真皮分布。分级 II级医疗设备 (IIa for EU)★感应技术-皮内分光光度分析法;▲感应器-手持感应器;▲感应区域, 通过标准USB 2.0 线与系统连接。★发射波长 - 440nm 至 960nm ▲解析度: 大于 25 微米★数据显示格式:处理的数据显示为彩色位图,代表选定发色团的相对浓度和分布;参考图像格式-增强的色彩ELM(皮肤镜) 图像,图像进行重复性校正和优化以在图像的光亮和黑暗处有最大的辩色能力;取景器: 彩色取景器模式允许感应器在皮肤上准确定位。
[align=center][b][size=14.0pt]如何用sCMOS相机优化显微成像[/size][/b][/align][align=center][size=11.0pt]会议时间:2020年3月20日10:00[/size][/align][b][size=12.0pt]内容介绍:[/size][/b]本次报告从灵敏度、成像视野、成像速度、成像特性等参数方面全面解读来自牛津仪器Andor的全新背照式、高分辨sCMOS相机。首先,介绍相机的成像结构和数据读出原理;第二,重点介绍Andor背照式SCMOS相机,分析相机参数对显微成像的影响;第三,以单分子成像为例,比较背照式sCMOS相机和EMCCD相机,给出各自成像优势;最后,展示sCMOS相机在具体科研上的应用。[b][size=12.0pt]讲师介绍:[/size][size=11.0pt]王坤:[/size][/b][size=11.0pt]2009[/size][size=11.0pt]年中科院国家纳米科学中心获得凝聚态物理博士,目前在牛津仪器Andor公司担任应用科学家,近十年来一直从事高端显微成像系统的相关科研及应用工作,参与过科技部重大仪器专项、中科院仪器专项、中科院仪器功能开发项目、上海市自然科学基金等科研项目,熟悉各类高端显微成像系统的原理,在各类生物样本成像上具有丰富的经验。[/size][font=等线][size=10.5pt]报名地址:[url]https://www.instrument.com.cn/webinar/meeting_12626.html[/url][/size][/font]
随着MALDI-TOF等生物质谱仪器性能的提升和应用领域的扩大,基于MALDI的质谱成像技术已成为研究肿瘤标志物、药物代谢、脂类分布等方面的有力手段。最新样品前处理方法以及自动化基质喷涂等技术的发展,大大提高了质谱成像技术的灵敏度和分辨率。利用原位酶切技术直接鉴定组织切片上的蛋白质和多肽是IMS当前的热点和关键。体内药物代谢物分布、脂类物质分布以及植物组织的质谱成像等研究逐渐成为新的应用热点。本文较系统地介绍了生物组织质谱成像技术的研究进展。详见附件。http://simg.instrument.com.cn/bbs/images/brow/em09510.gif
凝胶成像定义 凝胶成像即:对DNA或RNA胶 进行切胶、拍照、观察、分析 ,的实验室类仪器, 凝胶成像系统可以应用于分子 量计算,密度扫描,密度定量, PCR定量等生物工程常规研究。凝胶成像应用范围 总体上来说凝胶成像可应用于:凝胶成像系统可以用于:蛋白质、核酸、多肽、氨基酸、多聚氨基酸等其他生物分子的分离纯化结果作定性分析 (1)分子量定量 对于一般常用的DNA胶片,利用分子量定量功能,通过对胶上DNA Marker条带的已知分子量注释,自动生成拟合曲线,并以它衡量得到未知条带的分子量。通过这种方法所得到的结果较肉眼观察估计要准确很多。 (2)密度定量 一般常用的测定DNA(脱氧核糖核酸)和RNA(核糖核酸)浓度的方法是紫外吸收法,但它只能测定样品中的总核苷酸浓度,而不能区分各个长度片段的浓度。利用凝胶成像系统和软件,先将DNA胶片上某一已知其DNA含量的标准条带进行密度标定以后,可以方便的单击其他未知条带,根据与已知条带的密度做比较,可以得到未知DNA的含量。此方法也适用于对PA GE蛋白胶条带的浓度测定。 (3)密度扫描 在分子生物学和生物工程研究中,最常用到的是对蛋白表达产物占整个菌体蛋白的百分含量的计算。传统的方法是利用专用的密度扫描,但利用生物分析软件结合现在实验室常规配备的扫描仪或者直接用白光照射的凝胶成像就能完成此项工作。 (4)PCR定量 PCR定量主要是指,如果PCR实验扩增出来的条带不是一条,那么可以利用软件计算出各个条带占总体条带的相对百分数。就此功能而言,与密度扫描类似,但实际在原理上并不相同。PCR定量是对选定的几条带进行相对密度定量并计算其占总和的百分数,密度扫描时并对选择区域生成纵向扫描曲线图并积分。
rt,北京有哪些机构有薄层色谱成像仪是对外开放的,想去做实验啊
在整个高光谱成像系统中很重要的是各组件的选择以及电控移动台的配合,所选择的各个组件,均需要根据实际使用需要进行优化选择。系统组件选择需要特别考虑所检测的样品的大小,通常情况下,高光谱成像系统的设计针对大小不超过200mm长、200mm宽、100mm高的物体。若使用者对于高光谱成像系统外观及内部结构设计有特别需求,我公司也可根据实际需求,对现有设计进行适当更改,以满足使用者自身高光谱成像系统主要由光源、光谱相机(即高光谱成像仪)、样品移动台等部件组成。高光谱成像系统工作原理(推扫型/推帚型):线光源照射在放置于电控移动台上的待测物体(样品),样品上被线光源照射部分的影像通过镜头被高光谱成像仪捕获,在X轴向上被光谱仪分光,Y轴上直接成像,从而得到一维的影像以及光谱信息,由X-Stage电控移动台带动样品连续运行,从而能够得到连续的一维影像以及光谱信息,所有的数据被计算机软件所记录,可以方便的进行后续分析。
请问各个专业人士,目前采用多光谱荧光活体成像系统哪个产家的会多一些,主要要做老鼠活体成像.谢谢
【序号】:4【作者】:王建宇【题名】:成像光谱仪的光谱响应函数及光谱分辨能力【年、卷、期、起止页码】:成像光谱技术,1991:44-50【全文链接】:期刊 - 数据库搜不到?请帮忙!!
大家好,我是新来的,求助《红外光谱成像仪的原理与应用》论文一篇,万分感谢!
质谱成像原理