现在求购细胞融合实验中用到的电融合仪和双向电泳仪,能提供相关技术服务!尽快回复!陆志勇电话:024-23317080邮件:luzhiyong1982@163.com
根据电泳仪原理、电泳仪功能、电泳仪的使用方法、电泳仪的用途不同可以为:琼脂糖凝胶电泳、毛细管电泳、凝胶电泳、聚丙烯酰胺凝胶电泳、醋酸纤维薄膜电泳、高效毛细管电泳、琼脂糖电泳、SDS-PAGE凝胶电泳、蛋白质电泳、血清蛋白电泳、dna电泳、血红蛋白电泳、蛋白质双向电泳、免疫电泳、等电聚焦电泳、单细胞凝胶电泳、蛋白质凝胶电泳、质粒电泳、对流免疫电泳、变性电泳等。电泳仪分类:1、毛细管电泳仪:其主要部件有0~30kV可调稳压稳流电源,内径小于100μm(常用50~75μm)、长度一般为30~100cm的弹性石英毛细管、电极槽、检测器和进样装置。检测器有紫外/可见分光检测器、激光诱导荧光检测器和电化学检测器,前者最为常用。进样方法有电动法(电迁移)、压力法(正压力、负压力)和虹吸法。成套仪器还配有自动冲洗、自动进样、温度控制、数据采集和处理等部件。 2、常规电泳仪:其组成部件为可调稳压稳流电源,垂直电泳槽,水平电泳槽,电极连接线,支持体【非凝胶性支持体区带电泳(支持体有:①淀粉②纤维素粉③玻璃粉,硅胶等) ;凝胶支持体区带电泳支持体有:①淀粉液②聚丙烯酰胺凝胶③琼脂(糖)凝胶】;陶瓷板,抽水泵,输水管,冰水曹等部件组成。3、其他电泳仪:Tiselius或微量电泳、显微电泳、等电点聚焦电泳技术、等速电泳技术、密度梯度电泳等。是一种非支持体的电泳仪也称为自由电泳法的发展并不迅速,因为其电泳仪构造复杂、体积庞大,操作要求严格,价格昂贵等很少使用。毛细管电泳仪、凝胶电泳仪、垂直电泳仪、微电泳仪、高压电泳仪、水平电泳仪、高效毛细管电泳仪、双向电泳仪、bio rad 电泳仪、脉冲场电泳仪、伯乐电泳仪、北京六一电泳仪上海巴玖均可提供!
各位专业朋友,请问LTQ Orbitrap XL组合型傅里叶变换高分辨质谱能用于双向电泳蛋白点的鉴定吗?先谢谢大家了~~
目 录第一章 实验材料1.1 IPG预制胶条及载体两性电解质1.2 蛋白质定量试剂盒及其试剂1.3 试剂盒及其试剂1.4 化学试剂1.5 蛋白质Marker1.6 染色试剂1.7 注意事项第二章 SDS-PAGE聚丙烯酰胺凝胶电泳2. 1 溶液的配制2. 2 SDS-PAGE凝胶的配制2. 3 操作方法2. 4 注意事项第三章 双向电泳3. 1 溶液配制3. 2 操作步骤3. 3 注意事项附录1 双向电泳完整的操作步骤附录2 聚丙烯酰胺凝胶电泳凝胶的配置附录3 细胞样品的一般处理步骤附录4 组织样品的一般处理步骤附录5 我方主要工作人员通讯录[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=18952]双向电泳实验培训资料[/url]
一、实验原理:2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。这样就可以得到蛋白质等电点和分子量的信息。二、实验步骤:1. 样品的溶解取纯化后的晶体蛋白3.0mg,加入300ul裂解液(1mg蛋白:100ul裂解液)振荡器上振荡10min左右,共处理一个小时。其中每隔10~15分钟振荡一次,然后13200rpm离心15min除杂质,取上清分装,每管70ul,-80℃保存。2. Bradford法测蛋白含量取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。取7个10ml的离心管,首先在5个离心管中按次序加入0ul,5ul,10ul,15ul,20ul 的BSA溶解液,另2管中分别加入2 ul的待测样品溶液,再在每管中加入相应体积的双蒸水(总体积为80ul),然后,各管中分别加入4ml的Bradford液(原来配好的Bradford液使用前需再取需要的剂量过滤一遍方能使用),摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。(测量过程要在一个小时内完成)。3. 双向电泳第一向——IEF(双向电泳中一律使用超纯水)3.1 水化液的制备称取2.0mg 的DTT,用700ul水化液储液溶解后,加入8ul 0.05% 的溴酚兰,3.5ul(0.5%v/v)IPG buffer (pH 3-10)振荡混匀,13200rpm离心15min 除杂质,取上清。在含300ug 蛋白(经验值)的样品溶解液中加入水化液,至终体积为340ul,振荡器上振荡混合,13200rpm离心15min除杂质,取上清。3.2 点样,上胶分两次吸取样品,每次170ul, 按从正极到负极的顺序加入点样槽两侧,再用镊子拨开 Immobiline DryStrip gels (18cm,pH 3-10)胶条,从正极到负极将胶条压入槽中,胶面接触加入的样品。注意:胶条使用前,要在室温中平衡30分钟;加样时,正极要多加样,以防气泡的产生;压胶时不能产生气泡;酸性端对应正极,碱性端对应负极;样品加好后,加同样多的覆盖油(Bio-Rad),两个上样槽必须与底线齐平。3.3 IPG聚焦系统跑胶程序的设定(跑胶温度为20℃)S1 (30v, 12hr, 360vhs, step)S2 (500v, 1hr, 500vhs, step)S3 (1000v, 1hr, 1000vhs, step)S4 (8000v, 0.5hr, 2250vhs, Grad)S5 (8000v, 5hr, 40000vhs, step) 共计44110vhs, 19.5小时其中S1用于泡胀水化胶条,S2和S3用于去小离子,S4和S5用于聚焦3.4 平衡用镊子夹出胶条,超纯水冲洗后,在滤纸上吸干(胶面,即接触样品那一面不能接触滤纸,如果为18cm的胶条要将两头剪去),再以超纯水冲洗,滤纸吸干(再次冲洗过程也可省略),然后用镊子夹住胶条以正极端(即酸性端)向下,负极端(即碱性端)向上,放入用来平衡的试管中(镊子所夹的是碱性端,酸性端留有溴酚兰作为标记),用平衡液A,平衡液B先后平衡15min. 注:平衡时要注意保持胶面始终向上,不能接触平衡管壁。平衡第二次时,在沸水中煮Marker 3min,剪两个同样大小的小纸片,长度与一向胶条的宽度等同,然后吸取煮好的Marker,转入SDS-PAGE胶面上,保持紧密贴合;同样在第二次平衡时,煮5%的琼脂糖10ml.4. 双向电泳第二向——SDS-PAGE4.1 配胶(两根胶条所用剂量)分离胶:(T=8% 80 ml):溶液于真空机中抽气后再加APS和TEMED30 % 丙烯酰胺储液 21.28ml分离胶buffer 20ml 10%APS 220ul TEMED 44 ul双蒸水 38.72ml浓缩胶:(T=4.8% 10ml)30 % 丙烯酰胺储液 1.6ml浓缩胶buffer 2.5ml 10%APS 30ul TEMED 5ul双蒸水 5.9ml4.2 灌胶将玻璃板洗净后,室温晾干,然后,将电泳槽平衡好,玻璃板夹好,再在玻璃板底部涂上凡士林以防漏胶,倒入正丁醇压胶,凝胶后(这时会出现三条线),用注射器吸去正丁醇,超纯水洗两次,再用滤纸除水后,倒入浓缩胶,正丁醇压胶,凝胶后,用注射器吸去正丁醇,超纯水洗两次,再加入超纯水,用保险膜封好。
双向电泳篇 1. 重泡胀后的胶可以不用转移到另一个电泳槽,直接跑 2D 的一向吗? 一般情况下是可以的。但当上样量特别大时,可能会有一部分蛋白质没有被胶条吸收,这样跑完 1D 和 2D 胶后,会有很多横向条纹。所以在这种情况下,最好在重泡胀后,将胶条转移到另外一个电泳漕中进行电泳。 2. 为什么我在等电聚焦前加的矿物油在聚焦后会减少,暴露出了胶条的背面? 这是因为 BioRad 的电泳槽有个盖子。为了固定电泳槽中的胶条,这个盖子上设计了对应的突起,以便压住胶条。由于虹吸作用,这个突起会导引矿物油到相邻的空电泳槽,从而降低有胶条的电泳槽中的矿物油液面。如果由此把胶条暴露在空气中,那对等电聚焦的影响将是毁灭性的。为了防止这个现象的发生,可以在相邻的空电泳槽里,也加入适量( 80 %满)的矿物油。 3. 跑第一向时,为什么要设定一个电流的最大值电压(50 μ A/ 胶)? 电流的平方和功率成正比。电流增大,功率增大,放出的热量也随之增大,就会导致胶条的温度增加。当温度超过 30 摄氏度时,缓冲液里的尿素就容易解离,产生一些极性分子,从而对等电聚焦产生影响。 4. 跑第一向时,为什么刚开始的电压比较低,而后逐渐增高? 刚开始时,体系内的带电小分子比较多(比如无机盐和双极性分子)。所以在这个阶段,电流主要是由这些小分子的移动所产生的。由于这些分子质量小,移动他们不需要很高的电压。当这些小分子移动到他们的目的地时(无机盐移动到极性相反的电极;两性分子移动到对应的 pH 条带),体系内的蛋白质才开始肩负起运载电流的任务,逐渐向所对应的 pH 区域移动。 5. 跑第一向时,为什么会产生一条蓝色的条带,并逐渐向酸性端移动? 蓝色条带是缓冲液中痕量的溴酚蓝被聚焦所产生的。溴酚蓝也是 pH 指示剂,当它移动到酸性区时( pH4 ),颜色会变成黄色。溴酚蓝的这个移动过程大体上发生在极性小分子的聚焦之后,蛋白质大分子聚焦之前。 6. 跑第一向时,为什么电压总达不到预定值? 当上样量比较大时或体系内盐分比较多时,聚焦的电压有可能达不到所设定的数值。 7. 跑第一向时,在电压达到预定值后,电流为什么会降低? 当上样量比较少时,所有蛋白在较短的时间内就移动到所对应的 pH 值区域值,从而变成中性分子。这样,体系的电阻越来越大,在恒定的电压下,电流就会越来越小。 8. 跑第一向时,为什么在两个电极丝附近有气泡产生? 等电聚焦完成后,所有的蛋白质都移动到了相应的 pI 值区域,而成为中心分子。这是加在体系上的电压就开始电解水分子,在阳极产生氧气,在阴极产生氢气。 9. 重泡胀缓冲液(rehydration buffer)中的硫脲的作用是什么,双极性分子的作用是什么? 硫脲的作用是增加蛋白质的溶解性,特别是碱性蛋白的溶解性。双极性分子的作用也是增加蛋白质的溶解性。当蛋白移动到相应的 pH 值后,就变成了中性分子。而不带电荷的蛋白质分子容易聚集,从而降低其在随后的二向胶时的迁移效率,可能会造成竖的脱尾。而硫脲和双极性小分子则会鉴定中性蛋白质之间的相互作用,防止它们的聚集。 10. 怎样估计 2D 胶上蛋白质点的分子量和 pI 值? 可以用 BioRad 生产的 2D 胶标准蛋白来校准。也可以用体系内已知蛋白来做比对。 11. 为什么 2D 胶上的蛋白点有横的和竖的脱尾? 横的脱尾可能是: 1 )一向等电聚焦不完全; 2 )某些蛋白质本身的原因(糖蛋白); 3 )蛋白的丰度太高。竖的脱尾是因为跑二向时,蛋白的溶解度不好。 12. 什么成分会影响 2D 胶的效果? 核酸,盐,去垢剂等等。 13. 2D 胶的上样量应该在什么范围? 上样量和样品有关。样品内蛋白种类多的上样量要大些,这样每个点才有足够的量被检测到。一般的全细胞裂解体系,上样量大概在 100 微克(银染)到 500 微克(考染)之间。 14. 我的蛋白质浓度很低,应该用什么方法来浓缩? 蛋白质的浓缩有很多方法。大致有超滤法,沉淀法和透析法。超滤比较温和,对蛋白质不会有修饰和改变,蛋白的种类一般不会有丢失。它的缺点是总样品的量可能会减少(被膜所吸附)。另外超滤对样品的要求比较高。甘油,去垢剂都会堵塞滤膜,影响超滤的效果。沉淀法比较快速,容易操作,对盐,甘油,去垢剂的耐受性好。缺点是可能会有部分种类的蛋白没有被沉淀下来(丢失)。沉淀法中,又以 TCA 法最为普遍使用。使用 TCA 法时,一定要用冷的纯丙酮清洗蛋白沉淀两次,去处残留的 TCA 和其他沉淀下来的杂质。透析法只使用于量比较大的样品,量小时,操作困难。 透析法可以和超滤法联用。先把样品透析到一个比较干净的环境( 不含盐,甘油,去垢剂或其它杂质,比如碳酸氢氨溶液),然后再进行超滤。
简单的说,电泳仪电源一般可分为两类:精简型和多用型,精简型均为双稳型,而多用型都是三稳(三恒)型。无论有几种稳定功能,电泳仪电源在实际工作时只能稳其中一种参数,至于稳哪一种参数,要看电泳仪电源的设定以及电泳仪的等效负载电阻而定。市面上销售的电泳仪电源,按电压分为高压1500~5000V、中压500~1500V、低压500V以下三种;按电流分为大电流500mA~2000mA、中电流100~500mA、小电流100mA以下三种;按功率分为大功率200~400W、中功率60~200W、小功率60W以下三种。从电压的角度来看,用于核酸(琼脂糖)水平电泳、PCR电泳、DNA回收、印迹转移等实验只需最高电压300V;用于蛋白垂直电泳、种子纯度电泳、醋酸纤维膜电泳等需要使用最高电压600V左右的电泳仪;用于DNA测序(SSR分子标记)、等点聚焦电泳、双向电泳等要求最高电压3000V;用于DNA测序电泳(AFLP分子标记)要求最高电压3800V。电泳仪电源输出的所有参数根据其型号的不同都有一个特定的工作范围,如果实际需要超过这一范围,就应当选择能够满足使用的另外型号的电泳仪电源。因为高、低压电泳仪内部结构特征不同,由于高压电泳仪常附加着多功能,而且高压电泳仪决不能空载运行(容易造成人身伤害内部器件损坏),导致操作上难易程度的不同等。因此,选用合适规格的电泳仪很重要。用户如果需要一台电泳仪电源带几个电泳槽工作时,首先要确定总电流不要超过仪器的最大范围,其次各电泳仪之间是并联的,因而每个电泳仪的电压都是相同的,总电流为各电泳仪电流之和。使用时注意不能超出电泳仪电源额定的范围。
请问,双向电泳的电源电压要求多大。
以前一致用伯乐的蛋白电泳仪,现第一次用六一的工具做了SDS-PAGE胶,上电泳,结果电压加到250v了电流还只有9mA,电泳了很久也没有太大的变化,开始以为是电泳液有问题,重装重配还是这样,终于电泳完了,很丑的结果。为什么会这样呢,在拆胶的时候发现配胶用的胶条还在上面,原来是胶条阻止了电流通过!望大家注意哟!!哈
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=164458]双向电泳操作手册[/url]
在资料中心上传了一本[url=http://www.instrument.com.cn/download/shtml/023576.shtml]《双向电泳简易中文操作手册》[/url],如果大家觉得有用,可以看看。[em61]
双向电泳完整操作步骤(一)第一向等电聚焦1. 从冰箱中取-20℃冷冻保存的水化上样缓冲液(I)(不含DTT,不含Bio-Lyte)一小管(1ml/管),置室温溶解。2. 在小管中加入0.01g DTT, Bio-Lyte 4-6、5-7各2.5ml,充分混匀。3. 从小管中取出400ml水化上样缓冲液,加入100ml样品,充分混匀。4. 从冰箱中取-20℃冷冻保存的IPG预制胶条(17cm pH 4-7),室温中放置10分钟。5. 沿着聚焦盘或水化盘中槽的边缘至左而右线性加入样品。在槽两端各1cm左右不要加样,中间的样品液一定要连贯。注意:不要产生气泡。否则影响到胶条中蛋白质的分布。6. 当所有的蛋白质样品都已经加入到聚焦盘或水化盘中后,用镊子轻轻的去除预制IPG胶条上的保护层。7. 分清胶条的正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极。确保胶条与电极紧密接触。不要使样品溶液弄到胶条背面的塑料支撑膜上,因为这些溶液不会被胶条吸收。同样还要注意不使胶条下面的溶液产生气泡。如果已经产生气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶到胶条以外。8. 在每根胶条上覆盖2-3ml矿物油,防止胶条水化过程中液体的蒸发。需缓慢的加入矿物油,沿着胶条,使矿物油一滴一滴慢慢加在塑料支撑膜上。9. 对好正、负极,盖上盖子。设置等电聚焦程序。10.聚焦结束的胶条。立即进行平衡、第二向SDS-PAGE电泳,否则将胶条置于样品水化盘中,-20℃冰箱保存。(二)第二向SDS-PAGE电泳1. 配制10%的丙烯酰胺凝胶两块。配80ml凝胶溶液,每块凝胶40ml,将溶液分别注入玻璃板夹层中,上部留1cm的空间,用MilliQ水、乙醇或水饱和正丁醇封面,保持胶面平整。聚合30分钟。一般凝胶与上方液体分层后,表明凝胶已基本聚合。 2. 待凝胶凝固后,倒去分离胶表面的MilliQ水、乙醇或水饱和正丁醇,用MilliQ水冲洗。3. 从-20℃冰箱中取出的胶条,先于室温放置10分钟,使其溶解。4. 配制胶条平衡缓冲液I。5.在桌上先放置干的厚滤纸,聚焦好的胶条胶面朝上放在干的厚滤纸上。将另一份厚滤纸用MilliQ水浸湿,挤去多余水分,然后直接置于胶条上,轻轻吸干胶条上的矿物油及多余样品。这可以减少凝胶染色时出现的纵条纹。6. 将胶条转移至溶涨盘中,每个槽一根胶条,在有胶条的槽中加入5ml胶条平衡缓冲液I。将样品水化盘放在水平摇床上缓慢摇晃15分钟。7. 配制胶条平衡缓冲液II。8. 第一次平衡结束后,彻底倒掉或吸掉样品水化盘中的胶条平衡缓冲液I。并用滤纸吸取多余的平衡液(将胶条竖在滤纸上,以免损失蛋白或损坏凝胶表面)。再加入胶条平衡缓冲液II,继续在水平摇床上缓慢摇晃15分钟。9. 用滤纸吸去SDS-PAGE聚丙烯酰胺凝胶上方玻璃板间多余的液体。将处理好的第二向凝胶放在桌面上,长玻璃板在下,短玻璃板朝上,凝胶的顶部对着自己。10.将琼脂糖封胶液进行加热溶解。11.将10×电泳缓冲液,用量筒稀释10倍,成1×电泳缓冲液。赶去缓冲液表面的气泡。12.第二次平衡结束后,彻底倒掉或吸掉样品水化盘中的胶条平衡缓冲液II。并用滤纸吸取多余的平衡液(将胶条竖在滤纸上,以免损失蛋白或损坏凝胶表面)。13.将IPG胶条从样品水化盘中移出,用镊子夹住胶条的一端使胶面完全浸末在1×电泳缓冲液中。然后将胶条胶面朝上放在凝胶的长玻璃板上。其余胶条同样操作。14.将放有胶条的SDS-PAGE凝胶转移到灌胶架上,短玻璃板一面对着自己。在凝胶的上方加入低熔点琼脂糖封胶液。15.用镊子、压舌板或是平头的针头,轻轻地将胶条向下推,使之与聚丙烯酰胺凝胶胶面完全接触。注意不要在胶条下方产生任何气泡。在用镊子、压舌板或平头针头推胶条时,要注意是推动凝胶背面的支撑膜,不要碰到胶面。16.放置5分钟,使低熔点琼脂糖封胶液彻底凝固。17.在低熔点琼脂糖封胶液完全凝固后。将凝胶转移至电泳槽中。18.在电泳槽加入电泳缓冲液后,接通电源,起始时用的低电流(5mA/gel/17cm)或低电压,待样品在完全走出IPG胶条,浓缩成一条线后,再加大电流(或电压)(20-30mA/gel/17cm),待溴酚蓝指示剂达到底部边缘时即可停止电泳。19.电泳结束后,轻轻撬开两层玻璃,取出凝胶,并切角以作记号(戴手套,防止污染胶面)。20.进行染色。
哪位有GE荧光差异双向电泳的荧光标记试剂盒的渠道请站短
请问目前有可以替代进口双向电泳第一向的国产等电聚焦吗?能够使用胶条。
1. 用 PDQuest软件或肉眼比对,找出感兴趣的蛋白点,并做好标记和记录。2. 用 MilliQ水冲洗胶 2 次。3. 用色谱纯甲醇和 MilliQ水冲洗 Ep 管4. 将枪头(200μl)下端剪去,使其内径略小于蛋白斑点的直径,用色谱纯甲醇和MilliQ水冲洗枪头。5. 对准斑点中央小心将蛋白切割下来,放入Ep 管,MilliQ水漂洗 2 次,如胶块 太大,将其切成 1 x 1 mm 的胶片。6. 将切好的点做好标记和记录,置- 80℃ 保存或冻干后- 20℃ 存放。注意事项:1. 尽量避免皮肤和头发的角蛋白的污染,在操作过程中应戴一次性的 PE 手套 (不用乳胶手套)和帽子。2. 不要将胶长期存放于乙酸溶液中。3. Ep 管及染胶的容器必须用甲醇和水充分清洗,尤其应与进行Western blotting 的容器分开,以避免 casein 或 BSA 的污染。
采用P/ACETM MDQ高效毛细管电泳仪,电泳缓冲液为50mmol/L 柠檬酸-20mmol/L 柠檬酸三钠,pH2.6,电泳温度25℃,电压22kV,紫外检测波长196nm。结果表明:肌肉中肌红蛋白和血红蛋白含量测定结果相对标准偏差为0.69% 和0.90%,后加标准品和前加标准品回收率分别为93.26%~97.84%、90.32%~97.46% 和79.89%~84.14%、79.52%~83.65%。该方法简单、快速、对同时测定畜禽肌肉色素物质肌红蛋白和血红蛋白含量准确度良好,是评价肉品质参数的一种值得推广应用的新方法。
我们目前有一品种需检测蛋白纯度,想买一台电泳仪 加光密度扫描仪,或全自动电泳仪,请大家帮忙推荐一下,谢谢!
一、植物组织蛋白质提取方法1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。3、用离心机离心8000rpm40min4℃或11100rpm20min4℃4、提取上清液,样品制备完成。 蛋白质提取液:300ml1、1Mtris-HCl(PH8) 45ml2、甘油(Glycerol)75ml3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g 这种方法针对SDS-PAGE,垂直板电泳! 二、植物组织蛋白质提取方法 三氯醋酸—丙酮沉淀法1、在液氮中研磨叶片2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1小时),然后真空干燥沉淀,备用。4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮。裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少! 三、组织:肠黏膜 目的:WESTERNBLOT检测凋亡相关蛋白的表达 应用TRIPURE提取蛋白质步骤: 含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量) 倒转混匀,置室温10min 离心:12000 g,10min,4度,弃上清 加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量) 振荡,置室温20min 离心: 7500g,5 min,4度,弃上清 重复0.3M盐酸胍/95%乙醇步2次 沉淀中加入100%乙醇 2ml 充分振荡混匀,置室温20min 离心: 7500g,5min,4度,弃上清吹干沉淀1%SDS溶解沉淀 离心:10000g,10min,4度 取上清-20度保存(或可直接用于WESTERN BLOT) 存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。 解决:提蛋白试剂盒,另外组织大小适中,要碎,立即加2X BUFFER,然后煮5-10分钟,效果很好的。
各位,我遇到一个问题,我现在有一个AmBn的复合蛋白,其中A蛋白有m个,B蛋白有n个,老师想让我求出m、n的确切数值。请问用毛细管电泳怎么做?有人做过吗?谢谢了
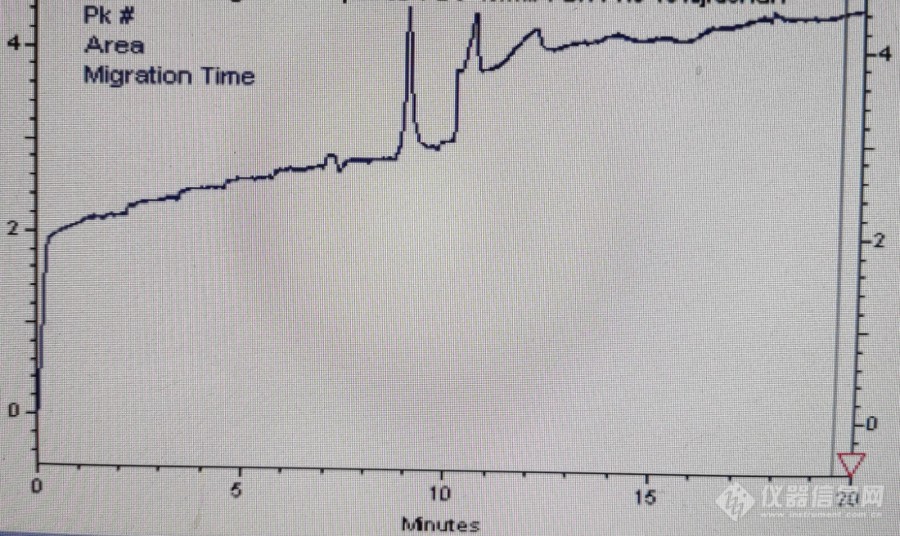
[img=,690,410]https://ng1.17img.cn/bbsfiles/images/2023/04/202304071246366038_1302_5414383_3.jpg!w690x410.jpg[/img]毛细管电泳跑蛋白标准品出了峰之后基线突然升高,求助各位大神是怎么回事。电泳仪是BECKMAN的P/ACE MDQ,用的DAD检测,BGE是10%甲醇+40mM PBS PH8。
[align=center][size=3][b][font=楷体_GB2312]双向电泳常用溶液配方[/font][/b][/size][/align][size=3][b][font=Times New Roman]A. [/font][font=楷体_GB2312]水化[/font][font=Times New Roman]/[/font][font=楷体_GB2312]上样缓冲液[/font][/b][font=Times New Roman](rehydration/sample lysis buffer)[/font][/size][font=楷体_GB2312]水化上样缓冲液[/font][font=楷体_GB2312]([/font][font=Times New Roman]I[/font][font=楷体_GB2312])[/font][font=Times New Roman] [b]1ml[/b][/font][size=3][font=Times New Roman] [/font][/size][table][tr][td=1,1,189][font=Times New Roman][size=3]urea[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]8M [/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]0.48g[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]CHAPS[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]4%[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]40mg[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]DTT[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]50~65mM[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]7~9.8mg[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]or TBP[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]2mM[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]10µ l[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]40% Bio-Lyte [/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]0.2%(w/v)[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]5µ l[/size][/font][/td][/tr][tr][td=1,1,189][size=3][font=Times New Roman]1%[/font][font=楷体_GB2312]溴酚蓝[/font][/size][/td][td=1,1,189][font=Times New Roman][size=3]0.001%[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]1µ l[/size][/font][/td][/tr][tr][td=1,1,189][size=3][font=Times New Roman]MilliQ[/font][font=楷体_GB2312]水[/font][/size][/td][td=1,1,189][size=3][font=Times New Roman] [/font][/size][/td][td=1,1,189][font=Times New Roman][size=3]650µ l[/size][/font][/td][/tr][/table][font=Times New Roman][size=3] [/size][/font][size=3][font=楷体_GB2312]水化上样缓冲液[/font][font=楷体_GB2312]([/font][font=Times New Roman]II[/font][font=楷体_GB2312])[/font][font=Times New Roman] [b]1ml [/b][/font][/size][b][size=3][font=Times New Roman] [/font][/size][/b][table][tr][td=1,1,189][font=Times New Roman][size=3]urea [/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]7M[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]0.42g[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]thiurea[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]2M [/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]0.152g[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]CHAPS[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]4%[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]40mg[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]DTT[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]50~65mM[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]7~9.8mg[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]or TBP[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]2mM[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]10µ l[/size][/font][/td][/tr][tr][td=1,1,189][font=Times New Roman][size=3]40% Bio-Lyte[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]0.2%(w/v)[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]5µ l[/size][/font][/td][/tr][tr][td=1,1,189][size=3][font=Times New Roman]1%[/font][font=楷体_GB2312]溴酚蓝[/font][/size][/td][td=1,1,189][font=Times New Roman][size=3]0.001%[/size][/font][/td][td=1,1,189][font=Times New Roman][size=3]1µ l[/size][/font][/td][/tr][tr][td=1,1,189][size=3][font=Times New Roman]MilliQ[/font][font=楷体_GB2312]水[/font][font=Times New Roman] [/font][/size][/td][td=1,1,189][size=3][font=Times New Roman] [/font][/size][/td][td=1,1,189][size=3][font=Times New Roman]650µ l[/font][/size][/td][/tr][/table][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][font=Times New Roman][size=3]1.[/size] [/font][size=3][font=楷体_GB2312]水化上样缓冲液[/font][font=楷体_GB2312]([/font][font=Times New Roman]I[/font][font=楷体_GB2312])[/font][font=楷体_GB2312]中的尿素浓度可以调高到[/font][font=Times New Roman]9[/font][font=楷体_GB2312]或者[/font][font=Times New Roman]9.8M[/font][font=楷体_GB2312];[/font][font=楷体_GB2312]用[/font][font=Times New Roman]7M Urea[/font][font=楷体_GB2312]和[/font][font=Times New Roman]2M Thoiurea[/font][font=楷体_GB2312]溶解蛋白的能力较单用尿素强。[/font][/size][font=Times New Roman][size=3]2.[/size] [/font][size=3][font=楷体_GB2312]目前常用的去垢剂为[/font][font=Times New Roman]CHAPS[/font][font=楷体_GB2312],也可用[/font][font=Times New Roman]Triton X-100[/font][font=楷体_GB2312]、[/font][font=Times New Roman]NP-40[/font][font=楷体_GB2312]等代替。[/font][/size][font=Times New Roman][size=3]3.[/size] [/font][size=3][font=楷体_GB2312]可以加蛋白质酶的抑制剂和[/font][font=Times New Roman]/[/font][font=楷体_GB2312]核酸酶。[/font][font=Times New Roman] [/font][/size][b][font=Times New Roman][size=3]4.[/size] [/font][/b][size=3][font=楷体_GB2312]还原剂可用[/font][font=Times New Roman]DTT[/font][font=楷体_GB2312]或[/font][font=Times New Roman]TBP[/font][font=楷体_GB2312],分离碱性蛋白时最好用[/font][font=Times New Roman]TBP[/font][font=楷体_GB2312]。[/font][b][font=Times New Roman] [/font][/b][/size][b][size=3]5.[/size] [/b][size=3]5[/size][size=3][font=楷体_GB2312]溴酚蓝作为指示剂,可以监测上样和聚焦过程,如操作熟练,可以不加。[/font][font=Times New Roman].[/font][/size][b][/b]
水化上样( 被动上样)1. 从冰箱中取出 IPG 胶条,室温放置 10min。2. 沿水化盘槽的边缘从左向右线性加入样品,槽两端各 1cm 左右不加样,中间的样品液一定要连贯。注意:不要产生气泡,否则会影响胶条中蛋白质的分布。3. 用镊子轻轻撕去 IPG 胶条上的保护层。注意:碱性端较脆弱,应小心操作。4. 将IPG胶条胶面朝下轻轻置于水化盘中样品溶液上。注意:不要将样品溶液弄到胶条背面,因为这些溶液不会被胶条吸收; 还使胶条下面的溶液产生气泡。如产 生了气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶走。5. 放置 30~45min 大部分样品被胶条吸收,沿着胶条缓慢加入矿物油,每根胶条 约 3ml(17cmIPG),防止胶条水化过程中液体蒸发。6. 置等电聚焦仪于- 20℃水化 11~15h。第一向 等电聚焦1. 将纸电极置于聚焦盘的正负极上,加 ddH2O 5~8μl 润湿。2. 取出水化好的胶条,提起一端将矿物油沥干,胶面朝下,将其置于刚好润湿 的滤纸片上杂交以去除表面上的不溶物。3. 将 IPG 胶条胶面朝下置于聚焦盘中,胶条的正极(标有+)对应于聚焦盘的正 极,确保胶条与电极紧密接触。4. 在每根胶条上覆盖 2- 3ml 矿物油。5. 对好正、负极,盖上盖子。设置等电聚焦程序。6. 聚焦结束的胶条,立即进行平衡、第二向 SDS-PAGE电泳。或将胶条置于样 品水化盘中,- 20℃冰箱保存,电泳前取出胶条, 室温放置10 分钟,使其溶解。
有人做过GPO的蛋白电泳吗?今天做GPO(甘油磷酸氧化酶,MW:75KD)的还原型SDS-PAGE电泳,5%浓缩胶,12%的分离胶,理论上应该可以进行的,但什么都没有染出(其他蛋白都是正常的)。
4. 电泳时虽然小电泳分离效果要好一些,但2小时以上的等待的时间实在是痛苦,因此可以提高电泳至150V,但需要将整个电泳槽放在放满冰水的脸盆里散热,这样跑出来的胶分离效果丝毫不比低电压来的差,关键是时间大大节省,不需1h即可看结果了。5. 做SDS-PAGE的时候,除了蛋白量上样一致,最好体积也一致,这样跑出来的胶各个泳道之间的band能做到一样宽,方便后面的比较,特别是WB。做法就是拿1X的上样缓冲补全要加的样做到体积一致,否则跑出来会有的宽有的窄,特别是上样体积相差较大的。
亲们,跑蛋白电泳时,0.05%的溴酚蓝水溶液怎么配比较好呢,因为它不溶于水。还有SDS溶液应该怎么配,它也不溶于水啊,一搅拌全是泡沫
1.原理等电聚焦凝胶电泳是依据蛋白质分子的静电荷或等电点进行分离的技术,等电聚焦中,蛋白质分子在含有载体两性电解质形成的一个连续而稳定的线性pH梯度中电泳。载体两性电解质是脂肪族多氨基多羧酸,在电场中形成正极为酸性,负极为碱性的连续的pH梯度。蛋白质分子在偏离其等电点的pH条件下带有电荷,因此可以在电场中移动;当蛋白质迁移至其等电点位置时,其静电荷数为零,在电场中不再移动,据此将蛋白质分离。 等电聚焦中,只有在凝胶两端给以高电压时,才能获得较好的蛋白质条带分辨率,这就需要非常有效的凝胶冷却系统(否则会导致烧胶),即凝胶同期周围液体之间的热传递效率要高。由于平板胶热传递能力高,并可方便的同时比较多种蛋白质样品,所以平板胶用在等电聚焦上的居多。由于等电聚焦对蛋白质的电荷差异非常敏感,若要好的重复性,制备蛋白样品时一定要小心,要避免任何对蛋白质化学组成和结构的修饰。另外,蛋白质-脂类、蛋白质-蛋白质相互作用可引起电荷改变,进而导致等电点迁移或纹理现象。除非特殊需要研究蛋白质-蛋白质相互作用或者必须保持蛋白质的生物学功能,等电聚焦通常在含有尿素的变性凝胶系统中进行。使用非离子去垢剂也可以提高分辨率。 2.主要仪器、试剂仪器:微型电泳系统、电源、注射器、固定和染色用容器 试剂:丙稀酰胺、双-丙稀酰胺、载体两性电解质、尿素、过硫酸胺、TEMED、TritonX-100、2-巯基乙醇、溴酚蓝、磷酸、氢氧化钠、氯化钾、三氯乙酸、考马斯亮蓝、甲醇、乙酸。 储存液:1)30%(w/v)丙稀酰胺,1%(w/v)双-丙稀酰胺;2)20%Triton X100;3)10%三氯乙酸;4)1%三氯乙酸;5)1%溴酚蓝;6)考马斯亮蓝染色液;7)考马斯亮蓝脱色液;
如题!我们想买一台电泳仪,想问一下可以做什么具体项目,除了蛋白质/多肽检测之外
蛋白PAGE电泳后如何回收?把胶切割后装在透析袋中电洗脱的具体步骤是什么?如果不要电洗脱能采用什么方式?
[摘要] 质谱对于现代蛋白质化学研究是一项重要的技术。也可用于蛋白组分析,在同一时间监控上千种蛋白的表达情况。首先蛋白质混合物可以用双向凝胶电泳分开,再用质谱及随后的蛋白质数据库检索对单个蛋白进行鉴定和分析。最近几年,质谱领域取得了令人鼓舞的进展,使得全自动、高通量的蛋白检测成为可能。质谱也可以用来分析蛋白的转录后调节以及研究蛋白质复合体。本文将介绍目前蛋白组研究中质谱方法的应用并对其优缺点进行讨论。关键词: 质谱;二维电泳(2-DE);蛋白组分析MALDI-TOF1 前 言蛋白组学是研究生物特定组织或细胞内表达的所有蛋白质成分,蛋白质组的一门学科。蛋白组分析一般是用双向凝胶电泳(2-DE),质谱(MS)以及数据检索来完成。2-DE要回顾到20世纪70年代初[1],但是用质谱技术对蛋白质进行鉴定和分析是在近十年内才成为可能。其中最重要的一个原因是新的软离子技术即基质辅助激光解析电离(MALDI)[2]和电喷雾电离(ESI)[3,4]技术的发展和应用,以及样本制备技术和质谱仪的发展等。从数据库中获得成指数上升的序列信息也促进了质谱技术的发展。跟转录组学中的全自动DNA微阵列技术相比,蛋白组分析需要更多的手工操作,尤其在2-DE上会出现很多问题[5,6]。尽管存在很多困难,蛋白组学的重要性还是公认的。DNA微阵列技术是建立在对mRNA稳定水平的检测上,然而蛋白组学研究的对象是细胞中最活跃的因子——蛋白质。最近有研究证明,mRNA的表达和蛋白的水平并非具有相关性[7,8]。蛋白质有转录后修饰过程,并会以不同的形式出现。而这些修饰过程是相应的DNA测序技术所不能预测的。质谱技术在蛋白质修饰分析过程中具有重要的作用。2 质谱对蛋白质的检测质谱仪是由离子源,质量分析,离子检测器,以及数据检索等单元组成。首先,被分析的分子在离子源中被离子化,然后在质量分析器里根据不同的质荷比分开,再对分开的离子进行检测。随着MALDI和EIS的出现,质谱技术已经广泛用来分析蛋白质。质量分析器有很多种,最常用的方法是将飞行时间检测器(TOF)与MALDI或三级四级串联质谱仪联用,或者将四级杆-TOF,离子阱等连接到ESI上。蛋白组分析中,可以用两种不同的方法检测电泳分离后的单个蛋白质。最简单的方法叫做肽指纹谱测定(PMF)[9~13]。这个方法是用特殊的酶对2-DE分离后的蛋白质点进行降解,产生的肽从凝胶中分离出来后再用质谱分析和检测肽的分子量。数据库检测能够产生所有蛋白质理论上的PMF,把它们和质谱分析所获得的肽片进行比较就可以得出结果。第二种方法是在质谱仪中把凝胶分离后的肽分解成片段,产生局部的氨基酸序列(序列标签)。那么就可以用分子量或者序列信息进行数据库检索[14,15]。PMF一般用MALDI-TOF来实现,序列标签可以用串联质谱技术MS-MS进行检测[16~18]。用质谱检测蛋白的灵敏性可以精确到飞摩的水平,甚至已有报道其精确度可以达到阿摩水平[19]。3 用MALDI-TOF进行肽指纹谱分析凝胶分离后的蛋白质鉴定以及肽指纹谱分析是目前质谱实验室常规使用的方法。在进行MALDI分析之前需要最优化的凝胶上消化[20~22]和脱盐过程。胰岛素是最常用的凝胶消化酶,因为它在赖氨酸和精氨酸位点能够特异性切割蛋白质,产生分子量在600~2500Da之间的小分子肽,并能够从凝胶上有效的分离出来。MALDI-TOF是质谱技术中相对简单并很容易使用的一种方式,对样本中的盐和其他污染物有很高的耐受性,这点优于ESI。提取的肽片混合物中较小的片段可以直接沉积在靶板上做PMF分析,剩下的样本可以储存起来作为以后的ESI-MS分析。如果经凝胶分离后所有的肽全用来做MALDI分析,那么样本经脱盐以后将会取得更好的结果。脱盐的过程可以用商品化的试剂盒ZipTip(Millipore),或者在凝胶电泳仪的末端放置一个小的逆向塑料柱来实现[23,24]。PMF中非常重要的一个因素就是质谱测量分子量的准确度[25]。现代的MALDI-TOF仪都具有延迟取样反射器装置,用它们检测的肽段分子量可以精确到10~30ppm。这样的精确度使得4~5个肽段足以清楚的鉴定蛋白质的分子量。MALDI产生的大多数都是单电荷离子,所以它的图谱很容易解释。4 肽质指纹谱分析的自动化为了实现高通量蛋白检测,样本准备,质谱检测,资料分析和数据检索必须实现自动化操作。目前有些实验室用机器人对蛋白质进行自动化取点,凝胶上消化,样本脱盐以及对MALDI平板进行定点测定等。而且,现代化的MALDI-TOF仪完全能够让MALDI检测自动化。资料分析和数据检索过程同样可以自动化。在进行蛋白组分析时,如果在凝胶上不用单个分离就可以对所有蛋白质进行鉴定将是非常具有诱惑力的。为此,研究人员做了很多努力,由Hochestrasser及其同事建立了一套称作分子探测术的方法(molecular scanner)[26,27]。它是将整个2-DE胶上蛋白质样本同时酶解,并将酶解片段一起原位转移至另一张膜上,再直接用MALDI- TOF 质谱对膜上样本进行整体扫描,为实现蛋白质组学研究的自动化、规模化以及临床应用提供了一个崭新的思路和方法。这种思路的优点是显而易见的,不过按照目前的方法,要普及此种技术主要的难点是,质谱扫描一张图谱所需的时间过长,如用0.4mm的精度扫描一张4cm×4cm的膜需55个小时,这就意味着一张16cm×16cm的常用膜的扫描,至少需要36天不间断的工作和大约40G的磁盘空间存储如此庞大的原始数据。5 用ESI-MS/MS的方法创建序列标签只有当被消化的蛋白存在于已有的蛋白或基因组数据库中,并且能从MALDI分析器中得到四五个肽片的数据才能成功进行。如果在EST数据库中只有目的蛋白的部分序列,那么就需要知道肽片的序列信息。创建序列标签的优势在于,用肽的分子量和序列作为数据库检索对象比只用分子量作为检索对象具有更高的特异性。有了序列标签信息后,也可以用EST数据库进行检索[28]。通常来自于一个肽上的序列标签就足以鉴定蛋白质。同MALDI相比,纳升-ESI-MS/MS费时费力,而且在做ESI分析之前必须对样本进行脱盐处理。这些问题可以通过ESI-MS与HPLC联用得到解决。做ESI分析对样本浓度很敏感,用现代化的纳升-HPLC方法可以提供很高的局部肽片凝聚物,分离后的样本可以直接用于质谱分析,而不需要再分解。当分析混合物的时候,在质谱之前做LC分离尤其重要,因为它使得数据依赖的实验(DDE)成为可能,在DDE中,所有的离子都进入检测器进行测量,如果从HPLC到质谱之间出现一个峰的话,软件将自动从质谱转换到MS/MS模式并对产生的离子进行扫描。跟纳升-ESI相比,用这个方法可以从一份标本产生更多的MS/MS数据。Yates等已经详细叙述了如何进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS全自动蛋白检测的策略[29]。
安捷伦收购电泳仪制造商Lab901美国时间2011年2月28日,安捷伦科技宣布收购领先的电泳设备及耗材供应商Lab901公司。财务及收购其他条款尚未披露。Lab901公司总部位于英国爱丁堡,开发和生产用于DNA、RNA和蛋白质研究的电泳产品,其主要产品是TapeStation台式电泳仪和ScreenTape及以塑料为基础的消耗品和相关试剂。【详细】