登顶Nature正刊!日本电子冷冻电镜助力国内研究团队揭示新型CRISPR-Cas
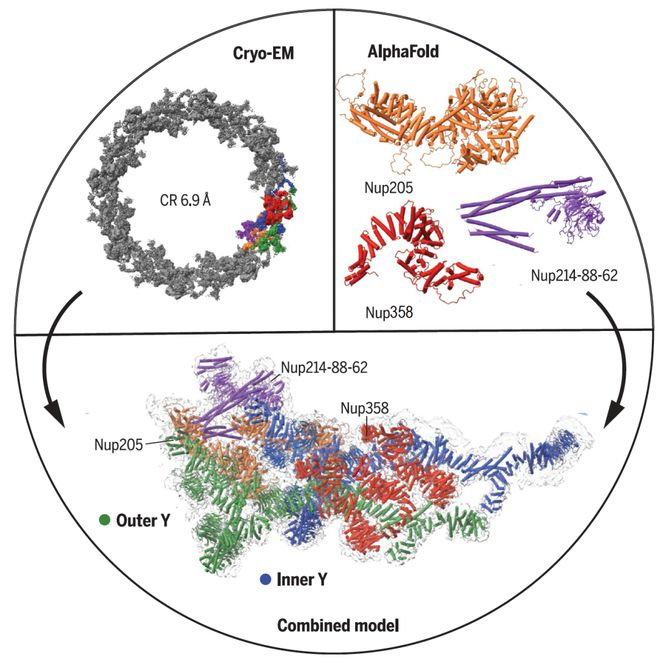
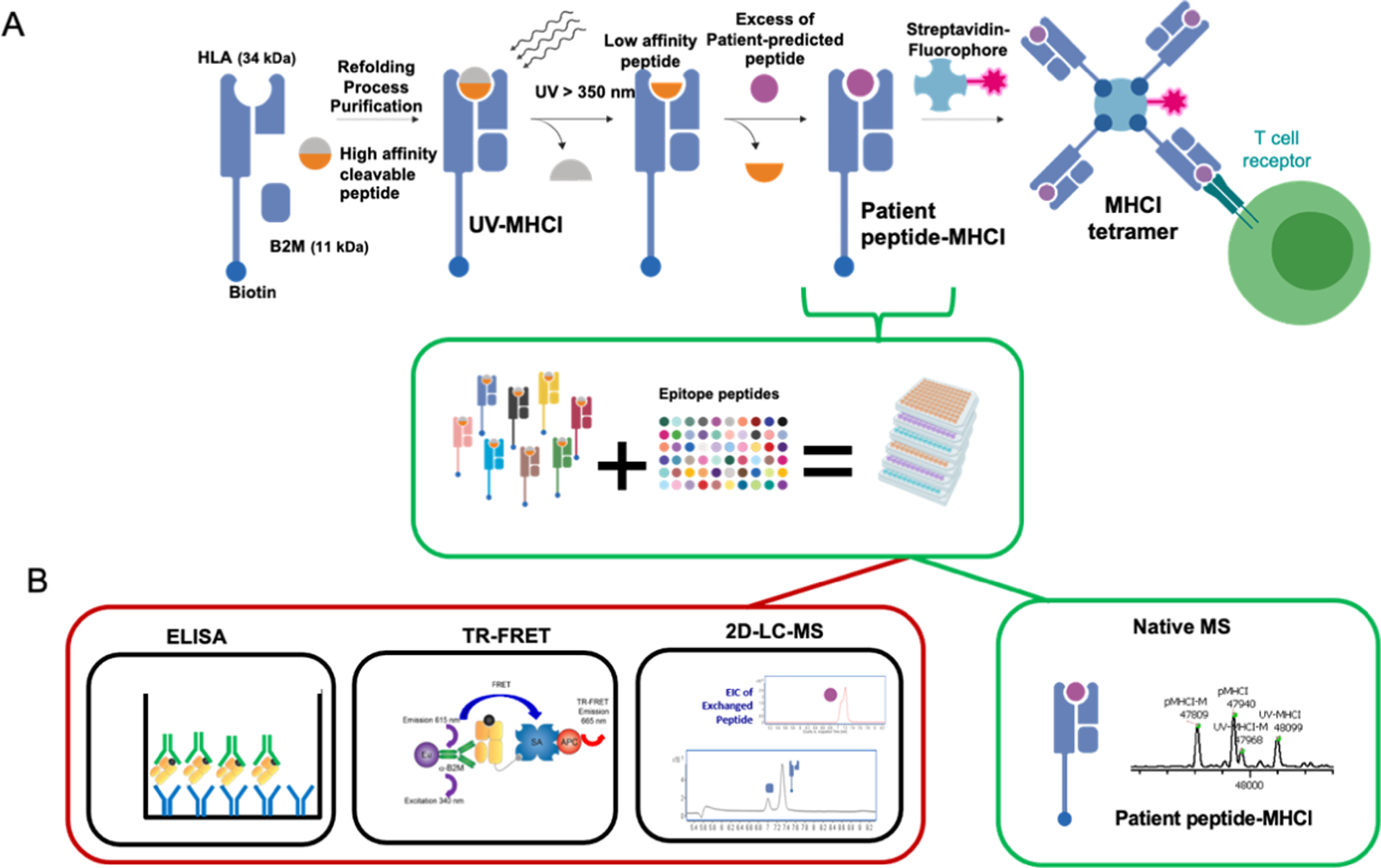
2024年8月14日,天津医科大学张恒团队与中国科学院武汉病毒研究所邓增钦团队合作在学术期刊Nature发表了题为"Structural basis for the activity of the type VII CRISPR-Cas system"的研究论文。该工作证实VII型CRISPR-Cas系统能够特异性识别细胞内转录本并靶向敲低基因表达,能够帮助宿主菌抵抗噬菌体的感染,是具有适应性免疫功能的CRISPR系统;进一步解析了该系统组装、识别和切割底物RNA的结构基础。CRISPR-Cas是广泛存在于细菌和古菌中的抵抗病毒入侵的适应性免疫系统。目前,对I-VI型CRISPR-Cas系统的功能和机制研究比较深入。然而,对于近期发现的Ⅶ型CRISPR-Cas系统的生物学功能和分子机理尚不清楚。合作团队使用JEOL在国内安装的第一台JEOL CRYOARM 300冷冻电镜解析了VII型系统7种不同功能状态下的高分辨电镜结构并结合生化分析(图1)。该电镜具备先进的样品仓设计,能够在更换样品时保持高真空状态,有效减少冰污染,确保了样品结构的完整性和解析精度。此外,电镜对镜筒内置的Omega能量过滤器进行了特殊优化系统优化,使电子束在长时间的成像过程中保持稳定,从而获得更为清晰和稳定的图像。研究人员从实验结果中发现:1)VII型系统复合体由7个Cas7蛋白、1个Cas5蛋白、4个Cas14蛋白以及crRNA和底物RNA构成;2)VII型系统通过一种独特的核酸酶Cas14四聚体特异性切割底物RNA;3)底物靶序列两侧的序列 (protospacer flanking sequence, PFS) 的存在往往限制了CRISPR工具对靶点的选择性,VII型系统的3'-PFS对底物切割无影响,而5'-PFS则可以通过增加VII系统复合体中Cas14的结合位点影响对RNA底物的切割。综上,该研究首次对Ⅶ型CRISPR-Cas系统的功能进行了表征,深入阐明了这一系统独特的组装机制、底物RNA识别和切割模式,为基于VII型CRISPR-Cas系统的RNA操控工具的设计与开发奠定了基础。图1 VII型CRISPR–Cas复合体底物结合状态I的密度图(a)和结构模型(b) 中科院武汉病毒所安装的CRYOARM 300 (JEM-Z300FSC)为JEOL在国内安装的第一台300 kV冷冻电镜,其配置了冷场发射电子枪、欧米茄能量过滤器和无孔相位板。该电镜已经投入运行约4年,目前产出的数据已经相继发表在包括Nature, Nature Microbiology, Cell Research, Nucleic Acids Research, Nature Communications等期刊上。1. Yu, G., Wang, X., Zhang, Y. et al. Structure and function of a bacterial type III-E CRISPR–Cas7-11 complex. Nat Microbiol 7, 2078–2088 (2022). https://doi.org/10.1038/s41564-022-01256-z2. Yang, S., Wang, Y., Yu, F. et al. Structural and functional insights into the modulation of T cell costimulation by monkeypox virus protein M2. Nat Commun 14, 5186 (2023).https://doi.org/10.1038/s41467-023-40748-23. Li, Z., Xia, H., Rao, G. et al. Cryo-EM structures of Banna virus in multiple states reveal stepwise detachment of viral spikes. Nat Commun 15, 2284 (2024). https://doi.org/10.1038/s41467-024-46624-x4. Jiayi Yin, Yan Fu, Guibo Rao, Zhiqiang Li, Kexing Tian, Tingting Chong, Kai Kuang, Manli Wang, Zhihong Hu, Sheng Cao, Structural transitions during the cooperative assembly of baculovirus single-stranded DNA-binding protein on ssDNA, Nucleic Acids Research, Volume 50, Issue 22, 9 December 2022, Pages 13100–13113,https://doi.org/10.1093/nar/gkac11425. Xiaoshen Wang, Guimei Yu, Yanan Wen, Qiyin An, Xuzichao Li, Fumeng Liao, Chengwei Lian, Kai Zhang, Hang Yin, Yong Wei, Zengqin Deng, Heng Zhang, Target RNA-guided protease activity in type III-E CRISPR–Cas system, Nucleic Acids Research, Volume 50, Issue 22, 9 December 2022, Pages 12913–12923, https://doi.org/10.1093/nar/gkac11516. Wang, X., Li, X., Yu, G. et al. Structural insights into mechanisms of Argonaute protein-associated NADase activation in bacterial immunity. Cell Res 33, 699–711 (2023).https://doi.org/10.1038/s41422-023-00839-77. An, Q., Wang, Y., Tian, Z. et al. Molecular and structural basis of an ATPase-nuclease dual-enzyme anti-phage defense complex. Cell Res 34, 545–555 (2024). https://doi.org/10.1038/s41422-024-00981-wJEOL新一代300kV冷冻电镜目前,市场在售的是JEOL新一代300kV冷冻电镜CRYOARM 300II (JEM-3300),其特点如下:高稳定性冷场枪科勒照明模式,消除光斑边缘菲涅尔条纹,提升采集效率低慧差光路系统,大范围移动电子束时光束质量稳定镜筒内置的Omega能量过滤器,一键实现零峰校正高真空样品存储仓,换样灵活图2 CRYOARM 300II外观相关产品 https://www.instrument.com.cn/netshow/SH100507/C283127.htm