最近早报一个药品,做杂质检查,此杂质是辅料降解产生的有害杂质.发现,杂质检查有两种方法,一个是定量试验,一个是限度试验.什么情况下按定量做,什么情况下按限度试验方法做呢.有什么具体的规定吗.我看了不少都是用的限度试验.
我最近在做一种制剂的有关物质检查。原先是在岛津的机器上UV检测器做的,主药在254nm处有最大吸收,故确定在此波长下检测。然后专家认为应该对杂质检查中杂质的检测波长进行优化,而不是依据主药的最大吸收波长来测。但是我们岛津没有配备DAD,是到Agilent1100上做的全波长扫描,但是很奇怪在Agilent的仪器上原本7分多钟的主药峰变成了20多分钟甚至更长,或者干脆就不出峰。进了好几针重现性很差,其他色谱条件都没有变动,就是换了一台仪器。而同一个样品再换到岛津上检测又是好的了。另外我的待测样品有点粘度,不知道是不是跟这个有关?真的百思不得其解这其中的问题所在,望高人帮忙想一下,非常感谢!

放射性物质检查系统是一种专门用于放射性恐怖活动和放射性物质非法转移的新型安检系统。该系统采用非常稳定和可靠的探测材料,对放射性物质探测灵敏度高,具有结构轻巧,便于安装、携带,检测信息能经过有线或无线进行网络传输,实现远程控制与监测,是保护社会和公众免受放射性危害的理想检查系统。特点:1.系统结构简单,安装方便2.灵敏度高,对放射源方位有较好辨别能力应用范围: *机场、海关口岸*车站、码头*体育和会议场馆等用于监测和检查行人、行李等是否携带放射性物质*CIAE1108A型:与危险品检查通道相配合用于行李、手提箱的检测;*CIAE1108B型:与金属探测安检门配合用于非金属包壳的放射性物品检测。
关于欧洲药典色氨酸有关物质检查的流动相问题,调节ph之前溶液总体积已达1700ml,再用2.9g/L磷酸溶液调节ph到2.3结果倒入400ml左右,才勉强能达到2.3,这是否合理?有人做过这个检查吗,有相关的色谱图可供参考吗?
螺内酯片有关物质检查有人做过吗?发图看一下
作为一个新药,对其纯度的检查是保证安全有效的重要指标之一,而纯度检查的内容,根据各个药物的性质和特点有些不同,但基本上均要涉及各自的“有关物质”检查研究。关于有关物质的检查,在国际上已早为“人用药品注册技术规范协调会(ICH)”所关注,国内在新药的有关文件中也提出了供参阅的一些具体要求,并逐渐引起研制新药者的重视。 由于一个新药从合成原料药到制备有关的制剂,再经贮藏、运输、使用,要经历一段较为复杂和漫长的过程,在此期间,每一过程都有可能产生有关的物质,如生产中可能带入起始原料、试剂、中间体、副产物和异构体等;在贮藏和运输过程中,可能产生降解产物、聚合物或晶型转变等特殊杂质。为保证药物的安全有效,同时也要考虑到生产实际情况,因此,国内外对药物的研究,可允许含有一定限量的无害或低毒性的有关物质,但对毒性较大,能危害人体健康的、无效的或能影响药物稳定性的有关物质则必须严格控制。 因有关物质的量微小,故检测方法至关重要,必须选择专属性强、灵敏度高、重复性好的方法。目前,首选的是色谱法,可根据新药的具体品种及其有关物质的性质采用TLC,HPLC及GC等,有的还应采用其他有关的色谱或波谱法。对于一、二类新药更应重视,必要时可采用HPLC/UV二极管阵列、HPLC/MS或GC/MS等联机技术,对有关物质进行定性定量分析。 现将有关物质检查中常见到的一些问题讨论如下。1 未提供研究方法的专属性 申报资料中常见到有关物质检查的结论是“未检出有关物质”,甚至在稳定性各影响因素考察中,样品颜色已明显变化,但其结果仍是“未检出降解产物”,因而提供的TLC图上只有1个斑点,HPLC图上只有1个主药的峰。对于此类情况,应考虑方法的专属性,如采用的是HPLC,则在方法研究中可按中国药典附录的要求,进行系统适用性试验,考察方法的专属性,具体方法有:①如有关物质为已知的某中间体、副产物或降解产物,则可在原料药中加入该杂质适量进行试验,以证明能达到分离;②如有关物质为未知,可用含有杂质的粗品进行试验,以证明能达到分离;③将精制品经强光、高温、高湿、氧化剂或酸碱等分别处理,使样品光解、分解、氧化或水解后进行试验,以证明能分离出杂质。经上述方法试验能分离出杂质,即证明采用的方法具有一定的专属性。2 未提供研究方法的灵敏度 申报资料中,有的把试验的最低浓度作为灵敏度,甚至有的只有文字叙述而无任何数据和图谱,而未提供详细方法学研究资料和图谱来证明该最低浓度为最低检出量。因此,提供的灵敏度缺乏试验依据,不能反映所采用方法的真实检出灵敏度。对此,研究者在研究的方法具有专属性后,应考虑方法的灵敏度。如采用HPLC分析时,一般使最低检出量相当于基线噪音的3倍峰高时注入的样品量;如采用TLC分析时,应将样品配制成一系列的不同浓度,分别点样、展开、显色,以确定灵敏度和最低检出量。3 未提供定性和定量的依据 在申报资料中,除极少数用已知杂质作对照,对样品中有关物质进行定性、定量外,多数强调了制备杂质对照品的困难。因此,对有关物质的定性和定量是用主成分自身对照法或面积归一化法,但因未提供所检测的杂质在设置的检出波长处的响应因子,而不同杂质的的响应因子有可能不同,且差别较大,至使虽有定性和定量结果,但可靠性较差。因此,有关物质定性、定量的最佳方法是采用已知对照品的方法,使所提供的定性和定量有充分依据。4 未提供有关物质的来源及其性质 申报新药中的有关物质,绝大多数为未知,即使其有关物质含量大于2%或一类创新药,也常把在HPLC主峰以外的各杂质峰统归为未知的杂质,而未研究其杂质的来源、性质及其确切的含量。为保证新药应有的纯度,特别是一类新药,对有关物质检查应严格要求,对其主要杂质要确证化学结构,对主要杂质和其他杂质要分别定出限量。5 色谱图记录时间太短或进样量过小 在资料中,有不少HPLC图谱不符合要求,表现在主峰的保留时间记录刚完毕,即停止记录,致使一些比主成分峰保留时间大的有关物质不能检出或进样量过小,杂质检不出。由于有的药物与其有关物质分子结构的极性相差较大,因此,在HPLC分析中,有关物质的保留时间可能在主成分峰之后出现,故记录时间应比主成分峰的保留时间延长2~3倍,并应考虑样品配制浓度或进样量致使主成分峰为一矩形峰,以确保样品中的有关物质能全部检出。6 提供的色谱图不合要求 资料中常见提供的色谱图失真,例如TLC分析提供的是手工绘制的正圆形示意图,或虽是图谱的照片,但无样品点样点,无溶剂前沿,斑点未标示Rf值,样品无批号或文字说明等;HPLC分析中亦有用手工描绘图谱的,有的原图缩得过小以至图上数据模糊不清,或提供的图谱无样品批号,无保留时间,无文字说明,或各峰积分值与列表数据不相吻合等;在稳定性考察降解产物中,上述情况更为严重,致使无法审查。因此,研究者应认真参考新药审批的有关技术指导原则进行试验,提供符合要求的色谱图。7 资料前后缺乏相关性 在有关物质检查研究中,有的用HPLC进行了较深入的方法学研究,以已知中间体或杂质作对照,证明方法较好,专属性较强,但在制订质量标准研究中的图谱却未出现相同的杂峰,而是其他杂质峰,致使样品研究中的有关物质与制订标准中的有关物质不相关,且在资料中对此无说明。对此情况,应进一步深入研究,弄清是产品工艺不稳定带入的其他有关物质,还是产品本身不稳定的降解产物或残留有机溶剂所致,使研究的结果与制订标准的结果一致。8 未说明有关物质的个数及其总量 资料除极少数研究了有关物质的个数和总量,并放入质量标准外,大多数对有关物质的数和量未做精密研究,对有关物质只是笼统的订为不得大于百分之多少,这就难以保证产品的有关物质是否稳定在规定的限度范围内。因此,在研究并确定了有关物质数和量的基础上,应对若干批工艺稳定后的产品进行分析,积累数据,对有关物质订出个数,并对主要有关物质、未知及总的有关物质分别订出限量,以保证产品质量。
【摘要】本文针对审评原料药有关物质检查方法中存在的问题,介绍欧洲和英国药典关于原料药已知杂质的研究现状和有关物质方法建立及质量控制,以供申请人参考。【关键词】有关物质、方法学、分离度。 笔者审评原料药有关物质检查方法中发现,大多申请人越来越多地认识到控制原料药有关物质的重要性,自行建立方法考察原料药中存在的有关物质。但在研究中往往片面认为样品通过了破坏性试验和1%自身对照法后的系统适用性试验就符合了要求。因此,忽视对主成分中杂质产生原因的分析,忽视仪器的检测灵敏度的分析、忽略色谱柱(柱效)的选择、流动相及比例的选择、检测波长的选择。忽视主成分和可能产生的杂质分离度的问题。 1、原料药有关物质方法建立应关注的问题:原料药中的杂质来源于合成的中间体、副产物、以及降解产物,建立方法初期,仅采用破坏性试验的方法考察降解产物的做法是片面的。由于降解产物的量较小,如果选择的方法不好,比如,柱效低,波长选择不合理、流动相及流动相比例不合适,即使有降解产物,也达不到有效的灵敏度和有效的分离。因此,一个好的分析方法的建立首要问题应是围绕主成分和杂质的分离度和检测波长进行。对于生产原料药的企业来讲,由于可以通过工艺得到中间体、副产物,在方法建立初始,首先应该将可能的中间体和副产物作为杂质对待,进行柱效、流动相及流动相比例、波长和分离度等方法学的研究。方法建立成熟后,可根据中间体和副产物的安全性和工艺得到的难易程度决定是否固定为已知杂质。如果工艺中难以得到,且比较安全,可考虑采用杂质校正因子加上相对保留时间的方法。或采用杂质相对保留时间加上自身对照方法。上述三种方法均有好的分离度和响应值(灵敏度)作保证。也是研发和审评中应当提倡的。如果原料合成中确实得不到副产物,对于有紫外吸收的样品可以用二极管阵列检测器,考察未精制的粗品,并对比已精制过的样品,确定粗品中各成分的分离度和样品中可能杂质的检测波长。方法确立后,可采用自身对照方法或面积归一化法控制杂质。对于后一方法,在研发和审评中应当慎重选用。如果证明上述四个方法是比较成熟的方法后,如果再加上破坏性试验考察降解产物,其方法就更加完整和适用。 2、介绍欧洲和英国药典控制有关物质关注的问题 欧洲和英国药典的原料药标准后面,大部分都附有可能产生的中间体和副产物的结构,在有关物质质量控制中有些采用已知杂质的方法;有些采用杂质校正因子加上相对保留时间的方法;杂质相对保留时间加上自身对照方法和自身对照方法或面积归一化法。例如:核黄素磷酸钠的有关物质检查就是采用HPLC的已知杂质-核黄素、其他杂质相对保留时间加上自身对照的方法。取本品0.1g,用水50ml溶解,并用流动相稀释至100ml,取该溶液8ml,用流动相稀释至50ml,作为供试品溶液。另取核黄素对照品60mg,加盐酸试液1ml溶解,用水稀释至250ml, 取该溶液4ml,用流动相稀释至100ml,作为对照品溶液(a)。再另取核黄素磷酸钠对照品0.1g,用水50ml溶解,并用流动相稀释至100ml,取该溶液8ml,用流动相稀释至50ml,作为对照品溶液(b)。用十八烷基硅烷键合硅胶为填充剂(填充剂粒度:5μm;柱长:0.25m;内径:4.6mm);以甲醇-7.35g/L磷酸二氢钾溶液(150:850)为流动相;检测波长266nm;流速2ml/分。5-单磷酸核黄素的保留时间为20分钟;其他相对保留时间:3,4-二磷酸核黄素大约0.2;3,5-二磷酸核黄素大约0.3;4,5-二磷酸核黄素大约0.5;3-单磷酸核黄素大约0.7;4-单磷酸核黄素大约0.9;核黄素大约2。 取对照溶液(a)100μl注入液相色谱仪,调节主峰高度为满量程的50%;再注入对照溶液(b)100μl,记录色谱峰直到核黄素的峰面积能被准确计算,且4-单磷酸核黄素峰与5-单磷酸核黄素峰的分离度应不小于1.5。精密量取供试品溶液、对照溶液(a)和对照溶液(b)各100μl,分别注入液相色谱仪,供试品溶液的色谱图中,如有与核黄素峰保留时间相应的色谱峰,其峰面积不得大于对照溶液(a)主峰面积(6.0%),二磷酸核黄素面积的和不得大于对照溶液(a)主峰面积(6.0%),且均应以干燥品计。 3、结合国内研发核黄素磷酸钠的状况提几点建议在审评核黄素磷酸钠原料和注射剂有关物质的过程中发现,申请人常参照中国药典收载的核黄素磷酸钠及注射液标准项目进行。忽视了国内外标准和国内同品种质量的调研,盲目申报。一些资料中单磷酸核黄素的分离度并不好,从图谱看起来,表面上其质量比国外标准的质量好,但实际上是单磷酸核黄素等多个组分并未得到有效分离。虽然国外将各单磷酸盐均看成有效成分,而未作为杂质控制,但在方法学研究中,的确关注了各单磷酸盐的分离度,这应是方法学研究的重点。如果建立的方法不能使每一个成分分离,这个方法就不是一个好的方法。从这个例子分析,审评中不能简单认为杂质个数少了,质量就好,杂质个数多了,质量就差,一定要结合分析方法的好坏,经过综合分析判断后下结论。否则,容易犯主观主义和片面主义的错误,将由于因分析方法的分离度较差而导致的杂质个数少的药品误认为质量好。其实,药品中包含着没有分开的成分,这个成分很可能是最不安全的成分。因此,一个药品的有关物质方法的评价更应重视分离度方法的评价,在分离度合适的情况下,比较检出杂质的个数才有意义,不能简单的以检出杂质的个数多少论质量。 对核黄素磷酸钠,引起重视的应是分离度方法的问题,在有了好的分离度方法基础上,再根据每一个成分的安全性和生产工艺的成本,考虑对每一个成分的合理控制,这是有关物质研究的重点。在可能的情况下,推荐使用国外药典标准的有关物质检查方法和限度。建议在仿制原料药时,首先应查阅国外药典同品种质量标准,借鉴国外的有关物质检查方法和限度,减少建立方法学和质量研究工作的盲目性。在未有文献可借鉴时,根据我国实际的研究水平,建立有关物质的检查方法。 其二,由于国内仿制的原料药是可以豁免临床研究的,不同的合成工艺对主药的影响不同,而可能的中间体、副产物、降解产物会不同。有关物质方法的确定一定要以工艺中的理论上的各成分的分离度为依据,并与已上市药品进行质量对比,确定可能的已知杂质或杂质相对保留时间保证方法的分离度。 其三,关注工艺杂质并兼顾原料药的降解产物的安全剂量,其限度可以以已上市药品的对照数据为依据。 原料药有关物质的控制方法对质量控制来说至关重要,它是衡量质量和稳定性一致性的尺子。因此,不能忽视有关物质检查方法的验证或方法建立。 上面是以审评核黄素磷酸钠原料和注射剂有关物质方法为例,说明方法建立应关注的重点问题是分离度,没有分离度作保证,方法的根基就不牢固。希望能对申请人的研发起到帮助,并减少申报资料的发补率。
螺内酯片有关物质检查有人做过吗?发图看一下
分析方法验证中杂质检查包括定量试验和限度试验,定量试验和限度试验有什么不同?分别主要做哪些实验?
为加强法定计量检定机构的监督管理,规范计量检定行为,提升计量检定工作质量,根据《法定计量检定机构监督管理办法》、《计量授权管理办法》等有关规定,内蒙古兴安盟质监局按照“双随机一公开”监管机制,组织开展2018年法定计量检定机构监督检查。此次监督检查工作的目标是以提高计量工作有效性为宗旨,以规范检定行为、提高检定工作质量为目标,促进全盟法定计量检定机构科学管理,确保检定结果准确、可靠、公正、有效。检查范围为全盟法定计量检定机构,包括依法设置的计量检定机构和授权建立的计量检定机构。采取自查和随机抽取检查对象开展现场检查相结合的方式。现场检查主要是听取被抽查机构自查情况汇报,查看工作场所和仪器装备,查阅有关文件资料和原始记录,与有关人员面谈询问,抽查服务对象意见等。此次检查共分为自查、现场抽查和整改三个阶段,目前全盟法定计量检定机构已按照通知要求组织开展自查。
我们公司现在增加了甘露醇的有关物质检查(HPLC),用的是磺化交联的的苯乙烯二乙烯基苯共聚物为填充剂的强阳离子钙型交换柱的色谱柱,原先都没用过,有谁用过吗?用的是什么厂家的柱子,性能怎么样?如:[url=http://www.instrument.com.cn/netshow/SH101062/Q715859.htm]SUGAR SC系列强阳离子钙型交换柱[/url] 怎么样?
目前本人在做一个新药(水不溶性)的一般杂质检查,关于氯化物检查和铁盐检查有个疑问,请各位帮忙:根据药典,做氯化物检查时,由于药物水溶性差,可以通过水浴加热、放冷过滤来获得滤液做检查;但是做铁盐检查时,为什么可以直接加水溶解,而不通过水浴加热来增加其溶解度?我一直觉得这两个杂质检查方法的杂质溶解步骤存在矛盾,不知各位意下如何?尽请讨论!
【摘要】本文针对审评原料药有关物质检查方法中存在的问题,介绍欧洲和英国药典关于原料药已知杂质的研究现状和有关物质方法建立及质量控制,以供申请人参考。【关键词】有关物质、方法学、分离度。笔者审评原料药有关物质检查方法中发现,大多申请人越来越多地认识到控制原料药有关物质的重要性,自行建立方法考察原料药中存在的有关物质。但在研究中往往片面认为样品通过了破坏性试验和1%自身对照法后的系统适用性试验就符合了要求。因此,忽视对主成分中杂质产生原因的分析,忽视仪器的检测灵敏度的分析、忽略色谱柱(柱效)的选择、流动相及比例的选择、检测波长的选择。忽视主成分和可能产生的杂质分离度的问题。1、原料药有关物质方法建立应关注的问题:原料药中的杂质来源于合成的中间体、副产物、以及降解产物,建立方法初期,仅采用破坏性试验的方法考察降解产物的做法是片面的。由于降解产物的量较小,如果选择的方法不好,比如,柱效低,波长选择不合理、流动相及流动相比例不合适,即使有降解产物,也达不到有效的灵敏度和有效的分离。因此,一个好的分析方法的建立首要问题应是围绕主成分和杂质的分离度和检测波长进行。对于生产原料药的企业来讲,由于可以通过工艺得到中间体、副产物,在方法建立初始,首先应该将可能的中间体和副产物作为杂质对待,进行柱效、流动相及流动相比例、波长和分离度等方法学的研究。方法建立成熟后,可根据中间体和副产物的安全性和工艺得到的难易程度决定是否固定为已知杂质。如果工艺中难以得到,且比较安全,可考虑采用杂质校正因子加上相对保留时间的方法。或采用杂质相对保留时间加上自身对照方法。上述三种方法均有好的分离度和响应值(灵敏度)作保证。也是研发和审评中应当提倡的。如果原料合成中确实得不到副产物,对于有紫外吸收的样品可以用二极管阵列检测器,考察未精制的粗品,并对比已精制过的样品,确定粗品中各成分的分离度和样品中可能杂质的检测波长。方法确立后,可采用自身对照方法或面积归一化法控制杂质。对于后一方法,在研发和审评中应当慎重选用。如果证明上述四个方法是比较成熟的方法后,如果再加上破坏性试验考察降解产物,其方法就更加完整和适用。2、介绍欧洲和英国药典控制有关物质关注的问题欧洲和英国药典的原料药标准后面,大部分都附有可能产生的中间体和副产物的结构,在有关物质质量控制中有些采用已知杂质的方法;有些采用杂质校正因子加上相对保留时间的方法;杂质相对保留时间加上自身对照方法和自身对照方法或面积归一化法。例如:核黄素磷酸钠的有关物质检查就是采用HPLC的已知杂质-核黄素、其他杂质相对保留时间加上自身对照的方法。取本品0.1g,用水50ml溶解,并用流动相稀释至100ml,取该溶液8ml,用流动相稀释至50ml,作为供试品溶液。另取核黄素对照品60mg,加盐酸试液1ml溶解,用水稀释至250ml, 取该溶液4ml,用流动相稀释至100ml,作为对照品溶液(a)。再另取核黄素磷酸钠对照品0.1g,用水50ml溶解,并用流动相稀释至100ml,取该溶液8ml,用流动相稀释至50ml,作为对照品溶液(b)。用十八烷基硅烷键合硅胶为填充剂(填充剂粒度:5μm;柱长:0.25m;内径:4.6mm);以甲醇-7.35g/L磷酸二氢钾溶液(150:850)为流动相;检测波长266nm;流速2ml/分。5-单磷酸核黄素的保留时间为20分钟;其他相对保留时间:3,4-二磷酸核黄素大约0.2;3,5-二磷酸核黄素大约0.3;4,5-二磷酸核黄素大约0.5;3-单磷酸核黄素大约0.7;4-单磷酸核黄素大约0.9;核黄素大约2。取对照溶液(a)100μl注入液相色谱仪,调节主峰高度为满量程的50%;再注入对照溶液(b)100μl,记录色谱峰直到核黄素的峰面积能被准确计算,且4-单磷酸核黄素峰与5-单磷酸核黄素峰的分离度应不小于1.5。精密量取供试品溶液、对照溶液(a)和对照溶液(b)各100μl,分别注入液相色谱仪,供试品溶液的色谱图中,如有与核黄素峰保留时间相应的色谱峰,其峰面积不得大于对照溶液(a)主峰面积(6.0%),二磷酸核黄素面积的和不得大于对照溶液(a)主峰面积(6.0%),且均应以干燥品计。
最近在做克拉霉素有关物质检查,却发现很多奇怪的现象,让我百思不解,写出来跟大家讨论讨论。仪器:岛津2010A/C(一新一旧),25cm的C18柱两根,210nm,05版药典二部方法,流动相为缓冲盐:乙腈(6:4),缓冲盐中加0.2%三乙胺,用磷酸调pH至5.5,柱温45度,分析时间30min。奇怪现象如下:1。柱温为室温(20度)时,主峰在6min左右出峰,柱温为45度时,主峰在8-9min出峰,有点反常。2。平衡好柱子后进样,系列进样,前几个样走得比较正常,比如到第3个样,第十几分钟后基线出现个大包(疑似进气泡的现象),连续3针基线都是波浪式的,但过了这几针却又好了。大家都说是检测池进气泡了,但是我每次做这个样品的时候都出现这个情况,而且流动相我每次都要超声10min,使用新的仪器(刚买不到1个月)也这样,而这台仪器做其它样品的时候一切正常,所以,让我很头疼,不知道有没有跟我碰到一样的情况。3。样品用流动相溶解,当进空白溶剂(即流动相)时,在2.4min出现一个小峰,峰高大约在1mAU,克拉霉素原料在2.4min也出现杂质峰,峰高要大一点,而克拉霉素片用的辅料也在2.4min出峰,所以做有关物质时就犯难了,这个峰怎么处理,也不能当溶剂或辅料峰扣掉,不扣的话,这个杂质峰就已经超标了。
浅谈对已有国家标准化学药物杂质检查方法学研究资料的审评体会审评五部 李志万 《已有国家标准化学药品研究技术指导原则》(征求意见稿)中“质量研究方法的选择及方法学验证”部分提出“对于原料药的有关物质检查,重点通过采用合成中间体、粗品等考察方法的专属性;对于制剂的有关物质检查,重点通过破坏试验等考察方法的专属性”。 已有国家标准的(注册分类6的仿制)药物注册占我国目前的药物注册绝大部分。可能因为对新制订的《化学药物杂质研究技术指导原则》的理解不同,仿制药物申报资料中杂质研究部分多数存在这样或那样的问题,需要以书面或非书面的形式进行说明或完善,严重影响了对药品评价和注册的进度。笔者拟根据自己对此问题的理解,简略谈一下自己对仿制药物杂质检查方法研究的几点认识。 本文所阐述的杂质主要为药物中的有机杂质,但不包括残留有机溶剂。 一 正确认识仿制药物杂质研究的意义 可能有部分研究人员认为鉴于仿制药物的安全性已经验证,其杂质研究可否不再进行,可否不经验证直接沿用已有标准中(有关物质检查)方法。对上述观点,笔者认为因不同研发单位所用的原辅料不同,所引入的杂质不同;不同研发单位所采用的制备路线、制备工艺不同,所产生的杂质可能会不同。因此,有必要对仿制药物中的杂质重新进行研究,已有标准中方法是否适用于自制品也需实验验证。 二、已有标准药物杂质检查方法研究的几点考虑 与其它定量检查方法相比,杂质检查更着重于方法的专属性和灵敏度;仿制药物杂质研究亦是如此,但因有同品种标准可供参考,也有其特殊性。下面拟以已有标准中有无杂质检查项,以及在相应情况下原料药和制剂的杂质如何研究分别阐述。 1 已有标准中有有关物质检查项的仿制药物杂质检查 此时的原料药杂质研究如采用已有标准中方法,方法专属性和灵敏度验证的主要对象应药物粗品中杂质和药物制备过程中的中间体,尤其是后期制备中间体,而非原料降解物。之所以不对原料降解物作更多关注,是基于药物结构一致,其降解物亦应一致的推断;而已有标准中检查方法对(相同)降解物检测的可行性是已经验证过的。以此相反,仿制的制剂杂质研究主要关注点则是已有方法对制剂中主药(在适宜条件下)降解物的检测专属性和灵敏度是否符合要求。这是因为:(1)原料药中杂质及其制备中间体已经得到检控。(2)因不同制剂的处方、制备工艺不同,导致主药存在的环境不同;在酸、碱、氧化、热、光照等条件的“催化下攠,主药产生的降解物可能会不同。(3)不同的辅料对主药降解物检测的干扰性不同。因此,验证已有方法是否仍适用于新制剂中的杂质检测很有必要。 对于已有明确认识的有毒降解物,如对乙酰氨基酚之对氨基酚、葡萄糖之5-甲基糠醛等,无论原料药还是制剂,均建议采用杂质对照品验证所用方法的可行性。 如可能因条件限制,或认识的不同,仿制药物研发单位采用有别于已有标准中的其他方法,笔者则建议进行全面的(自拟)杂质检查方法学研究为宜,具体要求见《化学药物杂质研究技术指导原则》。值得强调的是,自拟方法与已有方法对相同供试品中杂质进行对比研究,对评价自拟方法的可行性很有意义。 2 已有标准中无有关物质检查项的仿制药物杂质检查 如已有标准中未收载有关物质检查项,在无相关研究结论支持的条件下,不能简单地推断所仿制的药物稳定而不需进行有关物质研究。笔者认为无论从质量标准的提高方面,还是从自制品质量研究、稳定性的考察方面(本文前面已说明自制品杂质可能与被仿制品杂质不同,稳定性亦可能有所差异),均有必要对仿制的原料药和/或制剂进行相应的杂质研究,并根据研究结果选用可行的杂质检查方法检控自制品的质量。具体要求亦请参见《化学药物杂质研究技术指导原则》。 考虑到原料药有时不会即时制成制剂,在贮存期间可能会有一定的降解,同时便于制剂厂家检测市购原料药的质量,建议制订适宜限度将有关物质检查项列入(原料药)质量标准;制剂质量标准中是否制订有关物质检查项,可根据杂质的毒性(安全性)、制剂的稳定性综合考虑。 欢迎对上述观点进行讨论、指正。
[size=3][b]请教已有药典标准的原料药的质量标准细节[/b][/size]我们现在做一个仿制药,质量标准收在美国药典。对于其中的一些细节问题向大家请教一下,先谢谢各位老师了。1、稳定性实验:加速试验、影响因素试验是不是每次取样进行含量测定、有关物质检查时都要做方法验证?2、采用药典方法还需要做详细的方法验证吗?具体哪些需要做,哪些可不必做?3、不用杂质对照品进行杂质定量时(采用主成分的对照品作为对照溶液,供试品中杂质的峰面积与对照溶液峰面积之比),方法验证需要做哪些?非常感谢!
请问:什么是脑部神经递质检查,适应于情感类和精神类疾病吗?
[b]扩散 | 检测机构注意!2018年度资质认定监督检查自查启动[/b]2018-02-13 17:00近日,国家认监委发布通知,要求各检验检测机构上报2017年年度报告并开展2018年资质认定监督自查,请有关单位注意。[align=center]国家认监委办公室关于检验检测机构上报2017年年度报告并开展2018年资质认定监督检查自查的通知[/align][align=center]认办实函〔2018〕16号[/align]各直属检验检疫局,各省、自治区、直辖市质量技术监督局(市场监督管理部门),各资质认定(计量认证)行业评审组,各国家产品质检中心及检验检测机构:为进一步加强检验检测机构资质认定监督管理,落实《检验检测机构资质认定管理办法》(质检总局令第163号)有关管理要求,根据国家认监委2018年检验检测机构资质认定监督管理工作安排,请检验检测机构上报2017年年度报告并开展2018年度资质认定监督检查自查,检验检测机构所属国家产品质检中心还需上报2017年年度社会责任报告。现将有关要求通知如下:一、检验检测机构上报2017年年度报告依法取得资质认定的检验检测机构,应当按照《检验检测机构资质认定管理办法》第三十七条的有关要求,按时向资质认定部门上报年度报告。各相关检验检测机构应于2018年4月底前,登录国家认监委网站(www.cnca.gov.cn)的检验检测统计直报系统,点选“上报年度报告”栏目,提交本机构2017年年度报告(2017年年度报告参考格式见附件1)。二、国家产品质检中心上报年度社会责任报告根据《国家产品质量监督检验中心授权管理办法》及《国家认监委关于印发的通知》的要求,取得认监委授权的各个国家产品质量监督检验中心,应当于2018年4月底前,以所属检验检测机构的用户名和密码,登录国家认监委网站(www.cnca.gov.cn)的检验检测统计直报系统,点选“上报社会责任报告”栏目,提交本中心2017年年度社会责任报告(2017年年度社会责任报告参考格式及填报要求见附件2)。一个法人单位承建有多个国家产品质检中心的,每个国家产品质检中心需单独填写一份社会责任报告。三、检验检测机构开展2018年度资质认定监督检查自查根据《检验检测机构资质认定管理办法》的要求,取得资质认定的检验检测机构应持续符合资质认定相关要求,并自觉接受资质认定部门的监督检查。各检验检测机构应按照国家认监委《2018年度检验检测机构资质认定监督检查自查表》(见附件3,以下简称“自查表”)的要求,于2018年4月底前登录检验检测统计直报系统,点选“资质认定监督检查自查”栏目进行资质认定自查,查找自身运行管理的问题和不足,并持续改进。四、工作要求各检验检测机构应高度重视年度报告上报及资质认定监督检查自查相关工作,认真按要求完成。未按照要求按时上报年度报告、年度社会责任报告(国家产品质检中心适用)以及开展资质认定监督检查自查的检验检测机构,资质认定部门将依情况,采取警告、责令改正、不再受理其资质认定申请或进行通报等处理措施,并在后续监管中将其列为重点监管对象。
最近在做一个新的抗生素 用液相面积归一化法做杂质检查 杂质要求小于百分0.6 两次平行多少的误差才算合格 依据出在哪里 例如百分0.51和百分0.29 这算平行吗
美国 FDA 对企业的检查重点美国 FDA 对企业的检查重点是时效性与动态性,时效性是强调以现行 GMP 为依据(即 CGMP )。因为 GMP 是一个不断提高、螺旋式上升的一种管理模式,没有最好,只有更好,因此现行 GMP 就代表了一定时期内较先进的管理水平。动态性是强调检查时申请注册的品种在生产状态下动态检查;每隔两年要对申请企业进行复查 , 以保证企业处于良好的、持续的按照现行 GMP 管理的状态。 FDA 检查官按原料药的生产顺序从原料到成品包装及出厂的顺序来进行检查, FDA 对工艺过程中的一些关键步骤的操作条件、方法及设备进行的验证( Validation )非常重视。 FDA 在对企业进行检查时对影响产品质量的关键工艺控制、防止交叉污染措施、工艺验证、清洁方法、设备验证、变更控制、水、环境、检验以及检验方法验证等非常重视。 FDA 对企业现场检查的重点以下几个方面: 1. 对原料药的原材料的质量控制与管理极为重视 其中包括原材料入库、堆垛、标记及标签、检验及发放的制度、库房的仓储条件。 2. 原料药生产工艺 通常重点检查生产关键中间体的第一次反应的步骤,对于非合成药物,则重点放在药物的分离与提取的第一步上。 3. 验证 FDA 从 1991 年起决定要对生产工艺进行验证,凡未进行过工艺验证的厂家, FDA 要强调进行工艺验证的检查,对于一个新产品,从中试阶段起应建立起完整的验证体系直到放大到工业规模,对已采用多年的生产工艺则应作一次回顾性的验证,生产工艺验证一般不是永恒性的,凡有变动(工艺、设备、原材料、质量标准检验方法),应重新进行验证。 4. 对生产设备诸如发酵罐、种子罐、结晶罐、反应罐、离心机、干燥器、混合器的清洗规程均应经过验证,在交叉使用设备生产不同的产品时尤为重要。 5. 供出口美国的成品批量对于一般的美国终端用户来说批量较大为好,这样可以减少批检验所需的成本。但是批的划分一定要能达到均质性,而且要对均质性进行验证,包括每一桶、每一机等。 5. FDA 对工厂的生产工艺用水等均要求提供质量标准及检验结果的资料。对制剂用水的要求比对原料药的要求更为严格,每月每季每年要作趋势分析。 6. 对原料药的包装容器上的标签应与对制剂药的要求一样进行严格的控制。 7. 对生产上的每一道工序及岗位的操作过程,仓库的成品及原材料管理,质量控制及质量保证的操作及管理等的标准操作规程。 8. FDA 非常重视对生产记录的检查,对原材料的入库、检验及发放、生产工艺过程的控制、成品的质量检验以及各项重点项目的验证等均要求有完整的原始记录及整套的批记录, FDA 官员在工厂检查要任意取样抽查批记录,批记录的真实性与完整性能具体体现工厂的 GMP 管理的水平。 9. 生产设备包括生产车间及质检等部门的房屋建筑结构、生产线的系列设备、水、电、汽及压缩空气等的附属设施,设备的布局等。 FDA 均要求申报厂家在 DMF 文件中作详细的描述。 FDA 官员只择重点进行检查。 10. 凡属于生产所用的需要定期加以校正的衡器、仪器等均应制定校正的规程及周期并应有完整的校正记录。无论自校或委外校都要保存记录,并要有资质证明。 11. FDA 认为在原料厂中化验实验室的管理最重要。对产品的杂质状况不了解,则该生产工艺就不能进行充分验证,也不能对该工艺的变化进行评估,在 DMF 中工厂应对此作出叙述。 12. FDA 对工艺过程控制的要求是过程管制的分析,操作应由称职的人员采用完整的分析仪器来进行。 13. FDA 要求原料药,特别是抗生素原料药有一个规定的有效期,并且有一套完整的产品稳定性试验的规程及正确的实施。在 DMF 中对此要加以描述,并提供实例及数据。 14. FDA 要求所有≥ 0.1% 的杂质必须要有确定的名称和结构。 15. 杂质检查要求使用二级管矩阵检测器,要求检查杂质的纯度。 16. 对分析方法的验证特别严格,必须按 ICH Q7A 中规定的验证方法进行验证。在具体检验样品时做 HPLC 方法系统适应性必须进样 5 次,测定 RSD 标准。 17. 要求对微生物超净工作台每年重新鉴定一次,按照超净工作台的参数来判定是否符合要求。 18. 要求对菌种的传代次数作出规定,一般不超过 5 次。 需要承诺继续进行试验,当有结果时,提交相关部门。
http://www.sxdaily.com.cn/NMediaFile/2016/0203/SXRB201602030810000547976323634.jpg质监局工作人员商场检查金银饰品柜台计量器 猴年春节马上到了,年前采购年货的人们已经忙碌了起来,为维护公平交易的市场秩序,让市民享受到足斤足秤,昨日,省、市、区三级质监部门,对西安市水产市场、金店、超市、邮局等地的计量器具进行了检查。
【讨论目的】现在的有关物质检查几乎都涉及到了特定杂质的检查,采用校正因子计算特定杂质越来越普遍,园子里面也很多战友讨论了很多。但是一定还有跟我一样对此问题存疑的战友,或许过去认为已了解的战友也存在不够准确的认识。【提出讨论】所提出讨论的问题也许你觉得很简单无聊,但非常希望你能参加讨论给出你的看法①现在问到你,校正因子计算公式,你如何回答?②为什么我们能看到的文献都是按公式(1)所得校正因子(如果是用这个公式,在计算时不能将杂质峰面积乘以校正因子,而是除以校正因子?)③我们是不是把校正因子和响应因子搞混淆了,校正因子与响应因子的倒数关系,是通过什么得到的?④中国药典中的规定和公式说明存在误导?带着这些问题,就查找到的信息汇总说明:1、公认的公式??查了很多资料,包括园里讨论的,包括药检所老师所写文章,几乎大家说到相对校正因子的计算方法都为:F=(A杂/C杂)/(A样/C样) 公式(1)这个公式在我所查到资料里可以认为是最普遍公认的公式2、中国药典的规定中国药典“加校正因子的主成分自身对照法”中规定计算方法:色谱图上各杂质的峰面积,分别乘以相应的校正因子后与对照溶液主成分的峰面积比较,计算各杂质含量。这里规定的“校正因子”计算方法是按内标法校正因子:F=(A内标/C内标)/(A对照/C对照) 公式(2)根据公式(2),我们直接把内标换成杂质,即得到与上面的公式(1)一样的公式,即认为是杂质斜率与主成分斜率的比值,得下面公式(3)F= 杂质斜率/ 供试品斜率 公式(3)药典规定用F乘以杂质峰面积,假设通过该公式计算的校正因子是1.5,则说明杂质峰的响应值要大于主成分,如果在计算时再将杂质峰面积乘以1.5,结果正确吗?那这个公式对吗?3、公式推导 假设响应因子为k,则有k=A/m(单位质量的物质相当于多少峰面积),令杂质k杂=A杂/m杂,主成分k样=A样/m样,则主成分中杂质含量w=m杂/m样*100%,即有:w=(A杂/k杂)/(A样/k样)*100%=(k样/k杂)*(A杂/A样)*100% 公式(4)根据药典,理论上,加校正因子以自身对照法计算杂质含量的公式简易表示应是:w=F * A杂/ A对 公式(5)由公式(4)(5)两式可知,计算杂质时加入的校正因子F:F=k样/k杂=(A样/C样)/(A杂/C杂) 公式(6)4、公式(6)和公式(1)的区别倒数关系,相对响应因子(RRF)与校正因子F的关系如下:F=1/RRF= Slope 主峰/ Slope imp 公式(7)其中:Slope imp是指对应杂质的斜率,Slope 主峰是指主峰的斜率。5、对中国药典的看法①药典中对有关物质计算方法中的校正因子的描述,也许是拐了一个弯,对于我这种没脑子的人来讲容易误导而绕进去出不来。药典中公式对针对内标法测含量设计,不适用于杂质计算。②药典中对“校正因子”的描述与色谱类专业书籍的不符,我所查到的是:校正因子= C/A 公式(8)响应因子= A/C 公式(9)
近日,四川省局计量处组织专家检查组对绵阳市计量测试所进行了法定计量检定机构工作质量现场监督检查。 检查组依据《法定计量检定机构监督管理办法》和《计量授权管理办法》的有关要求,通过听取自查情况汇报,查阅原始记录、计量标准文件集、质量监控记录等技术资料,查看工作现场和与相关人员面谈询问等方式,对该所质量管理体系运行,量值溯源,计量标准运行情况,检定工作质量等10个方面的内容进行了检查。检查组对该所的质量工作进行了肯定,认为该所质量管理体系运行正常。对有待改进的方面,检查组提出了整改意见。 检查组要求,要不断强化人员的责任意识,做好安全防护、环境监测器具强制检定等重点工作。绵阳市计量所所长李亮远表示,对检查组提出的问题将按时整改,举一反三;同时加强人员在质量管理体系方面的培训,推动质量管理水平再上新台阶。
有关物质检查的检查在新药研发中应引起重视 对于一个新药,对其纯度的检查是保证安全有效的重要指标之一,而纯度检查的内容,根据各个药物的性质和特点有些不同,但基本上均要涉及各自的“有关物质”检查研究。关于有关物质的检查,在国际上已早为“人用药品注册技术规范协调会(ICH)”所关注,国内在新药的有关文件中也提出了供参阅的一些具体要求,并逐渐引起研制新药者的重视。 由于一个新药从合成原料药到制备有关的制剂,再经贮藏、运输、使用,要经历一段较为复杂和漫长的过程,在此期间,每一过程都有可能产生有关的物质,如生产中可能带入起始原料、试剂、中间体、副产物和异构体等;在贮藏和运输过程中,可能产生降解产物、聚合物或晶型转变等特殊杂质。为保证药物的安全有效,同时也要考虑到生产实际情况,因此,国内外对药物的研究,可允许含有一定限量的无害或低毒性的有关物质,但对毒性较大,能危害人体健康的、无效的或能影响药物稳定性的有关物质则必须严格控制。 因有关物质的量微小,故检测方法至关重要,必须选择专属性强、灵敏度高、重复性好的方法。目前,首选的是色谱法,可根据新药的具体品种及其有关物质的性质采用TLC,HPLC及GC等,有的还应采用其他有关的色谱或波谱法。对于一、二类新药更应重视,必要时可采用HPLC/UV二极管阵列、HPLC/MS或GC/MS等联机技术,对有关物质进行定性定量分析。
如果你早餐经常吃油条、油饼,平时还爱吃炸鸡翅,那么请注意,在你食用这些美味的同时,健康也可能正在受到损害!因为食用油反复煎炸后,劣变程度很高,产生一些有毒有害物质,导致油的质量下降,影响身体健康。 为了您和家人的健康,请尽量少吃油炸食品,如果想要调节下口味,尽量选择新的食用油,并且煎炸时间不宜过长。那么如果确认自己购买的食用油是新油呢?或者如何才能确定自己使用的煎炸油能否再次使用呢?异或怎么才知道路边小吃摊的油是否安全呢?下在为大家介绍一款用于煎炸油检测的仪器,德图testo270食用油品质检测仪。 一、德图testo270食用油品质检测仪介绍 食用油的总极性组分TPM值,反映了在油在煎炸过程中所导致的劣变情况,德图testo270就是通过测定总极性组分的含量来判断煎炸油的变质程度。testo270设计轻巧,方便操作,检测快速,带极限报警灯,是一款非常适用的油品检测仪器。http://s1.sinaimg.cn/mw690/004kRyXHgy6HMLwWASYb0&690 德图testo270食用油品质检测仪 二、德图testo270食用油品质检测仪主要优点 1.传感器由金属壳保护,可直接对探头进行清洁,坚固耐用; 2.直接放入高温油中检测; 3.传感器可直接进行下一次测量,无需冷却; 4.快速显示测量结果; 5.自动识别测量终值; 6.可设2个自由选择的报警极限值; 7.操作简单,只需3个按键; 8.可现场自行校准; 9.达到极限值LED灯报警; 10.可对配置菜单和极限值进行锁定,防止他人修改; 11.保护软套及皮带拉手,可在洗碗机中冲洗。http://s11.sinaimg.cn/mw690/004kRyXHgy6HMLxLXGq6a&690 德图testo 270煎炸油检测 三、德图testo270食用油品质检测仪技术参数 量程:40.0~200.0 ℃,0.5~40% TPM 精度:± 1.5 ℃,±2.0% TPM 分辨率:± 0.5℃,± 0.5 % TPM 响应时间:20S 报警功能:4点LED高亮灯;2个限值设定 电源:2节AAA型电池 温度传感器:PTC传感器 TPM传感器:电容传感器(testo) 操作温度:0 ~+50℃ 储存温度:-20~+70 ℃ 尺寸:354×50×30mm 显示:LCD背光显示屏 重量:164g 外壳:ABS 四、德图testo270食用油品质检测仪使用要点 为了达到最好的测量效果,使测量结果更准确,请注意认下几个要点: 1、电磁场对测量有影响,测量时关掉电磁炉; 2、应在油炸物移出后再进行测量; 3、测量前将探头清洗干净; 4、测量时探头不要碰触锅壁; 5、测量过程中应搅动仪器; 6、尽量避免水分影响。 如果您还有关于德图testo 270食用油品质检测仪的疑问,请访问德图仪器网,您也可以和武汉宏锦科技有限公司的技术人员直接沟通:400-027-8968,我们将免费为您提供最有效的信息。
中国国家质检总局公布婴幼儿配方奶粉三聚氰胺专项检查阶段性结果 央视网消息(新闻联播):三鹿牌婴幼儿奶粉事件发生后,党中央、国务院高度重视,做出重大部署,日前,国家质检总局紧急在全国开展了婴幼儿配方奶粉三聚氰胺专项检查并公布了阶段性检查结果。 全国目前共有175家婴幼儿奶粉生产企业,其中66家企业已停止生产婴幼儿奶粉。此次专项检查对其余109家企业进行了排查,共检验了这些企业的491批次产品。专项检查显示,有22家企业69批次产品检出了含量不同的三聚氰胺。 检出三聚氰胺婴幼儿配方乳粉企业名单 1、石家庄三鹿集团股份有限公司生产的三鹿牌婴幼儿配方乳粉 2、上海熊猫乳品有限公司生产的熊猫可宝牌婴幼儿配方乳粉 3、青岛圣元乳业有限公司生产的圣元牌婴幼儿配方乳粉 4、山西古城乳业集团有限公司生产的古城牌婴幼儿配方乳粉 5、江西光明英雄乳业股份有限公司生产的英雄牌婴幼儿配方乳粉 6、宝鸡惠民乳品(集团)有限公司生产的惠民牌婴幼儿配方乳粉 7、内蒙古蒙牛乳业(集团)股份有限公司生产的蒙牛牌婴幼儿配方乳粉 8、中澳合资多加多乳业(天津)有限公司生产的可淇牌婴幼儿配方乳粉 9、广东雅士利集团股份有限公司生产的雅士利牌婴幼儿配方乳粉 10、湖南培益乳业有限公司生产的南山倍益牌婴幼儿配方乳粉 11、黑龙江省齐宁乳业有限责任公司生产的婴幼儿配方乳粉2段基粉 12、山西雅士利乳业有限公司生产的雅士利牌婴幼儿配方乳粉 13、深圳金必氏乳业有限公司生产的金必氏牌婴幼儿配方乳粉 14、施恩(广州)婴幼儿营养品有限公司生产的施恩牌婴幼儿配方乳粉 15、广州金鼎乳制品厂生产的金鼎牌婴幼儿配方乳粉 16、内蒙古伊利实业集团股份有限公司生产的伊利牌儿童配方乳粉 17、烟台澳美多营养品有限公司生产的澳美多牌婴幼儿配方乳粉 18、青岛索康营养科技有限公司生产的爱可丁牌婴幼儿配方乳粉 19、西安市阎良区百跃乳业有限公司生产的御宝牌婴幼儿配方乳粉 20、烟台磊磊乳品有限公司生产的磊磊牌婴幼儿配方乳粉 21、上海宝安力乳品有限公司生产的宝安力牌婴幼儿配方乳粉 22、福鼎市晨冠乳业有限公司生产的聪尔壮牌婴幼儿配方乳粉 其他87家企业未检出。 在检出三聚氰胺的产品中,石家庄三鹿牌婴幼儿配方奶粉三聚氰胺含量很高,其中最高的达2563mg/kg,其他在0.09-619mg/kg之间。 被检企业中,只有广东雅士利的婴幼儿配方奶粉出口到了孟加拉、缅甸、也门3个国家。经对留样检测,未发现三聚氰胺。 供应北京奥运会、残奥会的乳制品均未检出三聚氰胺。 9月14日以后生产的液态奶未发现三聚氰胺。 为了保证乳制品的安全,有关部门采取了进一步加强监管的措施。一是对检出存在三聚氰胺的69个批次产品,立即下架、封存、召回、销毁。对有关企业立即进行全面调查,查清原因,追究责任,依法严肃处理。二是对所有乳制品生产企业质检部门派员驻厂监管,对进厂原料奶和各生产环节进行严格监督检查,对出厂成品进行批批严格检验,确保这次专项检查后生产的乳制品质量安全。 另据医学专家介绍,三聚氰胺是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患。目前患泌尿系统结石的婴幼儿,主要是由于食用了含有大量三聚氰胺的三鹿牌婴幼儿配方奶粉引起的,多数患儿通过多饮水、勤排尿等方法,结石可自行排出。如出现尿液混浊、排尿困难等症状时,需要及时到医院就诊。发生急性肾功能衰竭时,如及时治疗,患儿也可以恢复。卫生部门要求各医疗机构进一步加强对含三聚氰胺奶粉引发病例的筛查诊断工作,国家有关部门将继续密切跟踪调查。
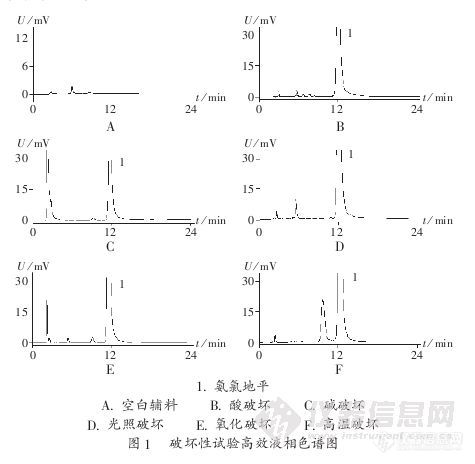
作者:秦书德 马晓伟 陈静 郭兴杰作者单位沈阳药科大学,摘 要:目的建立检查苯磺酸氨氯地平有关物质的反相高效液相色谱法。方法采用Diamonsil C18色谱柱(200 mm×4.6 mm,5μm)进行分离,流动相为甲醇-30 mmol/L磷酸二氢钾溶液(60∶40),流速1.0 mL/min,检测波长238 nm。结果所用色谱条件能很好地分离氨氯地平及其降解产物,氨氯地平质量浓度在0.71~3.57μg/mL范围内与峰面积线性关系良好。结论反相高效液相色谱法专属性强、准确、灵敏,可用于苯磺酸氨氯地平片中有关物质的检查:http://ng1.17img.cn/bbsfiles/images/2012/08/201208201631_384755_2379123_3.jpg
问题: 我想问下有关物质检查中主峰保留时间改变辅料峰保留时间是不是不会改变
均质器的功能检查?怎么做
气路检查,原子荧光光度计的气路怎么检查?是否有用到肥皂水什么的?跟[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]的气路检查一样吗. 望高手指点迷津.