AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤很简单的,比较适合初学者。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=113913]AKATA制备型液相色谱蛋白分析仪纯化蛋白步骤[/url]
牛奶蛋白质分析仪可以用于检测乳蛋白制品。以下是详细解释和相关信息: 功能与应用:牛奶蛋白质分析仪是一种专门用于分析牛奶及其制品中蛋白质含量的仪器。它基于先进的生化分析技术,如比色法、光谱法或电化学法等,能够准确、快速地检测样品中的蛋白质含量。 乳蛋白制品的检测:乳蛋白制品,如奶粉、酸奶、奶酪等,其蛋白质含量是产品质量和营养价值的重要指标。牛奶蛋白质分析仪可以有效地检测这些乳蛋白制品中的蛋白质含量,为生产厂家提供准确的质量控制手段。 优点与特点: 准确性高:牛奶蛋白质分析仪具有高灵敏度和高准确性,能够确保测量结果的可靠性。 快速便捷:该仪器操作简单,使用方便,可以快速得出测量结果,提高检测效率。 适用范围广:除了牛奶及其制品外,还可以用于其他含蛋白质样品的检测,如豆类制品、肉制品等。 在乳品工业中的重要性:随着乳品市场的不断扩大和消费者对乳制品质量要求的提高,牛奶蛋白质分析仪在乳品工业中的重要性日益凸显。它可以帮助乳品企业提高产品质量、降低生产成本,同时为消费者提供更加安全、健康的乳制品。 综上所述,牛奶蛋白质分析仪是一种功能强大、应用广泛的检测仪器,完全可以用于检测乳蛋白制品中的蛋白质含量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/05/202405271615421543_8284_6238082_3.jpg!w690x690.jpg[/img]
[font=宋体][font=宋体]泛素化是一种细胞内的蛋白质标记系统,蛋白质泛素化是指将小的蛋白质泛素共价地连接到其他蛋白质分子上的过程。泛素([/font][font=Calibri]ubiquitin[/font][font=宋体])是一种高度保守的蛋白质,其结构由[/font][font=Calibri]76[/font][font=宋体]个氨基酸残基组成。泛素连接到目标蛋白质上的过程,经历了泛素激活、泛素转移和靶蛋白接受三个主要步骤。[/font][/font][font=宋体] [/font][font=宋体]蛋白质泛素化具有多种特点,例如它是高度选择性的,不同蛋白质泛素化的位置和数量可以影响其功能;它是可逆的,通过去泛素化反应可以调控蛋白质的泛素化状态;它还是动态调控的,受到多种因素的调控,如细胞信号通路和环境刺激。[/font][b][font=宋体]泛素化蛋白大小:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]蛋白泛素化是指将小蛋白颗粒泛素([/font][font=Calibri]Ubiquitin[/font][font=宋体])与其他蛋白质共价结合的修饰过程。 泛素化修饰通常会导致泛素共价连接在蛋白质的赖氨酸残基上形成多重泛素链。 这种蛋白质泛素化增加了蛋白质的分子量,因为每个泛素分子的质量大约为[/font][b][font=Calibri]8.5[/font][font=宋体]千达尔顿([/font][font=Calibri]kDa[/font][/b][font=宋体][b])[/b]。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]泛素化蛋白质组学在许多领域有重要的应用,主要包括:[/font][/b][font=宋体] [/font][font=宋体]①疾病机制研究:泛素化是一种广泛存在于细胞中的蛋白质修饰方式,参与了细胞的生长、分化、修复和调控等多个生命活动。泛素化蛋白质组学的研究可以帮助我们了解泛素化修饰的生物学功能和调控机制,为疾病发生机制和治疗策略的研究提供重要线索。例如,在癌症、代谢综合征、神经退行性疾病等疾病中,则会出现异常泛素化。[/font][font=宋体]②药物研发:通过分析药物对泛素化蛋白质的影响,可以评估药物的效力和选择性,为药物研发提供指导。[/font][font=宋体]③临床诊断:泛素化蛋白质组学鉴定与定量分析技术可以揭示细胞调控的机制,通过分析泛素化蛋白质的组学数据,可以确定泛素化修饰在细胞信号转导、蛋白质降解和细胞周期调控等过程中的重要作用。此外,通过比较病态和正常样品中泛素化蛋白质的差异,可以鉴定与疾病发生发展相关的泛素化修饰靶点,并进一步理解疾病的分子机制。因此,这些技术也可用于临床诊断。[/font][font=宋体]④蛋白质降解调控:在癌症、神经退行性疾病和免疫相关疾病等病症中,蛋白质降解调控出现异常。而泛素化蛋白组在调控蛋白质降解中发挥重要作用。通过与泛素连接,目标蛋白质被送入蛋白酶体或蛋白酶体样体中进行降解。这个过程是细胞清除异常、老化或受损蛋白质的重要途径。[/font][font=宋体]⑤高通量技术应用:高通量泛素化蛋白质组学鉴定与定量分析技术的发展包括质谱鉴定和抗体鉴定两种方法。质谱鉴定技术利用质谱仪的高灵敏度和分辨率,能够鉴定泛素化修饰的蛋白质及其泛素化位点。抗体鉴定技术则通过特异性抗体的使用,可以富集和鉴定泛素化修饰的蛋白质。这些技术为全面了解泛素化在细胞中的作用机制和调控网络提供了可能。[/font][font=宋体]总的来说,泛素化蛋白质组学在多个领域都有重要的应用价值,推动了我们对生命过程的深入理解以及疾病治疗的创新发展。[/font][font=宋体] [/font][font=宋体]更多详情关于[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url]详情可以参看:[/font][url=https://cn.sinobiological.com/resource/protein-review][u][font=宋体][color=#0000ff][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/color][/font][/u][/url][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]

各位老師您好我用的儀器是賽曼背景校正的AA分析蛋白質與血漿內Se元素目前遇到問題,背景值一直都很高不知道是改進劑還是升溫條件有問題請各位老師可以給點意見 http://ng1.17img.cn/bbsfiles/images/2012/04/201204120918_360806_2232331_3.jpg
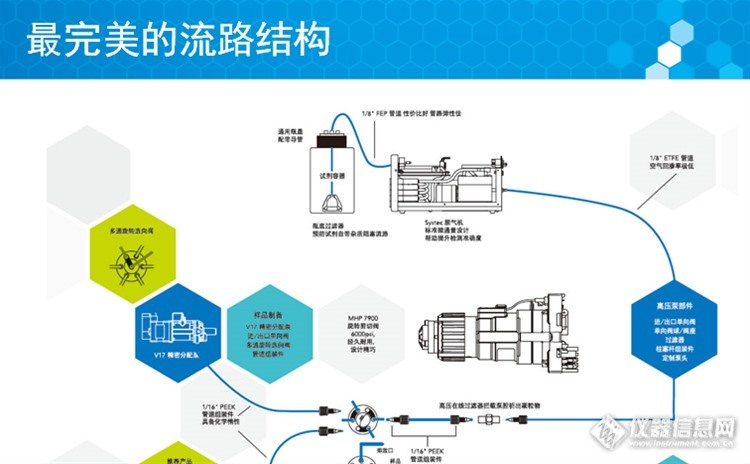
糖尿病是一种慢性病,随着经济生活水平的提高和社会老龄化的加剧,近年来患者人数在全球包括中国逐年递增,目前已严重威胁到国民的健康。对糖尿病的监测也越来越受到国家和人们的重视。作为全球公认的糖尿病检测"金标准",糖化血红蛋白(HbA1c)能够稳定可靠地反映出受检人在检测前90天到120天内的平均血糖水平,不受抽检时间、空腹与否或胰岛素等因素的干扰,经过国际临床化学和实验室医学联盟(IFCC)的技术验证和推广使用,使得糖化血红蛋白检测已成为诊断糖尿病的一种趋势。我们国家也参考国际公认的HPLC-LC-MS/MS方法,已经基本建立了自己的糖化血红蛋白检测一级参考体系。http://ng1.17img.cn/bbsfiles/images/2015/10/201510221629_570638_1587_3.jpg糖尿病检测方法以及主流仪器分析使用最先进的流体技术和产品,为您打造最优秀的HbA1c分析仪项目难度以及如何解决各类流路问题糖化血红蛋白(HbA1c)分析仪市场情况以及前景分析立即报名参与讲座:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1689
不知有谁使用过这个机器,是否能提供DU530核酸/蛋白分析仪使用说明书,谢谢!
请教一下各位:用氨基酸分析仪能检测皮革水解蛋白吗?
[size=16px]素食者在蛋白质摄入上一直面临着挑战,尽管素食食品富含多种营养成分,但素食者在蛋白质摄入方面存在不足。首先,植物性食品中的蛋白质含量相对较低,且氨基酸组成不如动物性蛋白完整,素食者需要摄入更多的植物性食品才能满足蛋白质的需求。然而,过多的植物性食品摄入可能导致热量过剩、膳食纤维过多等问题。其次,一些素食者可能存在对某些植物性食品的过敏或不耐受情况,例如大豆、坚果等食品中的蛋白质可能引发人体过敏反应,而谷物中的麸质[i][/i]则可能引起不耐受反应等。此外,植物性蛋白质的生物利用率较低,需要素食者通过合理搭配食物来提高蛋白质的摄入效率。[/size][size=16px]在传统素食者蛋白质摄入不足的背景下,素食蛋白棒产品正逐渐在素食者中普及起来。[/size][size=16px]素食蛋白棒是一种高蛋白、低脂肪、便携的零食,能够方便素食者在日常饮食中补充蛋白质,满足素食者对蛋白质的需求。素食蛋白棒的热量和脂肪含量相对较低,使得素食者可以在控制热量摄入的同时,获得足够的蛋白质补充。[b]一是丰富的营养价值[/b]:作为素食蛋白棒中重要蛋白来源的酵母蛋白,是一种来源于酿酒酵母的优质完全蛋白,拥有高蛋白质含量与优质氨基酸配比,其蛋白质含量高达80%以上,富含人体所需的全部8种必需氨基酸,且其氨基酸配比合理,易被人体吸收利用。酵母蛋白除了赋予素食蛋白棒高蛋白质含量外,还提供B族维生素和矿物质等多种营养成分,有助于维持身体的正常代谢和健康状态。研究表明,酵母蛋白中的活性成分能够调节肠道菌群平衡,促进有益菌的增殖,抑制有害菌的生长,从而改善肠道环境,提高肠道健康水平。[b]二是环保与可持续性和性价比优势[/b]:酵母蛋白来源于微生物发酵,相比动物源蛋白和植物源蛋白更加环保和可持续,它不需要大量的土地、水和饲料资源,也不产生温室气体排放。目前,酵母蛋白的生产已完全工业化,生产效率高、成本低,使得酵母蛋白与乳清蛋白等动物蛋白相比在价格上具有一定的优势,同时避免了动物源蛋白和植物源蛋白可能带来的过敏源问题。[/size]
[font=宋体][font=宋体]生物素[/font][font=Calibri]-[/font][font=宋体]亲和素系统 [/font][font=Calibri](biotin-avidin system[/font][font=宋体],[/font][font=Calibri]BAS)[/font][font=宋体],是[/font][font=Calibri]70[/font][font=宋体]年代后期应用于免疫学,并得到迅速发展的一种常用的生物反应放大系统。它具有高度特异性、敏感性、稳定性的特点,两者的亲和常数([/font][font=Calibri]K=1015 mol/L[/font][font=宋体])比抗原[/font][font=Calibri]-[/font][font=宋体]抗体([/font][font=Calibri]K=105[/font][font=宋体]~[/font][font=Calibri]1011 mol/L[/font][font=宋体])至少高[/font][font=Calibri]1[/font][font=宋体]万倍,是目前已知强度最高的非共价作用,这使得生物素标记的蛋白成为研究蛋白质相互作用和筛选抗体或小分子潜力药物的强大工具。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州开发了丰富的生物素标记蛋白产品,拥有[/font][font=Calibri]Avi-tag[/font][font=宋体]定点标记和化学标记两种类型的生物素标记蛋白,覆盖细胞治疗、抗体药、疫苗等热门靶点。产品具有高批间一致性、高活性等优势,适用于[/font][font=Calibri]ELISA[/font][font=宋体]、[/font][font=Calibri]Biopanning[/font][font=宋体]、[/font][font=Calibri]SPR / BLI[/font][font=宋体]等实验。下面为大家提供生物素蛋白标记常见问题及注意事项:[/font][/font][font=宋体] [/font][font=宋体][b]生物素蛋白标记常见问题:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、什么是生物素标记蛋白[/font][font=Calibri]?[/font][/font][font=宋体][font=宋体]在生物化学中,生物素化蛋白质就是生物素与蛋白质等大分子物质共价结合的产物。生物素[/font][font=Calibri]-[/font][font=宋体]亲和素亲和常数至少比抗原[/font][font=Calibri]-[/font][font=宋体]抗体高一万倍[/font][font=Calibri],[/font][font=宋体]是目前发现的自然界中具有最强亲和力的物质。因此,生物素[/font][font=Calibri]-[/font][font=宋体]亲和素系统已被广泛地应用于免疫诊断技术。生物素化蛋白的出现,也为类似于[/font][font=Calibri]WB[/font][font=宋体]实验简化了流程,提高了效率。此外,由于生物素的小尺寸([/font][font=Calibri]MW = 244.31g / mol[/font][font=宋体]),不太影响蛋白质本身的天然功能。所以它同时具备了高亲和力、高特异性、高灵敏度的优点。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、生物素标记蛋白有哪些应用?[/font][/font][font=宋体][font=宋体]生物素标记蛋白广泛的应用在生物技术的众多领域。如透析,将具有特殊结构的亲和分子制成固相吸附剂放置在层析柱中,当要被分离的蛋白混合液通过层析柱时,与吸附剂具有亲和能力的蛋白质就会被吸附而滞留在层析柱中。那些没有亲和力的蛋白质由于不被吸附,直接流出,从而与被分离的蛋白质分开,然后选用适当的洗脱液,[/font] [font=宋体]改变结合条件将被结合的蛋白质洗脱下来。怎么释放所需蛋白呢?这需要非常严苛的条件(例如,[/font][font=Calibri]pH=1.5[/font][font=宋体]的 [/font][font=Calibri]GuHCl[/font][font=宋体]),这种极端条件下的蛋白是会变性的。如果需要分离标记的蛋白质,最好用亚氨基生物素标记的蛋白质。该种生物素在碱性条件下与抗生物素蛋白结合紧密,但是在降低[/font][font=Calibri]pH[/font][font=宋体]以后,亲和力降低。因此亚氨基生物素标记蛋白可以通过降低[/font][font=Calibri]pH([/font][font=宋体]约[/font][font=Calibri]pH=4)[/font][font=宋体]从柱子上释放。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫检测中的应用:在常规[/font][font=Calibri]ELISA[/font][font=宋体]原理的基础上,结合生物素[/font][font=Calibri](B)[/font][font=宋体]与亲和素[/font][font=Calibri](A)[/font][font=宋体]间的高度放大作用,而建立的一种检测系统。生物素很易与蛋白质[/font][font=Calibri]([/font][font=宋体]如抗体等[/font][font=Calibri])[/font][font=宋体]以共价键结合。这样,结合了酶的亲和素分子与结合有特异性抗体的生物素分子产生反应,既起到了多级放大作用,又由于酶在遇到相应底物时的催化作用而呈色,达到检测未知抗原[/font][font=Calibri]([/font][font=宋体]或抗体[/font][font=Calibri])[/font][font=宋体]分子的目的。 这可以用于通过荧光或电子显微镜定位的[/font][font=Calibri]ELISA[/font][font=宋体]测定,[/font][font=Calibri]ELISPOT[/font][font=宋体]测定,[/font][font=Calibri]western[/font][font=宋体]印迹和其他免疫分析方法。[/font][/font][font=宋体] [/font][font=宋体][b]生物素标记注意事项:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、依抗原或抗体分子所带可标记基团的种类(氨基、醛基或巯基)以及分子的酸碱性,选择相应的活化生物素和反应条件;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、标记反应时,活化生物素与待标记抗原或抗体应有适当的比例;生物素:[/font][font=Calibri]IgG [/font][font=宋体]用量比[/font][font=Calibri](mg/mg)[/font][font=宋体]宜为[/font][font=Calibri]2:1, IgG[/font][font=宋体]应用浓度[/font][font=Calibri]0.5~5[/font][font=宋体]μ[/font][font=Calibri]g/ml [/font][font=宋体]生物素[/font][font=Calibri]1~3[/font][font=宋体]个[/font][font=Calibri]/Ag[/font][font=宋体],[/font][font=Calibri]3~5[/font][font=宋体]个[/font][font=Calibri]/Ab[/font][font=宋体];[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、为减少空间位阻影响,可在生物素与被标记物之间加入交联臂样结构;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4[/font][font=宋体]、生物素与抗原、抗体等蛋白质结合后,不影响后者的免疫活性;标记酶时则结果有不同。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/category/biotinylated-protein-elite][b]生物素标记蛋白[/b][/url]详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/category/biotinylated-protein-elite[/font][/font][font=宋体] [/font]
牛奶蛋白质分析仪的原理主要基于光学测量技术,特别是光谱分析法。具体地说,它采用红外光谱法来测量牛奶中乳清蛋白和酪蛋白的含量。首先,将牛奶样品制成透明薄片,然后使用近红外光电传感器和光源对其进行扫描。牛奶中的蛋白质对特定波长的红外光有特定的吸收特性,通过测量这些吸收特性,可以分析出牛奶中蛋白质的种类和含量。此外,仪器会将牛奶光谱与事先建立的标准光谱进行比较,通过复杂的算法处理,从而得出各种蛋白质形态的含量。这种比较和计算过程确保了测量结果的准确性和可靠性。总的来说,牛奶蛋白质分析仪通过光学测量和光谱分析技术,能够快速、准确地测定牛奶中蛋白质的含量和种类,为乳制品生产、质量控制和科学研究提供了有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404291701212298_2595_6238082_3.jpg!w690x690.jpg[/img]
[font=宋体]蛋白表达系统指宿主、外源基因、载体和辅助成分组成的体系,通过这个体系可以实现外源基因顺利的实现在宿主中表达。[b]蛋白表达体系通常由以下几部分组成:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]宿主:用来表达的生物体,可以为细菌(大肠杆菌、枯草芽孢杆菌)、酵母、植物细胞、动物细胞等。由于各种宿主生物本身的特性多种多样,因此采用的表达体系也不相同[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]载体:载体的选择需要根据宿主而定,根据宿主不同,分为原核(大肠杆菌、枯草芽孢杆菌)表达载体、酵母表达载体、植物表达载体、哺乳动物表达载体、昆虫表达载体等。载体中还有外源基因片段,外源基因通过载体介导,可以在宿主中表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]辅助成分:有的表达系统中还包括了协助载体进入宿主的辅助成分,比如:昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒表达系统中的杆状病毒。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白表达的三个主要系统是细菌表达系统(例如乳酸乳球菌和大肠杆菌)、酵母和杆状病毒以及哺乳动物细胞介导的蛋白表达。[/font] [/font][font=宋体] [/font][b][font=宋体]应用:[/font][/b][font=宋体] [/font][font=宋体]表达后的蛋白常应用于:[/font][font=宋体][font=Calibri]1[/font][font=宋体])作为抗原制备抗体;[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体])参与细胞实验与动物实验;[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体])测定蛋白酶活;[/font][/font][font=宋体][font=Calibri]4[/font][font=宋体])研究蛋白相互作用;[/font][/font][font=宋体][font=Calibri]5[/font][font=宋体])研究蛋白结晶结构;[/font][/font][font=宋体][font=Calibri]6[/font][font=宋体])免疫组化实验;[/font][/font][font=宋体][font=Calibri]7[/font][font=宋体])药物蛋白研究、生产等。[/font][/font][font=宋体] [/font][b][font=宋体]影响蛋白表达的因素有:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]蛋白本身的特性:蛋白分子量大小、蛋白来源[/font][font=Calibri]/[/font][font=宋体]物种、是否为毒性蛋白,蛋白翻译后修饰程度、蛋白自身结构的复杂程度[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]宿主的选择:宿主本身的特性、蛋白表达需求等都影响着蛋白表达[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]蛋白需求量:蛋白应用范围对应的需求量不同,所以要根据需求量确定表达系统[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]质粒载体的选择:载体是携带外源基因的工具,要根据系统选择合适的载体才能使蛋白更好的表达[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]融合标签的选择:蛋白重组表达过程中采用亲和标签融合表达有两方面的作用:一方面是为了使蛋白纯化过程变得更加容易;另一方面是为了促进某些不溶性蛋白可溶[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]蛋白表达系统的优化:重组蛋白的表达往往不像理论那样一帆风顺,在实际的表达过程中有可能产生各种各样的问题,因此表达系统的优化很重要。[/font][/font][font=宋体] [/font][b][font=宋体]如何选择合适的表达系统[/font][/b][font=宋体]没有一个表达系统是完美的,要针对每个重组蛋白来评估哪种系统最有效。每个蛋白表达系统的生产速度、成本、糖基化和折叠等特性都各不相同,且跨度很大。如下图:[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-production-systems][b]蛋白表达系统[/b][/url][/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production-systems[/font][/font]
请问用酶标仪怎么检测奶牛饲料中的蛋白与黄曲霉素??
维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维定性分析的研究维纶基大豆蛋白纤维是迄今为止我国获得的唯一完全知识产权的纤维发明,在纺织行业得到了快递的发展,广泛的应用,但与维纶基大豆蛋白纤维一样由我国企业自主研发的维纶基牛奶蛋白纤维也申请到专利好几年了,但迟迟没有相关标准的出台,使这一我国自主研发的新型纤维得不到有效利用新型纤维的不断推出,为我们提供了更多的纤维原料,但同时由于国家标准的相对滞后,给检测工作者带来了很大的难题,下面就目前市场上两种新型蛋白复合纤维给予试验,进行定性分析。主要原理是在观察了维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维显微结构和燃烧性状后,研究两者在常用化学试剂中的溶解性。试验结果表明,维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维在88%甲酸和浓硝酸中都能够部分溶解;在沸腾水浴中,维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维能够完全溶解于75%硫酸和98%硫酸牛奶蛋白纤维是再生蛋白质纤维,是以牛奶为原料经脱水、脱脂、分离、纯化、浓缩制成牛奶酪蛋白,与高分子化合物共混、共聚制成纺丝液,再经湿法纺丝而成;牛奶酪蛋白与聚乙烯醇制得的纤维称为维纶基牛奶蛋白纤维;牛奶酪蛋白与纤维素共聚制得粘胶基牛奶蛋白纤维。牛奶蛋白纤维含有多种氨基酸,具有良好的亲肤性和吸湿导湿性,抗菌防蛀,服用性强,受到消费者的青睐。维纶基牛奶蛋白纤维呈浅黄色,是由牛奶酪蛋白和聚乙烯醇大分子共混、共聚、醛化、揉和、脱泡,湿法纺成的纤维,克服了合成纤维吸湿性差和天然纤维强度低的不足,其比电阻介于天然纤维和合成纤维之间,吸湿性也优于聚乙烯醇纤维,在直接染料、弱酸性染料、活性染料和中性染料中都有良好的上染能力。本文在观察维纶基牛奶蛋白纤维和维纶基大豆蛋白纤维显微结构和燃烧性状后,研究两者在常用化学试剂中的溶解性,为纤维检测提供参数。大豆蛋白纤维属于再生植物蛋白纤维类,是以榨过油的大豆豆粕为原料,利用生物工程技术,提取出豆粕中的球蛋白,通过添加功能性助剂,与腈基、羟基等高聚物接枝、共聚、共混,制成一定浓度的蛋白质纺丝液,改变蛋白质空间结构,经湿法纺丝而成. 其有着羊绒般的柔软手感,蚕丝般的柔和光泽,棉的保暖性和良好的亲肤性等优良性能,还有明显的抑菌功能,被誉为“新世纪的健康舒适纤维”。大豆纤维是以脱去油脂的大豆豆粕作原料,提取植物球蛋白经合成后制成的新型再生植物蛋白纤维,是由我国纺织科技工作者自主开发,并在国际上率先实现了工业化生产的高新技术,也是迄今为止我国获得的唯一完全知识产权的纤维发明。1 试验1. 1试验材料、仪器和试剂纤维细度成分显微分析仪,万分之一电子天平;SHA-C水浴振荡器;鼓风恒温烘箱; 索氏萃取器;酒精灯;具塞三角瓶若干。甲酸(88%);硫酸(75%);浓硫酸(98%);浓硝酸;1MOL/L次氯酸钠溶液;石油醚(馏程为40℃~60℃)。1.2试验方法显微结构试验:用纤维细度成分显微分析仪观察纤维的显微结构。 以下试验维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维同一方法分别做一次燃烧性状试验:点燃酒精灯,用镊子夹取10mg左右纤维束,徐徐靠近火焰,观察试样对热的反应情况。将纤维移入火焰,观察纤维的燃烧情况;然后离开火焰,观察纤维的燃烧情况,并用鼻子闻试样燃烧刚熄灭的气味。最后,待试样熄灭冷却,观察残留物灰分的状态。预处理:取纤维5g左右,用定量滤纸包好,置于索氏萃取器中,用石油醚萃取1h,每小时至少循环6次,待试样中的石油醚挥发后,把试样浸入冷水中浸泡1h,再在(65±5)℃的水中浸泡1h,浸泡过程中时时搅拌。水(mL)与试样(g)之比为100:1。然后抽吸脱水,晾干。溶解性试验:准确称取试样1g置于具塞三角瓶中,加入100mL化学试剂,在搅拌条件下观察不同温度下纤维和试剂随时间的变化情况。待一定时间后,洗涤,抽吸排液,烘干。2 试验结果2.1显微结构在显微镜下观察维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维的横截面呈腰圆形或哑铃形,纵向有沟槽,两种纤维在显微镜下几乎无差别,无法区分这两种纤维。2.2燃烧性状维纶基牛奶蛋白纤维与维纶基大豆蛋白纤维靠近火焰时现象都是熔融并卷曲;进入火焰,熔融、卷曲并燃烧;离开火焰,燃烧,有时会自然熄灭。燃烧过程中散发出蛋白质燃烧时所特有的臭味。纤维燃烧的一端形成黑褐色硬块。两种纤维在燃烧情况下,火焰颜色,气味几乎无差别,无法区分这两种纤维。2.3溶解性取维纶基牛奶蛋白纤维与和维纶基大豆蛋白纤维分别置于88%甲酸、75%硫酸、浓硫酸、浓硝酸和1MOL/L次氯酸钠溶液中进行溶解性试验, 品名/溶液88%甲酸[/ali
[font=宋体][url=https://cn.sinobiological.com/resource/protein-review/sumo-tag-purification][b][font=Calibri]SUMO [/font][font=宋体]([/font][font=Calibri]small ubiquitin-like modifier[/font][/b][/url][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/sumo-tag-purification][b])标签蛋白[/b][/url]是一种小分子泛素样修饰蛋白,研究发现[/font][font=Calibri]SUMO[/font][font=宋体]可以作为重组蛋白表达的融合标签和分子伴侣,不但可以进一步提高融合蛋白的表达量,且具有抗蛋白酶水解以及促进靶蛋白正确折叠,提高重组蛋白可溶性等功能。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]SUMO[/font][font=宋体]蛋白最早于[/font][font=Calibri]1996[/font][font=宋体]年在酵母中发现其修饰的蛋白,后来发现从酵母到真核细胞都有泛素化修饰的蛋白。泛素化修饰作为一种很常见的蛋白翻译后修饰,也是目前一个研究热点。目前研究发现真核细胞中有多种[/font][font=Calibri]SUMO[/font][font=宋体]蛋白, [/font][font=Calibri]SUMO[/font][font=宋体]化主要修饰蛋白质的赖氨酸残基,[/font][font=Calibri]SUMO[/font][font=宋体]化修饰是一个动态可逆的过程,通过修饰解离动态调节蛋白结构以维持不同的生理功能。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]SUMO[/font][font=宋体]作为融合标签蛋白的优势[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]与[/font][font=Calibri]MBP,GST,GFP,TrX[/font][font=宋体]等标签比较具有更大优势:[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]促进靶蛋白可溶性表达;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]作为伴侣蛋白,促进蛋白质正确折叠;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]对热和蛋白酶有很强的耐受性;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]有配套的特异性蛋白酶可以切除标签,精准结构性识别,相比较于以来蛋白氨基酸序列的酶切位点具有更好的特异性;[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5. [/font][font=宋体]标签的分子量较小,相对于目标蛋白占比性较高。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]SUMO[/font][font=宋体]在蛋白质表达中的应用[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]Sumo[/font][font=宋体]融合标签被广泛的应用于原核表达系统,除了用于常规蛋白的表达外还用于毒性蛋白,抗菌肽,蛋白二聚体的表达;但是其不能用于真核表达系统,原因是真核细胞内有[/font][font=Calibri]SUMO[/font][font=宋体]蛋白酶。但是道高一尺,魔高一丈,目前已经有公司开发出既可用于真核又可用于原核系统的[/font][font=Calibri]SUMO[/font][font=宋体]标签,以及配套的蛋白酶。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/sumo-tag-purification[/font][/font]
http://img.dxycdn.com/trademd/upload/asset/meeting/2013/09/06/A1378379551.jpg 氨基酸是蛋白质的基础组成单位,通过研究蛋白质中氨基酸的性质和组成来预测蛋白质的结构和功能,蛋白质氨基酸残基组成分析主要是通过氨基酸分析仪来完成的,本文推荐了2个基于氨基酸组成进行蛋白质预测软件。基于氨基酸组成的蛋白质预测软件根据组成蛋白质的20种氨基酸的物理和化学性质可以辨析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包包涵的程序:AACompIdent:与把氨基酸序列在SWISS-PROT库中搜索不同,AACompIdent工具利用未知蛋白的氨基酸组成去确认具有相同组成的已知蛋白。该程序分析时需提交的相关信息包括:蛋白质的氨基酸组成、等电点pI和分子量(如果知道)、正确的物种分类及特别的关键词。此外,用户还需在六种氨基酸“组合”中作出选择,这影响到分析如何进行。例如,某种“组合”会把残基Asp/Asn(D/N)和Gln/Glu(Q/E)组合成 Asx(B)和Glx(Z);或者某种残基会在分析中被完全除去。对数据库中的每一个蛋白序列,算法会对其氨基酸组成与所查询的氨基酸组成的差异打分。由电子邮件返回的结果被组织成三级列表:第一张列表中的蛋白都基于特定的物种分类而不考虑pI和分子量;第二张列表包含了不考虑物种分类、pI和分子量的全体蛋白;第三张列表中的蛋白不但基于特定物种分类,并且将 pI和分子量也考虑在内。虽然计算所得结果各不相同,但零分表明了该序列与提出的组成完全相符。AACompSim:AACompIdent的一个变种,AACompSim提供类似的分析,但与前者以实验所得的氨基酸组成为依据进行搜索不同,后者使用SWISS-PROT中的序列为依据。有报道称,氨基酸组成在物种之间是十分保守的(Cordwell等,1995),并且通过分析氨基酸的组成,研究者能从低于25%序列相似性的蛋白之间发现弱相似性(Hobohm和Sander,1995)。因此,在“传统的”数据库搜索基础上辅以组成分析,能为蛋白质之间关系提供更多见解。PROSEARCH:PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。分子量搜索(MOWSE)分子量搜索(MolecularWeightSearch,MOWSE)算法利用了通过质谱(MS)技术获得的信息。利用完整蛋白质的分子量及其被特定蛋白酶消化后产物的分子量,一种未知蛋白质能被准确无误地确认,给出由若干实验才能决定的结果。由于未知蛋白无需再全部或部分测序,这一方法显著地减少了实验时间。MOWSE的输入是一个纯文本文件,包含一张实验测定的肽段列表,分子量范围在0.7到4.0Kda之间。计算过程基于在OWL非冗余蛋白质序列库中包含的信息。打分基于在一定分子量范围内蛋白中一个片段分子量出现的次数。输出的结果是得分最佳的30个蛋白的列表,包括它们在OWL中的条目名称、相符肽段序列、和其它统计信息。模拟研究得出在使用5个或更少输入肽段分子量时,准确率为99%。该搜索服务可通过向mowse@daresburg.ac.uk发送电子邮件实现。为获得更多关于查询格式的细节信息,可以相该地址发送电子邮件,并在消息正文中写上“help”这个词。蛋白质氨基酸组成分析用盐酸在110 ℃将蛋白或多肽水解成游离的氨基酸,用氨基酸分析仪测定各氨基酸的含量。采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。仪器基本结构同普通HPLC相似,但针对氨基酸分析进行了细节优化(例如氮气保护、惰性管路、在线脱气、洗脱梯度及柱温梯度控制等等)通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。分析效果:从目前已知的氨基酸分析方法比较来看,除灵敏度(即最低检测限)比HPLC柱前衍生方法稍低以外(HPLC:0.5 pmol;氨基酸分析仪:10 pmol),其他如分离度、重现性、操作简便性、运行成本等方面,都优于其他分析方法。蛋白质氨基酸残基组成分析的主要步骤包括:首先是蛋白被水解为氨基酸,其次是采用离子色谱等方法进行游离的氨基酸含量和组成的分析。总之利用蛋白可以分析氨基酸,利用氨基酸也可以研究蛋白质。
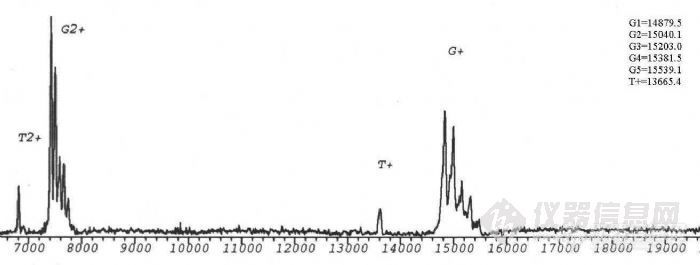
生物质谱在糖蛋白结构分析中的应用项目完成人:桑志红 蔡 耘项目完成单位:国家生物医学分析中心 随着人们对糖蛋白参与生命活动机理的日益深入了解,对天然糖蛋白及重组糖蛋白类药物的分析越来越受到重视。重组糖蛋白类药物的质量控制更是直接关系到药物的疗效及至人类的健康。九十年代以来,随着带有反射功能的基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)和纳升电喷雾串联质谱(nano-ESI-Q-TOF)等具有软电离方式的现代质谱 技术的发展,质谱以其高灵敏度和强有力的分析混合物的能力,提供了生物大分子的分子量、序列、一级结构信息以及结构转换、修饰等方面的信息,使糖基化分析有了重要的进展。 通常研究糖蛋白的方法是把蛋白链上的寡糖切下来,分别研究蛋白部分和寡糖部分的结构,因此无法研究与两部分共同相关的结构问题,也不能区分不同糖基化位点上切下来的寡糖。自90年代初,国外有人开始用质谱法研究糖蛋白的结构,同时描述了各个位点的不均一性。我们用建立的现代生物质谱技术研究糖蛋白一级结构的方法,将其应用与基因重组糖蛋白的结构分析。为糖蛋白结构分析及基因重组糖蛋白类药物的质量控制提供新的手段。一、 生物质谱研究糖蛋白结构方法的建立实验所用仪器为:1.德国BRUKER 公司的REFLEXIII型基质辅助激光解吸附电离飞行时间质谱仪,N2激光器,波长337nm,线性飞行距离150cm,加速电压2kv。2.英国Micromass 公司Q-TOF型电喷雾串联质谱仪。源温80°C,气体流速40L/h,枪头电压650V,检测频率2.4S,氩气碰撞池压力6*10-5mbar。1. 基质的选择,在MALDI-TOF-MS分析中,基质起着相当重要的作用。不同的基质对不同类的物质响应不同,a-氰基-4-羟基肉桂酸用于测定糖蛋白核糖核酸酶B效果相对较好。2. 糖蛋白分子量的测定,糖蛋白核糖核酸酶B由124个氨基酸组成,在34位Asn处连有一个高甘露糖型N-糖链。由于糖链的微不均一性,与普通蛋白质及核酸不同,其分子离子峰在MALDI-TOF-MS 质谱图上表现为一簇峰,各峰之间约相差一个糖基。正是由于这种微不均一性,使得其分子离子峰变宽,灵敏度降低。糖链分子量越大,峰越宽,灵敏度越低,所以一般只有糖链较短,蛋白的质量不太大的糖蛋白才能测定其平均分子量。用MALDI-TOF可直接测定糖蛋白核糖核酸酶B的平均分子量为 15208.6Da。http://ng1.17img.cn/bbsfiles/images/2011/03/201103211511_284179_1604317_3.jpg3. 糖含量的测定,采用O聚糖酶及内糖苷键酶F分别作用于核糖核酸酶 B,只有内糖苷键酶F能够是其分子量发生变化,表明核糖核酸酶B分子中不存在O-连接糖链存在着N-连接糖链。内糖苷键酶F切断N-糖链五糖核心最内侧的GlcNAc-GlcNAc糖苷键,得到含一个GlcNAc的肽链,减去GlcNAc,可以计算出准确的肽链分子量T=13695.6,与糖蛋白平均分子量之差为糖链的平均分子量G=1513.4,平均糖含量为:(糖链大小/糖蛋白分子量)×100%=9.95%。4. 糖基化位点的确定,研究糖基化类型及糖基化位点的策略:采用蛋白酶酶解与糖苷内切酶酶解相结合的方法,通过酶切前后含糖肽片的位移,结合网上数据库检索,可以确定糖基化类型和糖基化位点。以不同类型的糖苷内切酶作用于糖蛋白(N-糖苷键酶或O-糖苷键酶),在MALDITOF-MS 上观察其质量的变化,可以直接确定糖蛋白中是否含有响应类型的糖链,这是我们确定糖蛋白中糖苷键类型的基础。我们采用先将核糖核酸酶B还原烷基化,加Glu-C酶切,产物再用内糖苷肩酶F酶切,可观察到含糖肽段出现位移,将核糖核酸酶B的肽质量指纹图进行数据库检索,证实发生位移的肽段中含有N-糖链特异连接位点,由此确定34位Asn为糖基化位点。另外我们采用内糖苷键酶F及肽-N-聚糖酶F两种酶进行差位酶切法对含糖肽段进行验证,两种酶酶切后分子离子峰的差值除以GlcNAc的质量,结果就是N-糖基化位点的个数5. 质谱测定氨基酸序列, 我们对核糖核酸酶B肽质量指纹谱中的含糖肽段进行了串联质谱测定,首先在一级质谱图中选择离子4972.23,在串联质谱的碰撞活化室以氩气与其碰撞产生碎片,从碎片的质荷比推算出此肽片中的一段氨基酸序列,检索结果为核糖核酸酶B,从而判断其理论序列是否一致。6. 糖链结构的研究,凝集素对糖肽的亲和提取,进一步分析糖肽序列及糖链结构的关键是含糖肽段的提取。核糖核酸酶B中糖链为高甘露糖型,我们选用对其有特异性吸附的伴刀豆球蛋白对其进行提取利用这种简捷的亲和质谱的方法,对糖肽段进行了分析。建立了亲和质谱分析糖肽类物质的方法,为今后糖肽序列分析及糖链结构分析奠定了基础。二、基因重组糖蛋白人促红细胞生成素(rhEPO)的结构分析。 利用以上建立的方法,我们对样品重组人促红细胞生成素进行了分析,断定此样品为非完全糖基化,样品中只存在N-连接的糖链,无O-糖链。应用酶切法用肽-N-聚糖酶处理后,得到两个含糖肽段,进行数据库检索,测得38位及83位为N-糖基化位点,与文献报道相符,结果可靠。因此,该项课
蛋白质分析仪的校准
蛋白分析系统在我们选择蛋白分析工具的时候,通常是根据不同的蛋白来选择不同的分析手段,如凝胶电泳、化学荧光染色、质谱等等。但是目前已经研制出的蛋白分析工具的种类繁多,从这一方面也在一定程度上反映了蛋白分析的复杂性。以下是一些近期推出的蛋白分析系统,希望能帮助您轻松完成研究工作。
[b][font=宋体][color=#060607]前言[/color][/font][/b][font=宋体][font=宋体]在生物医学研究领域,蛋白质的功能性鉴定及其在各种生物过程中的作用机制一直是科研人员关注的焦点。近年来,质谱技术因其高分辨率和高灵敏度在蛋白质组学研究中发挥着越来越重要的作用。然而,传统的质谱策略在鉴定具有特定生物功能的蛋白质亚群时,常常受到标记物与非标记物区分困难的限制。为了解决这一问题,科学家们开发了一种名为[/font][font=宋体]“直接检测含生物素标签的蛋白质”([/font][font=Calibri]Direct Detection of Biotin-containing Tags, DiDBiT[/font][font=宋体])的新技术,显著提高了生物素化蛋白质的直接检测效率。[/font][/font][font=Calibri] [/font][b][font=宋体][font=Calibri]DiDBiT[/font][font=宋体]技术检测方法[/font][/font][/b][font=宋体][font=Calibri]DiDBiT[/font][font=宋体]主要是利用质谱技术([/font][font=Calibri]MS/MS[/font][font=宋体])来直接检测含生物素的肽段,无需额外的实验步骤即可直接鉴定生物素化蛋白质。与传统的生物素蛋白质鉴定方法相比,[/font][font=Calibri]DiDBiT[/font][font=宋体]技术显著提高了检测的灵敏度和效率。[/font][font=Calibri]DiDBiT[/font][font=宋体]技术通过优化样品的预处理和质谱分析步骤来提高生物素化肽段的检测灵敏度。首先对细胞裂解物进行蛋白质消化,然后使用[/font][font=Calibri]NeutrAvidin[/font][font=宋体]珠子富集含生物素的肽段,最后进行质谱分析。这种方法的关键在于通过降低样品复杂性,提高了生物素标记肽段的检出率。[/font][/font][font=Calibri] [/font][b][font=宋体][font=Calibri]DiDBiT[/font][font=宋体]技术的应用[/font][/font][/b][font=Calibri]Lucio Matias[/font][font=宋体][font=宋体]等人采用[/font][font=Calibri]DiDBiT[/font][font=宋体]技术,在啮齿动物的神经系统中标记新合成的蛋白质,结果表明使用[/font][font=Calibri]DiDBiT[/font][font=宋体]技术提高了生物素标记新合成蛋白质的检测,与传统方法相比,检测灵敏度提高了约[/font][font=Calibri]20[/font][font=宋体]倍。他们还成功地应用[/font][font=Calibri]DiDBiT[/font][font=宋体]技术在成年大鼠视网膜中直接检测新合成的蛋白质,显示出前所未有的时间分辨率,短至[/font][font=Calibri]3[/font][font=宋体]小时。[/font][/font][font=宋体][font=宋体]此外,[/font][font=Calibri]DiDBiT[/font][font=宋体]技术具有高度的灵活性和可扩展性。它可以与其他蛋白质组学技术相结合,如蛋白质相互作用研究、蛋白质翻译后修饰分析等,从而为我们提供更为全面和深入的蛋白质功能信息。[/font][/font][font=宋体][font=Calibri]DiDBiT[/font][font=宋体]技术的应用展示了其在蛋白质组学研究中的广泛潜力,尤其是在快速鉴定特定细胞类型或生物学状态下新合成蛋白质的能力。此技术不仅提高了实验的准确性和效率,而且通过直接检测生物素化肽段,显著简化了实验流程,降低了实验的复杂性和成本。[/font][/font][font=Calibri] [/font][b][font=宋体]结论[/font][/b][font=宋体][font=Calibri]DiDBiT[/font][font=宋体]技术提供了一种强大的工具,用于在复杂生物样本中直接鉴定和分析含生物素的蛋白质。这种高灵敏度和高分辨率的策略适用于广泛的生物标记策略和样本准备,显著提高了从样本中区分真实候选物和污染物的能力。此技术特别适用于含量较少的生物素化蛋白质的研究,为蛋白质组学和细胞生物学提供了新的研究工具。[/font][/font][font=Calibri] [/font][font=宋体]本篇文章由义翘神州编辑整理,同时义翘神州提供[/font][url=https://cn.sinobiological.com/category/biotinylated-protein-elite][u][font=宋体][color=#0000ff][b]生物素标记蛋白[/b][/color][/font][/u][/url][font=宋体],更多详情可以点击查看![/font][font=宋体]参考文献:[/font][font=宋体][font=Calibri]Schiapparelli LM, McClatchy DB, Liu HH, Sharma P, Yates JR 3rd, Cline HT. Direct detection of biotinylated proteins by mass spectrometry. J Proteome Res. 2014 13(9):3966-3978. doi:10.1021/pr5002862[/font][/font]
把蛋白完全水解成氨基酸,可以在pmol到nmol水平上分离和定量。虽然氨基酸的序列信息已经无法得到,但是组成蛋白的氨基酸种类及含量信息可以得到,利用氨基酸的指纹信息可以鉴定蛋白。
1、雷公藤红素抑制CML细胞增殖作者首先进行了网络药理学分析,以评估在治疗CML方面最有效的天然产物。通过对3882种天然产物进行了网络药理学分析,发现从传统中药“雷公藤”(Tripterygium wilfordii)根皮中提取的五环三萜雷公藤红素在抑制CML方面排名第一。为了验证网络药理学筛选的可靠性,作者在CML细胞中进行细胞活力测定。选择18β-甘草次酸作为阴参,因为它与雷公藤红素的结构最相似,但在3882 种天然产物中预测得分不高,选择17-AAG(HSP90抑制剂,已有文章报道HSP90是雷公藤红素的靶点)和TKI 药物伊马替尼作为阳参。结果表明雷公藤红素、17-AAG和伊马替尼均能有效抑制CML细胞增殖,而18β-甘草次酸几乎不影响细胞生长。作者进一步开展细胞实验,发现雷公藤红素对K562和K562T315I细胞表现出抗增殖活性,诱导细胞凋亡。尽管对雷公藤红素的研究很深入,但尚未系统地鉴定出雷公藤红素在CML中的直接蛋白质靶点,尤其是在耐药性CML细胞中 雷公藤红素抑制CML细胞增殖2、雷公藤红素处理后 K562T315I 细胞的转录组和蛋白质组学分析接着,作者通过RNA 测序发现富集的通路包括铁死亡、蛋白水解调节、响应p53介导的DNA损伤等。作者还进行了蛋白质组学分析雷公藤红素对K562T315I细胞中蛋白质表达水平的调节,下调蛋白主要富集于DNA和RNA代谢途径以及 DNA损伤反应,以及蛋白质加工途径。MCODE分析发现“对DNA损伤刺激的反应”和“对未折叠蛋白的反应”分别是最具特征性的途径。雷公藤红素与其已知靶标HSP90的相互作用可能是“对未折叠蛋白的反应”上调的关键贡献事件。而目前尚未有报道称雷公藤红素的直接蛋白质靶标与“对DNA损伤刺激的反应”途径有关( 雷公藤红素处理后 K562T315I 细胞的定量蛋白质组学分析3、雷公藤红素处理后 K562T315I 细胞的CETSA-MS分析作者接着检测了K562T315I细胞中celastrol处理后可溶性蛋白质水平的变化,在雷公藤红素处理后鉴定了178种差异溶解蛋白质,主要位于DNA中心区域,包括细胞核和线粒体,更具体地说是在DNA损伤位点。此外,“分子伴侣复合物”中溶解度降低,这可能是由于雷公藤红素和HSP90之间的互作所致 雷公藤红素处理后 K562T315I细胞的CETSA-MS分析4、雷公藤红素诱导 K562T315I 细胞DNA损伤对 K562T315I细胞经雷公藤红素处理后总蛋白和可溶性蛋白水平变化的系统分析表明,雷公藤红素主要诱导K562T315I细胞中的DNA损伤和未折叠蛋白反应。因此,作者进行了实验来验证这些观察结果。结果显示雷公藤红素显著诱导γ-H2AX(DNA损伤的常见标志物)的表达,并降低DNA损伤修复相关蛋白FANCD2水平,彗星试验进一步证实了雷公藤红素促进的DNA损伤( 雷公藤红素诱导 K562T315I细胞DNA损伤5、雷公藤红素在K562T315I细胞中的靶点鉴定然后,作者在细胞裂解物中开展质谱耦合等温剂量反应-细胞热位移分析(MS-ITDR-CETSA)实验,以确定雷公藤红素的直接蛋白质靶标,特别是那些参与DNA损伤反应的蛋白质靶标。在检测到的3393种蛋白质中,有12种蛋白质表现出热稳定性的显著变化,代表了最有潜力且可信度高的靶标蛋白质。值得注意的是,雷公藤红素的已知靶标HSP90 (HSP90AA1和HSP90AB1) 的热稳定性仅表现出很小的变化,并且没有超过阈值。对这12个潜在靶标和定量蛋白质组学以及CETSA-MS分析的差异蛋白进行PPI分析,发现 YY1均为最紧密相关的蛋白质。因此,YY1与所有这些DEP/DSP的关联节点数量最多,并且可能是与DNA损伤相关的最重要的靶标。现有研究表明,YY1作为转录因子,可以调节参与DNA修复和细胞存活的各种蛋白质的表达,以响应DNA损伤。此外,HMCES已被确定为通过屏蔽脱碱基位点来保护基因组完整性免受氧化碱基损伤的关键蛋白。因此,作者继续通过蛋白质印迹结合细胞热位移分析(WB-CETSA)验证了celastrol与YY1和HMCES的互作。同样,报道的阳性对照HSP90蛋白也显示出明显的热稳定性增加( 雷公藤红素在K562T315I细胞中的靶点鉴定6、雷公藤红素与YY1和HMCES相互作用的验证为了进一步验证celastrol与YY1和HMCES的直接相互作用,合成了可点击炔烃标签功能化celastrol探针(Cel-P),该探针保留了celastrol对K562T315I细胞的抑制活性。利用该探针开展Pulldown实验发现Cel-P 能够成功地从细胞中拉下HMCES和HSP90蛋白,但由于尚不清楚的原因,在蛋白质印迹膜上的下拉样本中未检测到YY1。随后,表达并纯化重组YY1(rYY1)蛋白,发现随着Cel-P浓度的增加,rYY1的标记以剂量依赖性方式增加 雷公藤红素与YY1和HMCES相互作用的验证7、雷公藤红素通过靶向YY1和HMCES诱导DNA损伤在验证了celastrol与YY1和HMCES之间的相互作用后,作者继续在K562T315I细胞中敲低 YY1或HMCES。结果显示YY1或HMCES的敲低显著增加了DNA损伤的发生率,同时影响细胞生长,增强细胞对celastrol的敏感性。此外,与HMCES相比,YY1敲低对细胞的影响更为显著,表明YY1发挥着更为重要的作用。对接分析显示,与HMCES相比,celastrol对YY1的亲和力略强,且Celastrol与YY1上的Leu132和Val316形成氢键,与HMCES的Glu127、Arg130和Arg137形成氢键 雷公藤红素通过靶向 YY1 和 HMCES 诱导 DNA 损伤鉴于YY1在雷公藤红素诱导的DNA损伤反应中发挥关键作用,作者对YY1蛋白进行了进一步实验。发现YY1过表达对细胞生长没有显著影响,但减轻了雷公藤红素引起的细胞死亡和DNA损伤,且通过裂解的PARP1和Caspase-3水平发现YY1表达与雷公藤红素诱导的细胞凋亡呈负相关。使用双荧光素酶报告基因发现雷公藤红素显著抑制了YY1的转录活性,BLI结合试验发现celastrol 可以与 rYY1 结合(图8)。图8 YY1在雷公藤红素诱导的 K562T315I细胞DNA损伤和细胞死亡中起关键作用总结研究使用多组学方法对雷公藤红素的作用机理进行了系统研究,利用蛋白质组范围的无标记靶标反卷积方法MS-CETSA来识别雷公藤红素的蛋白质靶标。研究不仅验证了雷公藤红素通过靶向HSP90来诱导未折叠蛋白反应,而且还发现它通过直接靶向耐药 K562T315ICML 细胞中的YY1和HMCES来诱导DNA损伤(图9)。研究有助于更好地理解雷公藤红素的多方面机制。研究提供了一种有效的系统药理学工作流程范例,该范例集成了网络药理学分析、蛋白质丰度和溶解度测量以及 MS-CETSA,以揭示任何天然产物或活性化合物的作用机理。
最近在做几个酸性蛋白的CIEF。贝克曼的方法比较适用于中性和偏碱性的蛋白分析,对于酸性蛋白分析效果不太理想。氨水迁移法比较适合酸性蛋白,但是据说很伤柱子,做不了几个样品。讨论一下,有没有人遇到同样的问题,是怎么优化方法的呢?我尝试调整占位剂的配比,暂时也没有得到理想的结果。
[font=Tahoma, Helvetica, SimSun, sans-serif, Hei]请问大家一个关于硫磺素T测淀粉样蛋白聚集的问题。是这样的,自由的硫磺素T的激发波长及发射波长分别为350及440;当其与淀粉样纤维结合时,其激发波长以及发射波长一定会红移至440(ex)以及482(em)吗?[/font]
我现在是一家科学仪器经销商的员工,主要为客户做售前选型方面的工作。以前学的是应用化学有机成型方向,有学过《仪器分析》但除了少量色谱和分光光度计的知识外很多已忘光。有在食品实验室工作经验但主要做水分、蛋白、粗脂肪等常规项目,色谱、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原吸[/color][/url]、原子荧光有看同事用过,自己在同事指导下完成过几次。现在想重点系统学习色谱、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原吸[/color][/url]、原子荧光、元素分析等实验室常用分析仪器的知识,群里做相关方面的厂家可否帮忙指导一下我该怎么做?顺便推荐些资料。我的目标是想自己在客户面前显得专业,能根据客户需求配置最优方案,及指导客户处理一些常见的故障。
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
目的要求(1)了解克隆基因表达的方法和意义。(2)了解重组蛋白亲和层析分离纯化的方法。实验原理克隆基因在细胞中表达对理论研究和实验应用都具有重要的意义。通过表达能探索和研究基因的功能以及基因表达调控的机理,同时克隆基因表达出所编码的蛋白质可供作结构与功能的研究。大肠杆菌是目前应用最广泛的蛋白质表达系统,其表达外源基因产物的水平远高于其它基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。本实验中,携带有目标蛋白基因的质粒在大肠杆菌BL21中,在 37℃,IPTG诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。试剂和器材一、试剂 LB液体培养基:Trytone 10g, yeast extract 5g, NaCl 10g, 用蒸馏水配至1000mL. 氨苄青霉素:100mg/mL 上样缓冲液:100 mM NaH2PO4, 10 mMTris, 8M Urea, 10 mM2-ME, pH8.0 Washing Buffer:100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3 Elution Buffer:100 mM NaH2PO4, 10 mMTris, 8M Urea, 500 mM Imidazole, pH8.0 IPTG二、器材摇床,离心机,层析柱(1′10 cm)操作方法一、氯霉素酰基转移酶重组蛋白的诱导1. 接种含有重组氯霉素酰基转移酶蛋白的大肠杆菌BL21菌株于5mL LB液体培养基中(含100ug/mL 氨苄青霉素),37℃震荡培养过夜。2. 转接1mL过夜培养物于100mL(含100ug/mL 氨苄青霉素)LB液体培养基中,37℃震荡培养至OD600 = 0.6 - 0.8。取10ul 样品用于SDS-PAGE 分析。3. 加入IPTG至终浓度0.5 mmol/l, 37℃继续培养1-3h.4. 12,000rpm 离心10 min, 弃上清,菌体沉淀保存于-20℃或-70℃冰箱中。二、氯霉素酰基转移酶重组蛋白的分离、纯化1. NTA层析柱的准备:在层析柱中加入1mL NTA介质,并分别用8mL 去离子水,8mL上样缓冲液洗涤。2. 重组蛋白的变性裂解:在冰浴中冻融菌体沉淀,加入5mL上样缓冲液, 用吸管抽吸重悬,超声波破裂菌体,用振荡器等轻柔的混匀样品60min, 4℃ 12000rpm 离心 30 min, 将上清吸至一个干净的容器中,并弃沉淀。取10ul 上清样品用于SDS-PAGE 分析。3. 上清样品以10-15mL/h 流速上Ni2+-NTA柱,收集流出液,取10ul样品用于SDS-PAGE 分析。4. 洗脱杂蛋白:用Washing Buffer以10-15mL/h流速洗柱,直至OD280 = 0.01.分步收集洗脱液,约3-4h,取10ul洗脱开始时的样品用于SDS-PAGE 分析。5. 洗脱目标蛋白:用Elution Buffer洗柱,收集每1 mL 级分,分别取10ul样品用于SDS-PAGE 分析。
比如奶糖类的样品,标准没有除蛋白的过程,如果只是溶解后过聚酰胺能不能除掉蛋白?如果用亚铁氰化钾和乙酸锌沉淀蛋白貌似会吸附一部分色素造成含量偏低,大家怎么做的?
在我的印象中元素分析仪 就是硫碳分析仪但是今天看 百度百科 http://baike.baidu.com/view/158354.htm电脑多元素一体化分析仪器 技术参数 援引美国加联数据,测量范围:(因该仪器可检测的元素较多,现以钢铁中的C、S、Mn、P、Si、Cr、Ni、Mo、Re、http://h.hiphotos.baidu.com/baike/s%3D220/sign=560c6f6f213fb80e08d166d506d02ffb/6d81800a19d8bc3ee6d06594828ba61ea9d34597.jpg 电脑多元素一体化分析仪器Mg、Fe、 Cu、Al、V、W、Ti等常见元素为例) 碳:0.001—10.00% 、 硫: 0.0005—0.5000% 、 锰0.10~15.00%、 硅0.10~5.00%、 磷0.005~0.80%、 铬0.01~25.0%、 钼0.101~6.00%、镁0.010~0.100%、 镍0.010~30.0%、 稀土0.01~0.100%、…… 如改变测试条件,该范围可相应扩大。 很多元素都可以分析。 我知道分析硫 碳 是用红外检测那分析 其他元素 靠的是什么检测手段?原理是什么啊??这些元素是同时测定?还是需要单独测定?元素分析仪 是不是就是 硫碳分析仪 还是比硫碳分析仪高级? 很困惑 请高手指教
胰岛素原料的大分子蛋白测定药典要求流速是每小时23毫升。这样测定一次就需要十几个小时。我第一次测就让仪器走了一夜。我第二次提高了近十倍的速度,结果测得的曲线几乎几乎没什么差别!在此想请教做过此实验的高手们,你们的经验是什么呢?速度真的一定要那么慢吗?
[size=14px] [/size] [size=14px]青蒿素(Arteminsinin)是从植物青蒿中分离出来的倍半萜内酯,与它的一些衍生物一起被公认为一种有效的用于治疗疟疾药物,现已逐渐被认为是潜在的抗肿瘤药物,已有一些研究试图确定青蒿素的蛋白质靶点并破译青蒿素杀死癌细胞的分子机制,但迄今为止,青蒿素的确切抗肿瘤相关靶点仍有很大挖掘空间。[/size] [size=14px] [/size] [size=14px]1、细胞毒性筛查将ART1确定为潜在的抗肿瘤药物[/size] [size=14px]作者首先制备了C-10位的不同芳基取代基的青蒿素衍生物(ART1、ART2和ART3),利用肺癌细胞系H1299和A549比较了它们以及青蒿素(QHS)及其衍生物双氢青蒿素(DHA)的抗肿瘤活性。发现ART1,一种含有萘环的青蒿素衍生物,对肺癌细胞表现出最强的细胞毒性。在肿瘤类器官模型和白血病MV4细胞中均证明ART1是最有效化合物。此外,ART1表现出对正常细胞的抗增殖活性非常弱。结果表明ART1是一种有前途的潜在抗癌药物。[/size] [size=14px]图片[/size] [size=14px]图1 ART1抑制肿瘤生长[/size] [size=14px]2、ART1诱导非经典铁死亡[/size] [size=14px]先前的报告表明青蒿素通过多种方式导致癌细胞死亡,包括细胞凋亡、自噬等。作者发现ART1触发的细胞死亡与凋亡、自噬无关。进一步确定ART1诱导癌细胞死亡的机制,发现ART1诱导的细胞死亡仅被铁死亡抑制剂ferrostatin-1(可防止脂质过氧化物的积累)抑制,而不能被细胞凋亡抑制剂z-VAD-FMK或坏死性凋亡抑制剂necrostatin-1抑制,表明ART1处理触发铁死亡。此外,ART1处理会诱导脂质过氧化,且ART1引起的脂质过氧化是铁依赖性的。深入机制研究发现ART1导致铁死亡已知类别的铁死亡诱导剂不同,它不影响其细胞内GSH水平和GPX4活性。[/size] [size=14px]图片[/size] [size=14px]图2 ART1诱导非经典铁死亡[/size] [size=14px]3、鉴定HSD17B4蛋白作为ART1的直接靶标[/size] [size=14px]为了确定ART1介导诱导铁死亡的蛋白靶点,作者设计了并合成了ART16(生物素标记的ART1)来开展Pulldown。ART16类似于ART1可诱导铁死亡,可用于后续实验。Pulldown+蛋白质组学分析显示HSD17B4蛋白为可能靶点, BLI、Pulldown+WB技术证实了两者的直接结合。[/size] [size=14px]图片[/size] [size=14px]图3 鉴定HSD17B4蛋白作为ART1的直接靶标[/size] [size=14px]4、ART1通过HSD17B4蛋白介导癌细胞死亡[/size] [size=14px]作者采用ART99(含有香豆素荧光团的ART1探针),发现ART99与靶蛋白HSD17B4的共定位。通过敲低HSD17B4来研究ART1诱导的细胞死亡是否由HSD17B4介导,发现HSD17B4敲低可显著减弱ART1的作用。[/size] [size=14px]图片[/size] [size=14px]图4 ART1通过HSD17B4蛋白介导癌细胞死亡[/size] [size=14px]5、ART1靶HSD17B4蛋白直接诱导脂质氧化[/size] [size=14px]HSD17B4蛋白是一种双功能酶,同时具有脱氢酶和水合酶活性,并参与VLCFA(极长链脂肪酸)的过氧化物酶体β氧化。作者发现ART1并未改变细胞中HSD17B4蛋白丰度,也不影响其脱氢酶和水合酶活性。由于ART1中的过氧化物部分对于诱导铁死亡是必不可少的,作者推测ART1可能是一种启动铁死亡的选择性氧化剂,与HSD17B4结合并促进周围脂质的氧化。作者验证发现ART1可以直接氧化铁死亡相关底物。PUFA,易受脂质过氧化的影响,是执行铁死亡所必需的。由于不容易获得超长链多不饱和脂肪酸,AA被用作替代物,作者发现ART1单独可以氧化AA,ART1还可以显著促进由亚铁离子催化的脂质过氧化。此外,活细胞成像探针发现ART1可以氧化细胞中HSD17B4蛋白周围的脂质。这些数据证实ART直接氧化HSD17B4蛋白周边的脂质,积累脂质过氧化物,并最终在癌细胞中促进铁死亡。[/size] [size=14px]图片[/size] [size=14px]图5 ART1靶向HSD17B4蛋白直接诱导脂质氧化[/size] [size=14px]6、ART1优先诱导高间充质状态癌细胞的铁死亡[/size] [size=14px]据报道,高间充质状态的耐药性癌细胞对铁死亡诱导剂敏感。作者检测这些肺癌细胞的上皮间充质状态,发现对ART1敏感细胞系H1299和H1838中的波形蛋白含量较高,表明高间充质状态,而对ART1耐药细胞系HCC366和H1650几乎表现出E-钙粘蛋白的丰度检测不到,这表明ART1的敏感性与癌细胞上皮间充质状态密切相关,ART1可优先诱导间充质癌细胞发生铁死亡。[/size] [size=14px]图片[/size] [size=14px]图6 ART1优先诱导高间充质状态癌细胞的铁死亡[/size] [size=14px]总结[/size] [size=14px]该研究将青蒿素衍生ART1已被确定为铁死亡诱导剂,对癌细胞增殖具有显著的抑制效果。接着使用化学蛋白质组学方法鉴定HSD17B4蛋白,一种在VLCF分解代谢中必不可少的酶,作为ART1的直接靶点。进一步研究发现ART1会导致铁死亡,通过直接氧化HSD17B4蛋白周围的脂肪酸而不干扰蛋白质的正常酶活性,揭示了一种意想不到的机制,其中ART1-HSD17B4用作“特洛伊木马”,潜入过氧化物酶体触发脂质氧化。总之,ART1通过靶向HSD17B4诱导铁死亡提供了一种有希望的癌症治疗方法。[/size]