质谱流式细胞术及其在精准医学中研究进展
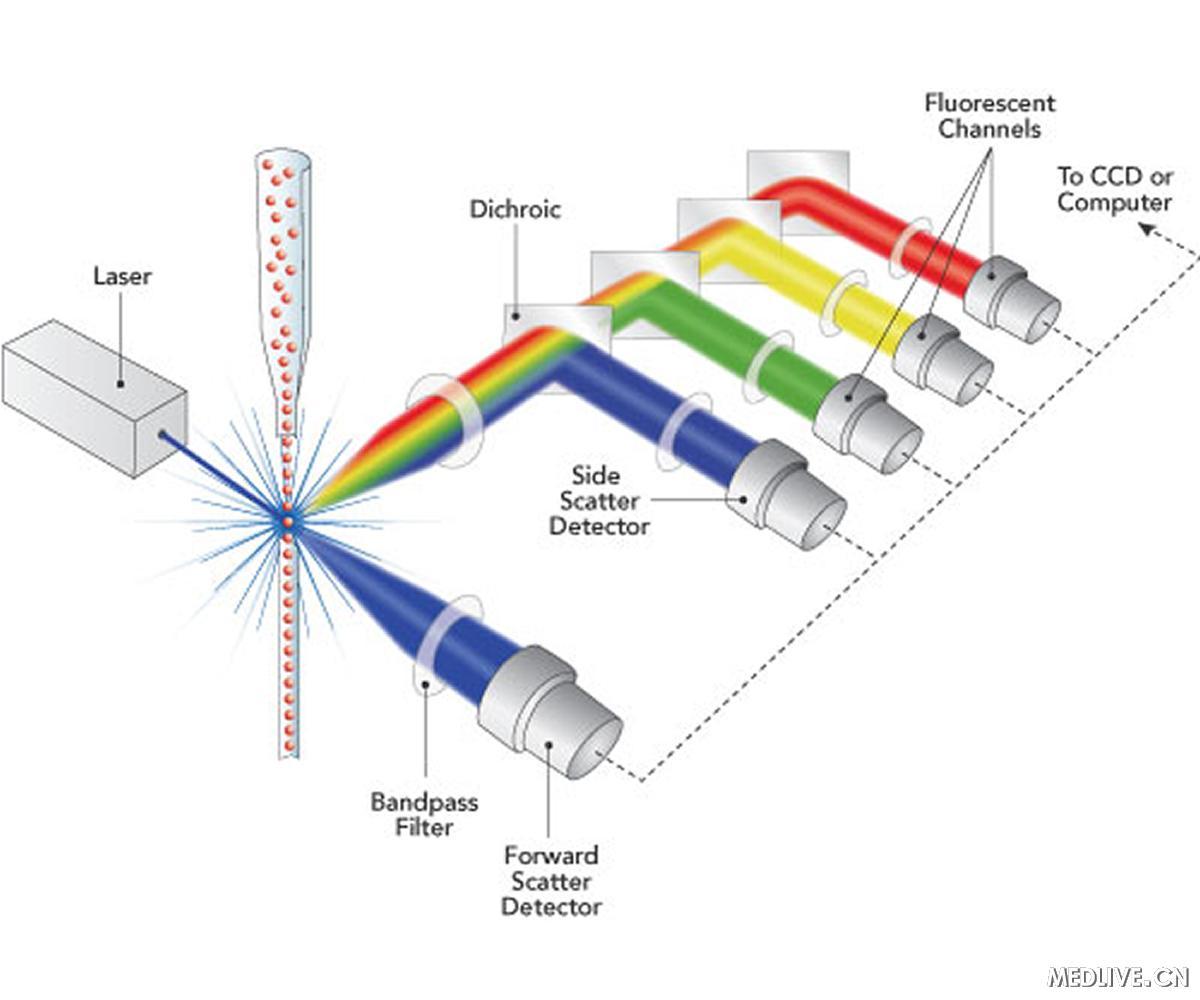
质谱流式细胞术及其在精准医学中研究进展张浩1,2,3, 韩国军1,2,31北京大学跨学部生物医学工程系;2北京大学口腔医院;3 北京大学医学部医学技术研究院。质谱流式细胞术(Mass Cytometry)是近年来应用最为广泛的单细胞技术之一种。其将流式细胞技术与质谱分析技术结合在一起,用金属同位素代替荧光标记特异性抗体或探针,并利用质谱来定量同位素标签,可以在单细胞水平完成多种生物标志物的检测分析,包括核酸、蛋白质及其它小分子。其具有高通量、高灵敏度和高稳定性等优点,尤其适合于肿瘤、免疫、血液、药物和遗传学等学科的研究。当前新冠病毒COVID-19对人体免疫系统造成严重侵害,质谱流式技术能够更深入、全面的分析人体免疫系统的各种细胞亚型及其比例的变化,并预测临床病程的变化趋势,对于早期诊断、治疗与病理研究具有重要意义。 (一) 质谱流式细胞术发展历史图 1美国斯坦福大学医学院Garry Nolan 实验室中三台质谱流式仪器: CyTOF 1, CyTOF 2,CyTOF 3 (Helios)和BD公司荧光流式细胞仪LSR II。[1]质谱流式细胞术从最初的分析方法学概念到单细胞仪器装置、最终在基础生物学与临床医学中取得重要的应用,经过近二十年的发展历程。图1为2015年美国斯坦福大学医学院免疫学与微生物学系Garry Nolan教授实验室中三台不同型号CyTOF质谱流式仪与BD公司荧光流式细胞仪同时使用的照片。回顾质谱流式细胞术的发展历史,有三位重要的科学家作出了杰出的贡献。如图2中所示,首先2002年清华大学张新荣教授在学术期刊Analytical Chemistry中第一次提出元素标记策略用于电感耦合等离子体质谱的生物大分子检测的方法学研究[2];2009年加拿大多伦多大学的Scott Tanner教授在学术期刊Analytical Chemistry中首次发布质谱流式细胞仪(Cytometry for Time of Flight,CyTOF)的研究工作[3],并成立DVS Sciences公司将传统流式细胞术与电感耦合等离子体质谱相结合,推出了首台商用质谱流式分析仪器。2011年斯坦福大学Garry Nolan教授首次将质谱流式技术成功应用于临床血癌免疫性疾病的单细胞的表型与磷酸化蛋白信号通路研究[4],开创了质谱流式医学应用的新篇章。2014年,DVS Sciences公司和质谱流式技术被美国Fluidigm公司收购,随后分别于与2015年和2017年陆续推出了Helios质谱流式系统和Hyperion组织成像系统以及700多种相关抗体和预设计标记试剂盒。目前为止,全球已经安装超过200台质谱流式细胞仪,中国拥有30台以上。并且,已经有50多个临床试验使用了质谱流式细胞术,这表明高通量、高灵敏、高稳定的质谱流式时代已经来临。图2 质谱流式细胞术三位主要奠基人:图A左一为清华大学张新荣教授;图A右一为加拿大多伦多大学Scott Tanner教授; 图B第一排右一为美国斯坦福大学Garry Nolan。(二) 质谱流式细胞术原理质谱流式细胞术主要工作原理是通过重金属同位素标记抗体或探针,然后识别细胞表面或内部信号,被标记的细胞以细胞悬液形式进入雾化器,随后样品在等离子体内发生汽化,产生离子云、离子在四级杆内根据质荷比进行筛选,然后在时间飞行器中通过已知强度的电场加速后到达检测器,而其到达检测器的飞行时间与离子质量有关。最后将原子质量谱的数据转换为细胞表面或内部的信号分子数据,并通过专业计算机分析软件对获得的数据进行降维处理分析,从而得到细胞外部表型和内部信号网络的数据结果。图3 质谱流式细胞术金属稳定同位素标记探针。包括标记单克隆抗体分子的稀土同位素;标记细胞编码的贵金属同位素;标记细胞周期的卤素[1]。北京大学韩国军教授首次建立了48种稳定同位素单克隆抗体统一标记策如图3所示,并定量分析了镧系、钇、铟、钯同位素间的CyTOF质谱干扰。系统性的建立了标准方法用于同位素标记抗体定量分析、抗体活性与选择性验证、以及抗体细胞染色浓度优化等,被多个国际质谱流式实验室作为同位素抗体标记标准手册使用。与传统流式技术相比,质谱流式细胞术主要有以下优势:① 前者使用荧光基团偶联抗体或分子,后者主要通过金属同位素进行标记,因为细胞中不含或很少含有这些金属同位素,因此背景信号较低,检测数据可靠性较高;② 传统荧光流式采用激光器和光电倍增管作为检测手段,最多可同时检测通道数不足20个,而质谱流式细胞术使用ICP-MS作为检测手段,不仅提高了检测通道数,可同时检测100个左右参数,而且避免了通道信号之间的串色干扰,无补偿或补偿非常小,使方案设计更加容易。③ 除可以在单细胞水平进行自身多参数分析以外,还可以检测分析一些金属治疗药物的分布及代谢情况,比如顺铂类化疗药物等。但质谱流式细胞术当前也存在一些问题,比如样本采集速度慢,每秒最多约1000个事件;测量不同样本之间需要程序清洁,导致每个样本平均测样时间延长;由于样本被气化,所以无法进行前向散射和侧向散射测量,也不能分选回收细胞进行后续实验等。(三)质谱流式细胞术的应用3.1 细胞表型鉴定与信号通路检测质谱流式细胞术非常适合对复杂的细胞表型进行深层次分析,可以区分在疾病发展过程中发挥不同作用的相似细胞,这对疾病的个体化治疗具有重要意义。Su等人通过对结直肠癌患者血液中的T细胞群进行质谱流式分析,展示了患者个体及不同患者之间 T 细胞亚群的表型多样性[5]。此外,Lelieveldt等用HSNE进行数据分析,在免疫细胞中发现了稀有细胞群[6]。分析细胞因子可以为研究免疫激活状态提供新的视角。Vendrame 等人利用 CyTOF评估细胞因子对自然杀伤 (NK) 细胞的影响,发现白介素 (IL)-12/IL-15/ IL-18刺激可显著增加NK细胞中γ干扰素 (IFN‐γ)的表达[7]。Doyle等对丙型肝炎病毒(HCV)感染患者的肝脏和外周血中的浆细胞样树突状细胞(pDCs)进行了研究,证明肝脏pDC具有多功能性,能够在慢性HCV感染期间产生大量的IFN-γ 和其他免疫调节因子[8]。随着检测细胞因子的报道不断增多,CyTOF将可能成为免疫细胞功能研究中不可或缺的工具。细胞受外界刺激后,细胞内信号网络会做出相应反应。使用靶向磷酸化蛋白的金属螯合抗体,CyTOF能够检测单个细胞内的信号通路。Shinko等人为临床血样提供了磷酸化信号蛋白染色的优化方案[9]。厦门大学周大旺教授团队应用 CyTOF质谱流式细胞仪发现了Hippo信号通路中转录共激活因子TAZ在调节 CD4+初始T细胞分化为Th17细胞和Treg细胞的过程中发挥着关键调控作用及其重要机理[10]。 3.2细胞周期鉴定、RNA和蛋白质的共同检测细胞周期改变是肿瘤进展、生物发育和免疫调节的重要方面。Behbehani 等人开发了一种新的CyTOF方法来描绘细胞周期阶段,分别使用IdU、磷酸化视网膜母细胞瘤抗体、细胞周期蛋白 B1抗体、细胞周期蛋白 A 抗体和磷酸化组蛋白H3抗体来标记S、G0、G1、G2、和 M 期细胞[11]。并利用这种细胞周期鉴定方法,研究展示了介导急性髓性白血病化疗敏感性的细胞周期差异[12]。为了能够在单细胞分辨率下同时检测 RNA 和蛋白质,Frei 等人开发了 RNA 邻近连接技术 (PLAYR)[13]。PLAYR包括杂交、连接、滚环扩增和检测四个阶段。针对目标RNA设计两个相邻区段的探针,与目标RNA结合后再与Backbone和Insert两个探针进行杂交,随后Backbone和Insert探针连接成一个环,做为后续滚环扩增的模板,与带有金属标签的探针杂交后就可以扩增并检测了。PLAYR的优势在于可以同时兼容蛋白检测,在实验过程中,可以先用抗体对胞内外蛋白进行标记,然后在用PLAYR流程对RNA进行原位标记和扩增。我们可以根据表面Marker对细胞进行亚群分析,深入研究每个亚群中信号通路、转录因子的激活及其相关基因的表达。并且利用PLAYR监测脂多糖刺激后PBMCs中8个细胞因子mRNA和18个蛋白表位的变化,揭示了每个细胞的功能能力与其蛋白标记物表达之间的相关性。3.3 质谱流式细胞术成像Geisen 等人使用 CyTOF 对组织样本进行成像以获得蛋白质空间组学[14]。他们提出的IMC (Imaging Mass Cytometry)技术使用分辨率为 1 μm 的激光光斑进行烧蚀、雾化、电离,并通过惰性气流传送到质谱检测器。IMC 被认为是具有里程碑意义的发展,因为它在亚细胞分辨率下将细胞间相互作用和的空间信息联系在一起,并能同时分析多达50种参数。自推出以来,IMC 正迅速被应用于各个研究领域。Damond 等人使用 IMC 对4例非糖尿病患者、4例首发1型糖尿病患者和4例长期1型糖尿病患者的胰岛进行研究,描述了人类1型糖尿病的进展,并发现在发病之前β胰岛素细胞表型已经发生改变[15]。另一类元素标记的单细胞成像技术是利用二次离子质谱SIMS(Secondary Imaging Mass Spectrometry),图4为北京大学韩国军教授利用NanoSIMS 50L质谱对Hela单细胞核中新生成的DNA与RNA的时空分析[16]。图4 基于二次离子质谱的高分辨Hela细胞核成像技术与人工智能机器学习数据分析。3.4 新冠肺炎检测及治疗 Silvin等人对COVID-19 患者外周血进行单细胞CyTOF及RNA测序,发现血浆内钙结合蛋白水平和非典型单核细胞减少可以鉴别严重的COVID-19患者[17]。Schrepping等人对全血和外周血单个核细胞进行RNA测序和单细胞蛋白质组学分析,揭示了SARS-CoV-2感染后免疫系统的反应[18]。而Rendeiro等人利用质谱流式细胞术进行空间成像,研究包括SARS-CoV-2 感染在内的人类急性肺损伤的细胞组成和空间结构。从而使我们能够从结构、免疫学和临床角度提出生物学上可解释的肺病理图谱,为理解COVID-19和一般的肺损伤病理学提供了重要的基础[19]。(四)总结质谱流式细胞术相较传统荧光流式细胞技术具有可以同时检测更多参数不需补偿、方案设计简单、灵敏度高等优点。其多参数检测的特征尤其适合对细胞表型、细胞因子、信号通路等进行深层次分析,适用于肿瘤、免疫系统疾病、传染病、血液病、药物临床试验、预后评估等方面研究。但质谱流式细胞术也存在采样较慢、清洁费时、成本较高等问题,因此还需研究人员根据自己的实验目的及需求进行选择。参考文献:1. Han GJ, Spitzer MH, Bendall SC, et al. Metal‐isotope‐tagged monoclonal antibodies for high‐dimensional mass cytometry[J]. Nat Protoc, 2018 13(10):2121-2148. DOI: 10.1038/s41596-018-0016-7.2. C. Zhang, Z. Y. Zhang, B. B. Yu, J. J. Shi, X. R. Zhang. Application fo the biological conjugate between antibody and colloid Au nanoparticle as analyte to inductively coupled plasma spectrometry. Anal.Chem. 20023. Bandura DR, Baranov VI, Ornatsky OI, et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time - of - flight masss pectrometry[J]. Anal Chem, 2009 81(16):6813-22. DOI: 10.1021/ac901049w.4. Bendall SC, Simonds EF, Qiu P, et al. Single‐cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum[J]. Science, 2011 332(6030):687-96. DOI: 10.1126/science.1198704.5. Di J, Liu M, Fan Y, et al. Phenotype molding of T cells in colorectal cancer by single‐cell analysis[J]. Int J Cancer. 2020 146(8):2281‐2295. DOI:10.1002/ijc.32856.6. van Unen V, Hollt T, Pezzotti N, et al. Visual analysis of mass cytometry data by hierarchical stochastic neighbour embedding reveals rare cell types[J]. Nat Commun. 2017 8(1):1740. DOI:10.1038/s41467-017-01689-9.7. Vendrame E, Fukuyama J, Strauss‐Albee DM, et al. Mass cytometry analytical approaches reveal cytokine‐induced changes in natural killer cells[J]. Cytometry B Clin Cytom. 2017 92(1):57‐67. DOI:10.1002/cyto.b.21500.8. Doyle EH, Rahman A, Aloman C, et al. Individual liver plasmacytoid dendritic cells are capable of producing IFNalpha and multiple additional cytokines during chronic HCV infection[J]. PLoS Pathog. 2019 15(7):e1007935. DOI:10.1371/journal.ppat.1007935.9. Shinko D, Ashhurst TM, McGuire HM, et al. Staining of phosphorylated signalling markers protocol for mass cytometry[J]. Methods Mol Biol. 2019 1989:139‐146. DOI:10.1007/978-1-4939-9454-0_10.10. Geng J, Yu S, Zhao H, et al. The transcriptional coactivator TAZ regulates reciprocal differentiation of TH17 cells and Treg cells[J]. Nat Immunol, 2017 18(7):800-812. DOI: 10.1038/ni.3748. 11. Behbehani GK, Bendall SC, Clutter MR, et al. Single‐cell mass cytometry adapted to measurements of the cell cycle[J]. Cytometry A. 2012 81(7):552‐566. DOI:10.1002/cyto.a.22075.12. Behbehani GK, Samusik N, Bjornson ZB, et al. Mass cytometric functional profiling of acute myeloid leukemia defines cell‐cycle and immunophenotypic properties that correlate with known responses to therapy[J]. Cancer Discov. 2015 5(9):988‐1003. DOI:10.1158/2159-8290.CD-15-0298.13. Frei AP, Bava FA, Zunder ER, et al. Highly multiplexed simultaneous detection of RNAs and proteins in single cells[J]. Nat Methods. 2016 13(3):269‐275. DOI:10.1038/nmeth.3742. 14. Giesen C, Wang HA, Schapiro D, et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry[J]. Nat Methods. 2014 11(4):417‐422. DOI:10.1038/nmeth.2869.15. Damond N, Engler S, Zanotelli VRT, et al. A map of human type 1 diabetes progression by imaging mass cytometry[J]. Cell Metab. 2019 29(3):755‐768.e5. DOI:10.1016/j.cmet.2018.11.014.16. Coskun. A. F., Guojun Han, Ganesh S. et al. Nanoscopic subcellular imaging enabled by ion beam tomography, Nature Communications, 2021, 12(789)17. Silvin A, Chapuis N, Dunsmore G, et al. Elevated Calprotectin and Abnormal Myeloid Cell Subsets Discriminate Severe from Mild COVID-19[J]. Cell, 2020 182(6):1401-1418.e18. DOI: 10.1016/j.cell.2020.08.002.18. Schulte-Schrepping J, Reusch N, Paclik D, et al. Severe COVID-19 Is Marked by a Dysregulated Myeloid Cell Compartment[J]. Cell, 2020 182(6):1419-1440.e23. DOI:10.1016/j.cell.2020.08.001. 19. Rendeiro AF, Ravichandran H, Bram Y, et al. The spatial landscape of lung pathology during COVID-19 progression[J]. Nature, 2021 593(7860):564-569. DOI:10.1038/s41586-021-03475-6. 【作者简介】张浩 博士 2020级北京大学口腔医学技术专业科研型博士,导师韩国军教授。硕士就读于山东大学口腔医院(导师刘少华教授),从事血管瘤临床治疗及泡沫硬化剂的改良研究,发表SCI论文4篇。目前师从韩国军教授,主要从事口腔鳞癌单细胞质谱研究及质谱病理诊断新方法研究。韩国军 研究员北京大学跨学部生物医学工程系研究员、博士生导师,北京大学口腔医院双聘博士生导师。2013年毕业于清华大学化学系(导师张新荣教授),2013至2020年在美国斯坦福大学医学院Mass Cytometry创始人Garry Nolan课题组从事新一代质谱流式相关技术与临床医学应用研究。曾获教育部自然科学一等奖,并在Nature Communications、Nature Protocols、Cell Reports、Angew Chem、Anal Chem、Cytometry等发表论文20余篇。目前主要从事质谱新技术在临床医学中应用研究,与北京大学口腔医院、北京大学第三医院、北京大学第一医院开展单细胞质谱流式临床精准医学研究。点击查看流式细胞仪专场Webinar预告(点击报名)专家约稿招募:若您有生命科学相关研究、技术、应用、经验等愿意以约稿形式共享,欢迎邮件投稿或沟通邮箱:liuld@instrument.com.cn微信/电话:13683372576扫码关注【3i生仪社】,解锁生命科学行业资讯!